Gruczolakorak płuc - Adenocarcinoma of the lung
| gruczolakorak płuc | |
|---|---|
| Inne nazwy | gruczolakorak płuc |
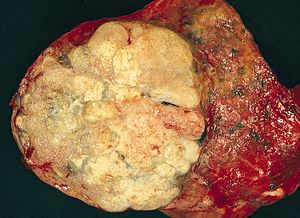 | |
| Wycinek patologiczny gruczolakoraka płuca usunięty podczas lobektomii . | |
| Specjalność | Onkologia |
Gruczolakorak płuca jest najczęstszym rodzajem raka płuca i podobnie jak inne formy raka płuca charakteryzuje się odrębnymi cechami komórkowymi i molekularnymi. Jest klasyfikowany jako jeden z kilku niedrobnokomórkowych raków płuca (NSCLC), aby odróżnić go od drobnokomórkowego raka płuca, który ma inne zachowanie i rokowanie. Gruczolakorak płuc jest dalej klasyfikowany na kilka podtypów i wariantów. Objawy tego specyficznego typu raka płuca są podobne do innych postaci raka płuca, a pacjenci najczęściej skarżą się na uporczywy kaszel i duszność.
Gruczolakorak występuje częściej u pacjentów z historią palenia papierosów i jest najczęstszą postacią raka płuc u młodszych kobiet i populacji azjatyckiej. Patofizjologia gruczolakoraka jest skomplikowana, ale generalnie wynika z progresji histologicznej od komórek znajdujących się w zdrowych płucach do komórek wyraźnie dysmorficznych lub nieregularnych. Istnieje kilka odrębnych szlaków molekularnych i genetycznych, które przyczyniają się do tego postępu. Podobnie jak w przypadku wielu nowotworów płuc, gruczolakorak płuc jest często zaawansowany w momencie postawienia diagnozy. Po zidentyfikowaniu zmiany lub guza za pomocą różnych metod obrazowania, takich jak tomografia komputerowa (CT) lub prześwietlenie rentgenowskie , wymagana jest biopsja w celu potwierdzenia diagnozy.
Leczenie tego raka płuca opiera się na określonym podtypie i zasięgu rozprzestrzeniania się z guza pierwotnego. Resekcja chirurgiczna, chemioterapia , radioterapia , terapia celowana i immunoterapia są stosowane w próbie zwalczenia komórek rakowych w oparciu o te czynniki.
objawy i symptomy
Większość pacjentów, u których zdiagnozowano raka płuca, zwykle ma chorobę miejscowo zaawansowaną lub przerzutową. Tylko około jedna trzecia pacjentów ma chorobę w stadium I w momencie rozpoznania. Objawy, które wykazuje pacjent, zwykle odzwierciedlają stopień rozprzestrzeniania się nowotworu. Wcześnie wykryte nowotwory płuc mogą powodować objawy zlokalizowane w układzie oddechowym. Jednak zaawansowany rak płuc spowoduje, że pacjenci będą odczuwać dodatkowe oznaki i objawy wtórne do rozprzestrzeniania się raka na inne układy narządów. W kolejności od najwyższej częstości najczęstsze objawy raka płuc to:
- kaszel, który nie ustępuje lub się nasila
- utrata wagi
- duszność (duszność lub trudności w oddychaniu)
- ból w klatce piersiowej, który może nasilać się przy głębokim oddychaniu, kaszlu lub śmiechu
- krwioplucie (kaszel krwi lub rdzawej flegmy)
- ból kości
- clubbing
- gorączka
- ogólnie czuje się zmęczony lub słaby
- niedrożność żyły głównej górnej – obrzęk twarzy, szyi, górnej części tułowia. Jest to spowodowane uciskiem układu naczyniowego przez guz płuca, który ogranicza powrót krwi z górnej części ciała.
- dysfagia (problemy z przełykaniem lub uczucie, że coś chwyta się w gardło) i chrypka
- nowy początek świszczącego oddechu bez astmy w wywiadzie
Lekarze powinni mieć duże podejrzenie raka płuc, zwłaszcza u pacjentów z paleniem w wywiadzie. Pacjenci z nawracającymi lub nieustępującymi infekcjami płuc (np. zapalenie oskrzeli i zapalenie płuc), które nie reagują na antybiotyki, również powinni być poddani dalszej ocenie pod kątem raka płuc. U osób niepalących kobiety i osoby z Azji Wschodniej są bardziej narażone na objawy raka płuc w młodszym wieku. Co ważne, wiele z tych objawów jest zwykle spowodowanych innymi przyczynami, które nie są rakiem. Od każdego pacjenta należy uzyskać szczegółową historię medyczną, aby określić znaczenie dalszych badań diagnostycznych i leczenia.
Objawy pozapłucne
Gruczolakorak, podobnie jak inne formy raka płuca, jest zwykle zaawansowany lub przerzutowy w momencie rozpoznania. Pacjenci mogą skarżyć się na oznaki lub objawy poza drogami oddechowymi, które stanowią powikłanie hematologiczne lub metaboliczne nowotworu, jednak niekoniecznie wynikające z niedrożności lub przerzutów. Noszą one nazwę zespołów paranowotworowych , które często wskazują na zaawansowaną chorobę i gorsze rokowanie. Poniżej opisano najczęstsze zespoły paranowotworowe związane z gruczolakorakiem płuc:
- Hiperkalcemia złośliwa występuje częściej w raku płaskonabłonkowym płuc, ale może również wystąpić w gruczolakoraku. Peptyd związany z parathormonem (PTHrP) jest wytwarzany przez komórki nowotworowe i działa podobnie do parathormonu (PTH). Produkcja tego hormonalnie aktywnego peptydu przez komórki nowotworowe powoduje zwiększoną resorpcję kości poprzez regulację w górę osteoklastów, jednej z komórek odpowiedzialnych za przebudowę kości. Kiedy kości ulegają rozkładowi, wapń jest uwalniany do krwioobiegu, powodując hiperkalcemię. Oznaki i objawy podwyższonego poziomu wapnia we krwi obejmują: pragnienie, zmęczenie, zaparcia, wielomocz (zwiększone oddawanie moczu) i nudności. Ważne jest, aby wykluczyć przerzuty do kości u pacjentów z NSCLC, ponieważ występują u nich również hiperkalcemia.
- Przerostowa osteoartropatia płuc (HPO) występuje dość rzadko w gruczolakoraku. Mniej niż 1% pacjentów z gruczolakorakiem płuca wykaże to stwierdzenie, ale gdy już się pojawi, jest to słaby czynnik prognostyczny. Dokładny mechanizm HPO nie jest znany, ale uważa się, że w etiologii jest hormonalny lub neurogenny. Triada HPO obejmuje pałkę dystalną, zapalenie stawów i obustronne symetryczne tworzenie się okostnej.
Przyczyny
Czynniki ryzyka
Według Nurses' Health Study , ryzyko gruczolakoraka płuc znacznie wzrasta po długim okresie palenia tytoniu : palacze, którzy wcześniej palili 30-40 lat, są ponad dwukrotnie bardziej narażeni na rozwój gruczolakoraka płuc w porównaniu z osobami, które nigdy nie paliły ( ryzyko względne około 2,4); okres dłuższy niż 40 lat zwiększa ryzyko względne do 5.
Rak ten jest zwykle obserwowany obwodowo w płucach, w przeciwieństwie do drobnokomórkowego raka płuca i płaskonabłonkowego raka płuca, które są zwykle zlokalizowane bardziej centralnie, chociaż może również występować jako zmiany centralne. Z nieznanych przyczyn często powstaje w związku z bliznami obwodowymi płuc. Obecna teoria mówi, że blizna prawdopodobnie pojawiła się wtórnie do guza, a nie powodowała guza. Gruczolakorak występuje częściej u palaczy i jest najczęstszym rodzajem raka płuc u kobiet i niepalących. Głębsze wdychanie dymu papierosowego powoduje zmiany obwodowe, które często występują w gruczolakoraku płuc. Ogólnie rzecz biorąc, gruczolakorak rośnie wolniej i tworzy mniejsze masy niż inne podtypy. Jednak ma tendencję do tworzenia przerzutów na wczesnym etapie.
Mechanizm
Patogeneza
Badania na dużą skalę, takie jak The Cancer Genome Atlas (TCGA) , systematycznie scharakteryzowały nawracające zmiany somatyczne, które prawdopodobnie napędzają inicjację i rozwój gruczolakoraka płuc.
Mutacje genów i zmiany liczby kopii
Ponieważ palenie tytoniu jest silnym czynnikiem mutagennym, gruczolakorak płuc jest jednym z typów nowotworów o największej liczbie mutacji. Powszechne mutacje somatyczne w gruczolakoraku płuc wpływają na wiele onkogenów i genów supresorowych nowotworów , w tym TP53 (zmutowany w 46% przypadków), EGFR (27%), KRAS (32%), KEAP1 , STK11 i NF1 . Mutacje EGFR i KRAS pojawiają się w sposób wykluczający się nawzajem. Mutacje KRAS są związane z nałogiem palenia, natomiast mutacje EGFR występują częściej u kobiet, osób pochodzenia azjatyckiego i osób nigdy nie palących.
Opisano amplifikację liczby kopii w onkogenach, takich jak TERT , MDM2 , EGFR, MET i MYC , a także delecje genów supresorowych nowotworów, takich jak CDKN2A .
Częste zmiany zachodzą w genach należących do szlaku receptorowej kinazy tyrozynowej , czego najbardziej widocznym przykładem jest EGFR. Szlak ten bierze udział w proliferacji i przeżyciu komórek, a w przypadku raka często ulega deregulacji. W konsekwencji opracowano terapie celowane, które hamują zmutowane elementy szlaku.
Rearanżacje chromosomowe
Trzy receptory kinazy tyrozynowej związane z błoną są nawracające zaangażowane w fuzje lub rearanżacje w gruczolakoraku : ALK , ROS1 i RET , oraz ponad osiemdziesiąt innych translokacji również opisano w gruczolakoraku płuc.
W rearanżacjach ALK najczęstszym genem partnerskim jest EML4. Fuzje EML4-ALK mają tendencję do występowania w guzach, które nie niosą mutacji EGFR lub KRAS i mają również mniejszą częstotliwość mutacji TP53. Fuzje ALK i ROS stwarzają możliwości dla terapii celowanych z użyciem inhibitorów kinazy tyrozynowej.
Patofizjologia
Drogi oddechowe można podzielić na dwa główne elementy: drogi oddechowe przewodzące i drogi oddechowe wymiany gazowej. Drogi oddechowe do wymiany gazowej zbudowane są z pęcherzyków, czyli małych mikroskopijnych worków powietrznych, które odpowiadają za wymianę tlenu i dwutlenku węgla podczas normalnego oddychania. Pęcherzyki płucne składają się z dwóch typów komórek, pneumocytów typu I i typu II. Pneumocyty typu I pokrywają 95% powierzchni pęcherzyków i nie są zdolne do regeneracji. Pneumocyty typu II są bardziej powszechne, stanowiąc 60% komórek w nabłonku wyrostka zębodołowego, ale stanowią tylko 3% powierzchni wyrostka zębodołowego.
Istnieje kilka czynników, które przyczyniają się do przekształcenia prawidłowego nabłonka pęcherzyków płucnych w zmiany dysplastyczne lub przedrakowe. Gruczolakorak płuca rozwija się stopniowo, w miarę jak pneumocyty typu II przechodzą kolejne zmiany molekularne, które zakłócają normalną regulację i obrót komórek. Atypowy rozrost gruczolakowaty (AAH) jest uważany za zmianę przedrakową i uważa się, że powoduje dalszy postęp w gruczolakoraka in situ i inwazyjnego gruczolakoraka płuc. Zmiany AAH są mniejsze niż 5 mm, mogą być pojedyncze lub mnogie i mają wygląd matowej szyby w obrazowaniu TK. W miarę gromadzenia się większej liczby mutacji genetycznych i rozregulowania prawidłowych szlaków sygnałowych komórek, AAH może przejść do gruczolakoraka in situ (AIS). Zmiany AIS klasyfikuje się jako małe guzy <3 cm z nieprawidłowym wzrostem komórek pneumocytów typu II, ograniczonym do przestrzeni pęcherzykowych, tj. bez naciekania do podścieliska, opłucnej lub układu naczyniowego. Ten typ wzrostu jest określany jako „lepidowy” i jest charakterystyczny dla gruczolakoraka płuc w jego najwcześniejszych stadiach.
Diagnoza
Rozpoznanie raka płuca można podejrzewać na podstawie typowych objawów , szczególnie u osoby palącej w przeszłości. Objawy, takie jak odkrztuszanie krwi i niezamierzona utrata masy ciała, mogą skłonić do dalszych badań, takich jak obrazowanie medyczne .
Klasyfikacja
Większość raków płuca można scharakteryzować jako drobnokomórkowy rak płuca (SCLC) lub niedrobnokomórkowy rak płuca (NSCLC). Gruczolakorak płuc jest jednym z trzech głównych podtypów NSCLC, które obejmują również raka płaskonabłonkowego i raka wielkokomórkowego .
Historycznie toczyło się wiele dyskusji na temat najdokładniejszej metody opisywania gruczolakoraka płuc i opublikowano kilka wersji systemów klasyfikacji. Ostatnio w 2011 r. opublikowano Międzynarodową Multidyscyplinarną Klasyfikację Gruczolakoraka Płuc, która reprezentuje konsensus kilku organizacji, aby dokładniej opisać ten specyficzny typ raka płuca. . Obecny system klasyfikacji ma na celu bardziej wiarygodną prognozę rokowania i określenie postępowania terapeutycznego.
Przy ustalaniu klasyfikacji bierze się pod uwagę wielkość guza, wzór wzrostu komórek i głębokość inwazji komórek do prawidłowej tkanki płucnej. Następujące nazwy przedstawiają stopniową progresję patologiczną w naturalnym przebiegu rozwoju gruczolakoraka; gruczolakorak in situ (AIS), małoinwazyjny gruczolakorak (MIA) i inwazyjny rak gruczołowy. Inwazyjny gruczolakorak płuc obejmuje niejednorodną mieszaninę podtypów i wariantów.
Konsensus z 2011 r. opisuje pięć podtypów inwazyjnego gruczolakoraka w oparciu o dominujący wzór komórkowy. Te podtypy są opisane poniżej:
- lepidowa przewaga
- z przewagą groniastych
- dominujący brodawkowaty
- dominacja mikrobrodawkowata
- dominacja ciała stałego z produkcją mucyny
Wzorce komórkowe identyfikujące podtypy są związane z rokowaniem, od korzystnego (lepidowy) przez pośredni (papilarny i brodawkowaty) do złego (mikrobrodawkowaty i lity).
Obecna klasyfikacja obejmuje również cztery odrębne warianty inwazyjnego gruczolakoraka, których nie można przypisać do tych pięciu podtypów:
- inwazyjny gruczolakorak śluzowy
- gruczolakorak koloidalny
- gruczolakorak płodu
- gruczolakorak jelit
Obrazowanie
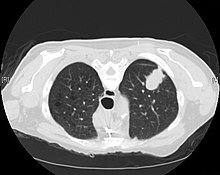
Prześwietlenie klatki piersiowej ( radiografia ) jest często pierwszym badaniem obrazowym wykonywanym, gdy dana osoba ma kaszel lub ból w klatce piersiowej, szczególnie w warunkach podstawowej opieki zdrowotnej. Radiogram klatki piersiowej może wykryć guzek/masę w płucu sugerujące raka, chociaż czułość i swoistość są ograniczone.
Obrazowanie CT zapewnia lepszą ocenę płuc, z wyższą czułością i swoistością dla raka płuca w porównaniu z radiogramem klatki piersiowej (chociaż nadal znaczący odsetek wyników fałszywie dodatnich). Tomografia komputerowa (CT), która jest specjalnie ukierunkowana na ocenę raka płuc, obejmuje klatkę piersiową i górną część brzucha. Pozwala to na ocenę innych istotnych struktur anatomicznych, takich jak pobliskie węzły chłonne, nadnercza, wątroba i kości, które mogą wykazywać oznaki przerzutowego rozprzestrzeniania się choroby. Rzeczywiście, USA Profilaktyczna Services Task Force zaleca coroczne badania przesiewowe z lat małą dawką CT u osób dorosłych w wieku 55 do 80, którzy mają 30 paczkolata historię palenia i aktualnie palą lub mają zakończyć w ciągu ostatnich 15 lat, z pewnymi zastrzeżeniami (zob Lung badania przesiewowe w kierunku raka ).
Obrazowanie w medycynie nuklearnej, takie jak PET/CT i skanowanie kości , może być również pomocne w diagnozowaniu i wykrywaniu przerzutów w innych częściach ciała. PET/CT wykorzystuje metabolicznie aktywny znacznik, który pozwala klinicystom zidentyfikować obszary ciała, które są hipermetaboliczne. Zwiększony wychwyt znacznika występuje w komórkach nowotworowych i obszarach zapalenia lub infekcji. Integracja obrazowania odzwierciedlającego aktywność metaboliczną z normalnym obrazowaniem CT pozwala na wyższą czułość i swoistość w porównaniu z samym PET .
MRI jest zarezerwowane dla pacjentów z zaawansowaną chorobą, u których prawdopodobne jest zajęcie wewnątrzczaszkowe lub mózgowe. Jest również pomocny w ocenie rozległości ściany klatki piersiowej, przepony, splotu ramiennego (np. w przypadku guzów bruzdy górnej ) lub zajęcia kręgosłupa.
Histopatologia
Jeśli to możliwe, wykonuje się biopsję każdego podejrzanego guza płuca w celu dokonania oceny mikroskopowej zaangażowanych komórek i jest ostatecznie wymagana do potwierdzenia diagnozy. Biopsję należy najpierw wykonać w przypadku zmian odległych, aby ustalić rozpoznanie histologiczne i jednocześnie potwierdzić stopień zaawansowania przerzutów. Materiał z biopsji służy również do analizy, czy nowotwór wyraża jakieś specyficzne mutacje odpowiednie do terapii tagagenem (np. mutacja EGFR lub mutacja ALK). Biopsję można wykonać za pomocą bronchoskopii, przezklatkowej biopsji igłowej i chirurgii torakoskopowej wspomaganej wideo (VATS).
Wykazano, że cytologia plwociny ma ograniczoną użyteczność, jednak w przypadku obecności wysięku opłucnowego należy wykonać torakocentezę lub aspirację płynu opłucnowego za pomocą igły pod kontrolą USG . Gdy złośliwe komórki zostaną zidentyfikowane w aspiracji opłucnej pacjentów z dużym podejrzeniem raka płuc, ustala się ostateczną diagnozę i stopień zaawansowania (gruczolakorak płuca IV stadium).
Gruczolakorak płuc ma tendencję do barwienia mucyny dodatniej, ponieważ pochodzi ona z gruczołów płucnych wytwarzających śluz. Podobnie jak w przypadku innych gruczolakoraków, jeśli nowotwór ten jest dobrze zróżnicowany (niski stopień złośliwości), będzie przypominał prawidłową strukturę gruczołową. Słabo zróżnicowany gruczolakorak nie będzie przypominał normalnych gruczołów (wysokiego stopnia) i zostanie wykryty przez stwierdzenie, że wybarwiają się na obecność mucyny (którą gruczoły produkują). Gruczolakoraka można również odróżnić poprzez barwienie TTF-1 , markera komórkowego dla gruczolakoraka.
Jak omówiono wcześniej, kategoria gruczolakoraka obejmuje szereg podtypów, a każdy guz ma tendencję do niejednorodnego składu. Kilka głównych podtypów jest obecnie uznanych przez Światową Organizację Zdrowia (WHO) i Międzynarodowe Stowarzyszenie Badań nad Rakiem Płuc (IASLC) / Amerykańskie Towarzystwo Klatki Piersiowej (ATS) / Europejskie Towarzystwo Układu Oddechowego (ERS): gruczolakorak z przewagą lepidów, gruczolakorak z przewagą groniak, dominujący gruczolakorak brodawkowaty, dominujący gruczolakorak mikrobrodawkowaty, dominujący gruczolakorak lity i dominujący gruczolakorak lity z wytwarzaniem mucyny. Aż w 80% tych guzów zostaną rozpoznane składniki więcej niż jednego podtypu. Guzy po resekcji chirurgicznej powinny być klasyfikowane za pomocą kompleksowego podtypu histologicznego, opisującego wzorce zajęcia w przyrostach co 5%. Do ogólnej klasyfikacji guza stosuje się następnie dominujący podtyp histologiczny. Dominujący podtyp jest prognostycznym przeżyciem po całkowitej resekcji.
Aby ujawnić linię gruczolakoraka wariantu litego, można wykazać wewnątrzkomórkową produkcję mucyny. W nabłonku bliższym gruczolakorakom mogą występować ogniska metaplazji płaskonabłonkowej i dysplazji, ale nie są to zmiany prekursorowe dla tego guza. Prekursor gruczolakoraków obwodowych nazwano raczej atypowym rozrostem gruczolakowatym (AAH). Mikroskopowo AAH jest dobrze odgraniczonym ogniskiem proliferacji nabłonka, zawierającym komórki prostopadłościenne do niskokolumnowych przypominające komórki klubowe lub pneumocyty typu II . Wykazują one różne stopnie atypii cytologicznej, w tym hiperchromazę , pleomorfizm , wydatne jąderka . Jednak atypia nie jest w takim stopniu, jak w przypadku szczerych gruczolakoraków. Zmiany AAH są monoklonalne i mają wiele wspólnych aberracji molekularnych (takich jak mutacje KRAS ), które są związane z gruczolakorakiem.
Gruczolakorak sygnetowy i jasnokomórkowy nie są już podtypami histologicznymi, lecz cechami cytologicznymi, które mogą występować w komórkach nowotworowych wielu podtypów histologicznych, najczęściej gruczolakoraka litego.
Leczenie
Leczenie gruczolakoraka płuc zależy od kilku czynników, w tym stopnia zaawansowania , możliwości resekcji, stanu sprawności , histologii i zmian genomowych nabytych przez pojedynczy nowotwór. Podobnie jak w przypadku większości typów nowotworów, metody leczenia można ogólnie podzielić na 5 kategorii: chirurgia, chemioterapia, radioterapia, terapia celowana i immunoterapia.
Operacja
Gruczolakorak płuc we wczesnym stadium (I, II i IIIA) jest zwykle leczony chirurgicznie w celu usunięcia guza za pomocą pneumonektomii lub lobektomii , jeśli w badaniach obrazowych i biopsjach okaże się, że można go wyciąć, oraz jeśli uważa się, że pacjent toleruje operację. Często stosowana jest chirurgia torakoskopowa wspomagana wideo (VATS), która polega na wprowadzeniu toroskopu do małego nacięcia wykonanego w klatce piersiowej; przez to małe nacięcie można usunąć płatek.

Chemoterapia
W przypadku zaawansowanych (stadium IV) i nieoperacyjnych guzów płuca leczeniem pierwszego rzutu jest chemioterapia dwulekowa oparta na platynie, łącząca cisplatynę lub karboplatynę z innym środkiem cytotoksycznym. Schematy silnie zależą od stanu sprawności i odpowiedzi każdego pacjenta, a gdy ryzyko zdarzeń niepożądanych może znacząco pogorszyć jakość życia, bardziej zalecana jest podstawowa opieka wspomagająca. Chemioterapia jest również stosowana jako terapia adiuwantowa po zabiegu chirurgicznym w celu zabicia pozostałych komórek nowotworowych u pacjentów z NSCLC w stadium IIA, IIB i IIIA.
Radioterapia
Gruczolakorak jest niedrobnokomórkowym rakiem płuc i nie jest tak wrażliwy na radioterapię jak rak drobnokomórkowy . Jednak radioterapia może być stosowana jako terapia uzupełniająca u pacjentów, którzy przeszli operację resekcji w celu zmniejszenia ryzyka nawrotu raka płuca. Może również przynieść korzyści nieoperacyjnym guzom zlokalizowanym w klatce piersiowej i stanowić część opieki paliatywnej w celu poprawy jakości życia pacjentów, którzy nie reagują na operację lub chemioterapię.
Terapia celowana
W przypadku gruczolakoraków płuc o określonych cechach molekularnych dostępna jest terapia celowana . Inhibitory kinazy tyrozynowej (TKI) zostały opracowane w celu ukierunkowania na zmutowane elementy szlaku receptorowej kinazy tyrozynowej, takie jak EGFR, ALK i ROS1, które wykazują częste zmiany w gruczolakoraku płuc.
Wykazano, że TKI pierwszej generacji EGFR, w tym gefitynib i erlotynib , są bardziej skuteczne w leczeniu pacjentów z mutacją EGFR w odniesieniu do chemioterapii cytotoksycznej. Inhibitory drugiej generacji, takie jak afatynib i dakomitynib, mają szerszy zakres zastosowania, ponieważ są w stanie celować nie tylko w samo białko EGFR , ale także w innych członków rodziny EGFR , takich jak HER2 i HER4 (znane również jako ERBB2 i ERBB4), i wykazali lepsze przeżycie bez progresji choroby w porównaniu z gefitynibem. Ponieważ najczęstszą przyczyną nabytej oporności na TKI pierwszej generacji jest druga mutacja EGFR w kodonie 790, opracowano TKI trzeciej generacji EGFR, ozymertynib , również dla tej nowej mutacji. Amplifikacja MET jest kolejnym znanym mechanizmem nabytej oporności.
Inhibitory ALK, takie jak kryzotynib, okazały się skuteczne przeciwko nowotworom niosącym fuzje ALK. Większość pacjentów wcześniej leczonych kryzotynibem odniosła korzyść z zastosowania inhibitorów ALK drugiej generacji , w tym cerytynib , alektynib i brygatynib . Oporność na inhibitory ALK może wystąpić w przypadku nowych nabytych mutacji lub amplifikacji ALK.
Również nowotwory ROS1-dodatnie wykazały wysoką wrażliwość na inhibitory ALK ze względu na wysoką homologię między domenami kinazowymi ROS1 i ALK.
Immunoterapia
Odpowiedzi immunologicznej można zapobiegać poprzez aktywację immunologicznych punktów kontrolnych , które polegają na wiązaniu białka ligandu (np. PD-L1 ) z receptorem (np. PD-1 ) na powierzchni komórki odpornościowej. W konsekwencji komórki nowotworowe wyrażające PD-L1 mogą inaktywować komórki T, co sprzyja wzrostowi guza. Inhibitory immunologicznego punktu kontrolnego zostały opracowane w celu przywrócenia odporności przeciwnowotworowej, w której pośredniczą limfocyty T, poprzez blokowanie ligandu lub receptora.
Inhibitory immunologicznego punktu kontrolnego zostały zatwierdzone do leczenia NSCLC, w tym niwolumab anty-PD-1 i pembrolizumab . Leki anty-PD-1 stosuje się u pacjentów z zaawansowanym NSCLC, u których nowotwór postępuje po chemioterapii cytotoksycznej pierwszego rzutu. Pembrolizumab został ustanowiony jako nowy standard opieki dla pacjentów z zaawansowanym lub przerzutowym NSCLC z wysokim poziomem ekspresji PD-L1, a odpowiedzi są jeszcze bardziej wyraźne w przypadku guza o wysokim obciążeniu mutacjami (tj. posiadającego podwyższoną liczbę mutacji).
Podejścia terapeutyczne łączące wiele inhibitorów immunologicznych punktów kontrolnych lub jeden inhibitor immunologicznych punktów kontrolnych i środek cytotoksyczny są w trakcie badań klinicznych od 2018 r. Badana jest również potencjalna rola leków anty-PD-1 jako terapii neoadiuwantowej w resekcyjnych NSCLC.
Epidemiologia
Podobnie jak w przypadku innych podtypów raka płuc, częstość występowania gruczolakoraka płuc jest silnie związana z paleniem.
Zapadalność na gruczolakoraka płuca wzrosła w wielu rozwiniętych krajach zachodnich w ciągu ostatnich kilku dekad, osiągając 43,3% wszystkich nowotworów płuc w USA w 2012 r., zastępując tym samym raka płaskonabłonkowego płuca jako najczęstszy typ raka płuca. Można to w dużej mierze przypisać zmniejszającej się liczbie osób palących, co sprzyja histologii gruczolakoraka. Rzeczywiście, chociaż palenie nadal jest najsilniejszym czynnikiem ryzyka, gruczolakorak płuc jest zdecydowanie najczęstszy wśród osób niepalących przez całe życie (<100 papierosów w ciągu życia).