Przeciwciało przeciw cytoplazmie neutrofili - Anti-neutrophil cytoplasmic antibody

Anty-neutrofili cytoplazmatyczne przeciwciała ( Ancas ) są grupą przeciwciał , głównie z IgG typu, wobec antygenów w cytoplazmie z granulocytów obojętnochłonnych (najbardziej powszechnym rodzajem krwinek białych ) i monocyty . Są one wykrywane jako badanie krwi w wielu chorobach autoimmunologicznych , ale są szczególnie związane z układowym zapaleniem naczyń , tak zwanymi zapaleniami naczyń związanymi z ANCA (AAV).
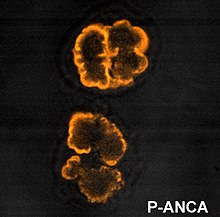
Wzorce ANCA IF
Do wykrywania ANCA stosuje się immunofluorescencję (IF) utrwalonych w etanolu granulocytów obojętnochłonnych, chociaż utrwalone w formalinie granulocyty obojętnochłonne mogą pomóc w różnicowaniu wzorców ANCA. ANCA można podzielić na cztery wzorce podczas wizualizacji przez IF; ANCA cytoplazmatyczna (c-ANCA), C-ANCA (atypowa), okołojądrowa ANCA (p-ANCA) i atypowa ANCA (a-ANCA), znana również jako x-ANCA. c-ANCA wykazuje ziarnistą cytoplazmatyczną fluorescencję z centralnym zaakcentowaniem międzypłatkowym. C-ANCA (atypowy) wykazuje barwienie cytoplazmatyczne, które jest zwykle jednolite i nie ma akcentowania międzypłatkowego. p-ANCA ma trzy podtypy, klasyczny p-ANCA, p-ANCA bez rozszerzenia jądra i przeciwciało przeciwjądrowe swoiste dla granulocytów (GS-ANA). Klasyczna p-ANCA wykazuje barwienie okołojądrowe z wydłużeniem jądra, p-ANCA bez wydłużenia jądra wykazuje barwienie okołojądrowe bez wydłużenia jądra, a GS-ANA pokazuje barwienie jądra tylko na granulocytach. a-ANCA często wykazuje kombinacje barwienia cytoplazmatycznego i okołojądrowego.
Antygeny ANCA
Antygen c-ANCA to specyficznie proteinaza 3 (PR3). Antygeny p-ANCA obejmują mieloperoksydazę (MPO) i czynnik zwiększający przepuszczalność bakterii Bakteriobójcze/zwiększające przepuszczalność białko (BPI). Istnieją inne antygeny dla c-ANCA (nietypowe), jednak wiele z nich jest jeszcze nieznanych. Klasyczna p-ANCA występuje z przeciwciałami skierowanymi przeciwko MPO. p-ANCA bez rozszerzenia jądra występuje z przeciwciałami przeciwko BPI, katepsynie G , elastazie , laktoferynie i lizozymowi . GS-ANA to przeciwciała skierowane przeciwko antygenom jądrowym swoistym dla granulocytów. Uważa się, że atypowe ANCA są antygenami podobnymi do tych z p-ANCA, jednak mogą wystąpić z powodu różnic w przetwarzaniu neutrofili.
Inne mniej powszechne antygeny obejmują HMG1 (wzór p-ANCA), HMG2 (wzór p-ANCA), alfa enolazę (wzór p i c-ANCA), katalazę ( wzór p i c-ANCA), beta-glukuronidazę (wzór p-ANCA) , azurocidyna ( wzór p i c-ANCA), aktyna (p i a-ANCA) i h-lampa-2 (c-ANCA).
ELISA
Enzyme-linked immunosorbent assay (ELISA) jest stosowane w laboratoriach diagnostycznych do wykrywania ANCA. Chociaż IF może być używany do badania przesiewowego wielu ANCA, ELISA służy do wykrywania przeciwciał przeciwko poszczególnym antygenom. Najczęstszymi antygenami stosowanymi na płytce do mikromiareczkowania ELISA są MPO i PR3, które są zwykle testowane po pozytywnym teście IF.
Rozwój
Niewiele wiadomo, jak rozwijają się ANCA, chociaż wysunięto kilka hipotez. Prawdopodobnie istnieje wkład genetyczny, szczególnie w genach kontrolujących poziom odpowiedzi immunologicznej – chociaż podatność genetyczna prawdopodobnie jest powiązana z czynnikiem środowiskowym, niektórymi możliwymi czynnikami, w tym szczepieniami lub narażeniem na krzemiany. Postulowane są dwa możliwe mechanizmy rozwoju ANCA, chociaż żadna z tych teorii nie odpowiada na pytanie, w jaki sposób rozwijane są różne specyfiki ANCA, i nadal podejmuje się wiele badań nad rozwojem ANCA.
Teoria mimikry molekularnej
Mikrobiologiczne superantygeny są cząsteczki ekspresji bakterii i innych mikroorganizmów, które mają moc stymulowania silną odpowiedź immunologiczną po aktywacji komórek T . Cząsteczki te na ogół mają regiony przypominające autoantygeny, które promują szczątkową odpowiedź autoimmunologiczną – jest to teoria mimikry molekularnej. Gronkowcowe i paciorkowcowe superantygeny scharakteryzowano w chorobach autoimmunologicznych - klasyczną przykład na stanowiskach paciorkowcem grupy A reumatyczne choroby serca , gdzie istnieje podobieństwo M białka z Streptococcus pyogenes sercowego miozyny i lamininy . Wykazano również, że do 70% pacjentów z ziarniniakowatością z zapaleniem naczyń jest przewlekłymi nosowymi nosicielami Staphylococcus aureus , przy czym nosiciele mają ośmiokrotnie większe ryzyko nawrotu choroby . Można by to zatem uznać za reakcję nadwrażliwości typu II .
Teoria wadliwej apoptozy
Neutrofili apoptozy albo zaprogramowanej śmierci komórek jest kluczowa kontrolowania czas początku reakcji zapalnych, a tym samym ograniczając uszkodzenie tkanki przez neutrofile. ANCA może być rozwijana albo poprzez nieskuteczną apoptozę, albo nieskuteczne usuwanie fragmentów komórek apoptotycznych, co prowadzi do ekspozycji układu odpornościowego na cząsteczki normalnie sekwestrowane wewnątrz komórek. Ta teoria rozwiązuje paradoks, w jaki sposób możliwe jest wytworzenie przeciwciał przeciwko wewnątrzkomórkowym celom antygenowym ANCA.
Rola w chorobie
Stowarzyszenia chorób
ANCA są związane z zapaleniem naczyń małych naczyń, w tym ziarniniakowatością z zapaleniem naczyń , mikroskopowym zapaleniem naczyń , pierwotnym ubogim immunologicznym martwiczym kłębuszkowym zapaleniem naczyń (rodzaj mikroskopowego zapalenia naczyń z ograniczeniem nerkowym), ziarniniakowatością eozynofilową z zapaleniem naczyń i polekowym zapaleniem naczyń. c-ANCA ukierunkowana na PR3 występuje w 80-90% ziarniniakowatości z zapaleniem naczyń, 20-40% mikroskopowego zapalenia naczyń, 20-40% immunologicznego półksiężycowego kłębuszkowego zapalenia nerek i 35% ziarniniakowatości eozynofilowej z zapaleniem naczyń. c-ANCA (atypowy) występuje w 80% mukowiscydozy (z BPI jako antygenem docelowym), a także w nieswoistym zapaleniu jelit , pierwotnym stwardniającym zapaleniu dróg żółciowych i reumatoidalnym zapaleniu stawów (z przeciwciałami przeciwko wielu celom antygenowym). p-ANCA ze swoistością MPO stwierdza się w 50% mikroskopowego zapalenia naczyń, 50% pierwotnego martwiczo-niedokrwiennego zapalenia kłębuszków nerkowych i 35% ziarniniakowatości eozynofilowej z zapaleniem naczyń. p-ANCA o swoistości wobec innych antygenów są związane z chorobą zapalną jelit, reumatoidalnym zapaleniem stawów, polekowym zapaleniem naczyń, autoimmunologiczną chorobą wątroby , zespołami polekowym i zakażeniami pasożytniczymi. Atypowa ANCA jest związana z polekowym układowym zapaleniem naczyń, nieswoistym zapaleniem jelit i reumatoidalnym zapaleniem stawów. Odsetek ANCA-dodatnich jest znacznie wyższy u pacjentów z cukrzycą typu 1 niż u osób zdrowych.
Lewamizol , który jest częstym zafałszowaniem kokainy , może powodować zapalenie naczyń z dodatnim wynikiem ANCA.
Obecność lub brak ANCA nie może wskazywać na obecność lub brak choroby, a wyniki są skorelowane z cechami klinicznymi. Związek ANCA i aktywności choroby pozostaje kontrowersyjny; jednak ponowne pojawienie się ANCA po leczeniu może wskazywać na nawrót.
Patogeneza
Chociaż patogenna rola ANCA jest nadal kontrowersyjna, modele in vitro i zwierzęce wspierają ideę, że przeciwciała odgrywają bezpośrednią patologiczną rolę w tworzeniu zapaleń małych naczyń. ANCA specyficzne dla MPO i PR3 mogą aktywować neutrofile i monocyty poprzez ich receptory Fc i Fab'2, które mogą być wzmacniane przez cytokiny, które powodują, że neutrofile wykazują na swojej powierzchni MPO i PR3. Nieprawidłowa glikozylacja ANCA specyficznych dla MPO i PR3 zwiększa ich zdolność do interakcji z aktywacją receptorów Fc na neutrofilach. Aktywowane granulocyty obojętnochłonne mogą następnie przylegać do komórek śródbłonka, gdzie następuje degranulacja. Uwalnia to wolne rodniki tlenowe i enzymy lityczne, powodując uszkodzenie śródbłonka poprzez indukcję martwicy i apoptozy . Ponadto neutrofile uwalniają chemoatrakcyjne cząsteczki sygnałowe, które rekrutują więcej neutrofili do śródbłonka, działając jako pętla dodatniego sprzężenia zwrotnego. Modele zwierzęce wykazały, że przeciwciała MPO mogą wywoływać martwicze półksiężycowe zapalenie kłębuszków nerkowych i układowe zapalenie małych naczyń. W tych modelach zwierzęcych powstawanie kłębuszkowego zapalenia nerek i zapalenia naczyń może wystąpić przy braku limfocytów T, jednak muszą być obecne neutrofile. Chociaż miano ANCA odnotowano mieć ograniczoną korelację z aktywnością choroby, oprócz chorób nerek, a także z ryzykiem nawrotu choroby, to wyjaśnić różnic w epitopach i powinowactwa Ancas. ANCA indukują nadmierną aktywację neutrofili , co skutkuje wytwarzaniem pozakomórkowych pułapek neutrofili (NET), które powodują uszkodzenie małych naczyń krwionośnych. Ponadto u pacjentów z aktywną chorobą, leczonych rytuksymabem , przeciwciałem anty- CD20 usuwającym krążące limfocyty B, remisja kliniczna koreluje bardziej ze zmniejszeniem liczby krążących limfocytów B niż ze spadkiem miana ANCA, co u niektórych pacjentów nie zmiana w trakcie leczenia. To samo badanie wykazało, że nawrót kliniczny u niektórych pacjentów był związany z powrotem krążących limfocytów B. W oparciu o powyższe obserwacje oraz fakt, że limfocyty B reagujące na ANCA można znaleźć w krążeniu u pacjentów z AAV, zaproponowano alternatywną hipotezę przypisywania bezpośredniej patogennej roli tych komórek, zgodnie z którą aktywowane neutrofile i limfocyty B reagujące na ANCA angażują się w międzykomórkowe crosstalk, który prowadzi nie tylko do degranulacji neutrofili i zapalenia, ale także do proliferacji i różnicowania limfocytów B reagujących na ANCA. Ta hipoteza pozostaje jednak do sprawdzenia.
Leczenie
Avacopan został zatwierdzony do użytku medycznego w Stanach Zjednoczonych w październiku 2021 r.
Historia
ANCA zostały pierwotnie opisane w Davies et al. w 1982 w odcinkowym martwiczym kłębuszkowym zapaleniu nerek . Drugie Międzynarodowe Warsztaty ANCA, które odbyły się w Holandii w maju 1989, ustaliły nazewnictwo na wzorce okołojądrowe i cytoplazmatyczne, a antygeny MPO i PR3 odkryto odpowiednio w 1988 i 1989 roku. Międzynarodowe Warsztaty ANCA odbywają się co dwa lata.