Kwas arsenowy - Arsenic acid
|
|

|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
kwas arsenowy, kwas arsenowy
|
|
| Inne nazwy
Kwas arsenowy Kwas
ortoarsenowy Osuszacz L-10 Zotox |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.029.001 |
| Numer WE | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 1553, 1554 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| H 3 AsO 4 | |
| Masa cząsteczkowa | 141,94 g/mol |
| Wygląd zewnętrzny | Białe, przezroczyste kryształy, higroskopijne . |
| Gęstość | 2,5 g / cm 3 |
| Temperatura topnienia | 35,5°C (95,9°F; 308,6 K) |
| Temperatura wrzenia | 120 ° C (248 ° F; 393 K) rozkłada się |
| 16,7 g/100 ml | |
| Rozpuszczalność | rozpuszczalny w alkoholu |
| Ciśnienie pary | 55 hPa (50 °C) |
| Kwasowość (p K a ) | 2,19, 6,94, 11,5 |
| Podstawa sprzężona | Arsenat |
| Struktura | |
| Czworościenny | |
| Zagrożenia | |
| Główne zagrożenia | Wyjątkowo toksyczny, rakotwórczy, żrący |
| Piktogramy GHS |
    
|
| Hasło ostrzegawcze GHS | Zagrożenie |
| H301 , H312 , H314 , H318 , H331 , H350 , H361 , H400 , H410 | |
| P201 , P202 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+310 , P301+330+331 , P302+352 , P303+361+353 , P304+340 , P305+351+338 , P308+313 , P310 , P311 , P312 , P321 , P322 , P330 , P363 , P391 | |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | Nie palne |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LD 50 ( mediana dawki )
|
48 mg/kg (szczur, doustnie)
6 mg/kg (królik, doustnie) |
| Związki pokrewne | |
|
Inne aniony
|
Kwas fosforowy |
|
Inne kationy
|
Arsenian sodu |
|
Związki pokrewne
|
Kwas arsenawy Pięciotlenek arsenu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |

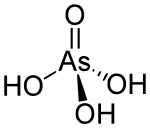
Kwas arsenowy to związek chemiczny o wzorze H 3 AsO 4 . Bardziej opisowo napisany jako AsO(OH) 3 , ten bezbarwny kwas jest analogiem arsenu kwasu fosforowego . Bardzo podobnie zachowują się sole arsenianowe i fosforanowe . Kwas arsenowy jako taki nie został wyizolowany, ale znajduje się tylko w roztworze, gdzie jest w dużej mierze zjonizowany. Jego półwodzianu forma (H 3 Aso 4 ·1/2H 2 O) tworzy stabilne kryształy. Próbki krystaliczne odwadniają się z kondensacją w 100 °C.
Nieruchomości
Jest to czworościenny gatunek o wyidealizowanej symetrii C 3v z długościami wiązań As-O w zakresie od 1,66 do 1,71 Å.
Będąc kwasem triprotonowym , jego kwasowość opisują trzy równowagi:
- H 3 AsO 4 + H 2 O ⇌ H
2AsO−
4 + H 3 O + (P K a1 = 2,19) -
h
2AsO−
4 + H 2 O ⇌ HAsO2-
4 + H 3 O + (P K a2 = 6,94) -
HASO2-
4 + H 2 O ⇌ AsO3−
4 + H 3 O + (P K a3 = 11,5)
Te P K a wartości są zbliżone do tych z kwasu fosforowego . Wysoce zasadowy jon arsenianowy ( AsO3−
4) jest produktem trzeciej jonizacji. W przeciwieństwie do kwasu fosforowego kwas arsenowy jest utleniaczem, o czym świadczy jego zdolność do przekształcania jodku w jod .
Przygotowanie
Kwas arsenowy otrzymuje się działając na trójtlenek arsenu stężonym kwasem azotowym . Jako produkt uboczny powstaje trójtlenek diazotu .
- As 2 O 3 + 2 HNO 3 + 2 H 2 O → 2 H 3 AsO 4 + N 2 O 3
Otrzymany roztwór chłodzi się, otrzymując bezbarwne kryształy półwodzianu H 3 AsO 4 ·1/2H 2 O, chociaż dwuwodzian H 3 AsO 4 · 2 H 2 O powstaje, gdy krystalizacja zachodzi w niższych temperaturach.
Inne metody
Kwas arsenowy tworzy się powoli, gdy pięciotlenek arsenu rozpuszcza się w wodzie i gdy kwas meta- lub piroarsenowy jest traktowany zimną wodą. Kwas arsenowy można również otrzymać bezpośrednio z arsenu pierwiastkowego poprzez zwilżenie go i potraktowanie ozonem .
- 2 As + 3 H 2 O + 5 O 3 → 2 H 3 AsO 4 + 5 O 2
Aplikacje
Komercyjne zastosowania kwasu arsenowego są ograniczone jego toksycznością. Jest prekursorem wielu pestycydów. Okazjonalnie znalazł zastosowanie jako środek do konserwacji drewna , biocyd o szerokim spektrum działania , środek do wykańczania szkła i metalu oraz odczynnik w syntezie niektórych barwników i organicznych związków arsenu.
Bezpieczeństwo
Kwas arsenowy jest niezwykle toksyczny i rakotwórczy, jak wszystkie związki arsenu. Jest również żrący . LD 50 u królików 6 mg / kg (0,006 g / kg).

