Ciało Barra - Barr body

Barr korpus (nazwane odkrywcy Murray Barr ) lub X chromatyny nieaktywnym chromosomu X w komórce więcej niż jednej z chromosomem X, staną się nieaktywne w procesie zwanym lyonization w gatunkami XY sex-określenia (w tym ludzi). W Lyonu hipoteza stwierdza, że w komórkach z wieloma chromosomów X , wszystko ale są inaktywowane ssaków podczas embriogenezy . Dzieje się tak na wczesnym etapie rozwoju embrionalnego w sposób losowy u ssaków , z wyjątkiem torbaczy i niektórych tkanek pozazarodkowych niektórych ssaków łożyskowych, w których chromosom X z plemnika jest zawsze dezaktywowany.
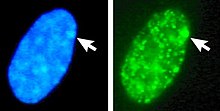
U ludzi euploidy , A genotypical żeńska (46 XX kariotyp ) posiada Barr ciała na somatycznych jądrze komórkowym , zaś genotypical męskiej (46, XY) ma. Ciało Barra można zobaczyć w jądrze międzyfazowym jako ciemno zabarwioną małą masę stykającą się z błoną jądra. Ciała Barra można zobaczyć w neutrofilach na krawędzi jądra.
U ludzi z więcej niż jednym chromosomem X, liczba ciał Barra widocznych w interfazie jest zawsze o jeden mniejsza niż całkowita liczba chromosomów X. Na przykład osoby z zespołem Klinefeltera (47, XXY) mają jedno ciało Barra, a osoby z kariotypem 47, XXX mają dwa ciała Barra.
Mechanizm
Ktoś z dwoma chromosomami X (jak większości ludzkich kobiet) ma tylko jedno ciało Barr za komórki somatycznej , gdy ktoś z jednym chromosomem X (jak większości ludzkich samców) ma żadnego.
Ssaków chromosomu X inaktywacji rozpoczyna się od środkowej X inaktywacji lub Xlc , znajdujące się zwykle w pobliżu centromeru . Centrum zawiera dwanaście genów , z których siedem koduje białka , pięć nie ulegających translacji RNA , z których tylko dwa są znane z odgrywania aktywnej roli w procesie inaktywacji chromosomu X , Xist i Tsix . Centrum wydaje się być również ważne w liczeniu chromosomów: zapewnienie, że losowa dezaktywacja ma miejsce tylko wtedy, gdy obecne są dwa lub więcej chromosomów X. Zapewnienie dodatkowego sztucznego Xic we wczesnej embriogenezie może indukować dezaktywację pojedynczego X znajdującego się w komórkach męskich.
Role Xist i Tsix wydają się być antagonistyczne. Utrata ekspresji Tsix na przyszłym nieaktywnym chromosomie X powoduje wzrost poziomu Xist wokół Xic . Tymczasem w przyszłości aktywne poziomy X Tsix są utrzymywane; w ten sposób poziomy Xist pozostają niskie. Ta zmiana pozwala Xistowi rozpocząć powlekanie przyszłego nieaktywnego chromosomu, rozprzestrzeniając się z Xic . W nielosowej inaktywacji wybór ten wydaje się być stały, a obecne dowody sugerują, że gen dziedziczony przez matkę może być imprintowany . Odnotowano zmiany częstości Xi w zależności od wieku, ciąży, stosowania doustnych środków antykoncepcyjnych, wahań cyklu miesiączkowego i nowotworu.
Uważa się, że stanowi to mechanizm wyboru i umożliwia dalszym procesom ustalenie zwartego stanu ciała Barra. Zmiany te obejmują modyfikacje histonów , takie jak metylacja histonu H3 (tj. H3K27me3 przez PRC2, który jest rekrutowany przez Xist ) i ubikwitynacja histonu H2A , a także bezpośrednia modyfikacja samego DNA poprzez metylację miejsc CpG . Zmiany te pomagają dezaktywować ekspresję genów na nieaktywnym chromosomie X i doprowadzić do jego zagęszczenia w celu utworzenia ciała Barra.
Możliwa jest również reaktywacja organizmu Barra, co zaobserwowano u pacjentów z rakiem piersi. Jedno z badań wykazało, że częstość występowania ciałek Barra w raku piersi była znacznie niższa niż u zdrowych osób kontrolnych, co wskazuje na reaktywację tych niegdyś inaktywowanych chromosomów X.
Zobacz też
Bibliografia
Linki do pełnych tekstów artykułów są dostępne w przypadku, gdy dostęp jest bezpłatny, w innych przypadkach link zawiera tylko abstrakt.
- ^ Barr, ML; Bertram, EG (1949). „Morfologiczne rozróżnienie między neuronami męskiego i żeńskiego oraz zachowanie satelity jądrowego podczas przyspieszonej syntezy nukleoprotein”. Natura . 163 (4148): 676-677. Kod Bibcode : 1949Natur.163..676B . doi : 10.1038/163676a0 . PMID 18120749 . S2CID 4093883 .
- ^ B Lyon MF (2003). „Hipoteza Lyon i LINE”. Seminaria z biologii komórkowej i rozwojowej . 14 (6): 313–318. doi : 10.1016/j.semcdb.2003.09.015 . PMID 15015738 .
- ^ Lyon, MF (1961). „Działanie genów w chromosomie X myszy ( Mus musculus L.)” . Natura . 190 (4773): 372-373. Kod Bibcode : 1961Natur.190..372L . doi : 10.1038/190372a0 . PMID 13764598 . S2CID 4146768 .
- ^ B Brązowy CJ Robinson WP, (1997), XIST Ekspresja i inaktywacji chromosomu X w ludzkiej zagnieżdżeniem zarodków Am. J. Hum. Genet. 61, 5–8 ( Pełny tekstowy PDF )
- ^ Lee, JT (2003). „Inaktywacja chromosomu X: podejście multidyscyplinarne”. J.semcdb . 14 (6): 311–312. doi : 10.1016/j.semcdb.2003.09.025 . PMID 15015737 .
- ^ B c Rougeulle, C .; Avner, P. (2003). „Kontrolowanie inaktywacji chromosomu X u ssaków: co ma centrum?”. Seminaria z biologii komórkowej i rozwojowej . 14 (6): 331-340. doi : 10.1016/j.semcdb.2003.09.014 . PMID 15015740 .
- ^ Lee, JT; Davidow, LS; Warshawsky, D. (1999). „Tisx, gen antysensowny do Xist w centrum X-inaktywacji”. Nat. Genet . 21 (4): 400–404. doi : 10.1038/7734 . PMID 10192391 . S2CID 30636065 .
- ^ Sharma, Deepti (10 stycznia 2018). „Rozszyfrowanie roli ciała Barra w nowotworach złośliwych” . Sultan Qaboos University Medical Journal . 17 (4): 389–397. doi : 10.18295/squmj.2017.17.04.003 . PMC 5766293 . PMID 29372079 .
- ^ Słyszałem, E.; Rougeulle, C.; Arnaud, D.; Avner, P.; Allis, CD (2001). „Metylacja histonu H3 w Lys-9 to wczesny znak na chromosomie X podczas inaktywacji X” . Komórka . 107 (6): 727-738. doi : 10.1016/S0092-8674(01)00598-0 . PMID 11747809 . S2CID 10124177 .
- ^ de Napoles, M.; Mermoud, JE; Wakao, R.; Tang, YA; Endoh, M.; Appana, R.; Niestierowa, TB; Silva, J.; Otte, AP; Vidal, M.; Koseki, H.; Brockdorff, N. (2004). „Białka grupy Polycomb Ring1A/B łączą ubikwitylację histonu H2A z dziedzicznym wyciszaniem genów i dezaktywacją X” . Odw. Komórka . 7 (5): 663–676. doi : 10.1016/j.devcel.2004.10.005 . PMID 15525528 .
- ^ Chadwick, BP; Willard, HF (2003). „Zakaz ekspresji genów po XIST: utrzymanie fakulatywnej heterochromatyny na nieaktywnym X”. Seminaria z biologii komórkowej i rozwojowej . 14 (6): 359–367. doi : 10.1016/j.semcdb.2003.09.016 . PMID 15015743 .
- ^ B Natekar, Prashant E .; DeSouza, Fatima M. (2008). „Reaktywacja nieaktywnego chromosomu X w rozmazie policzkowym raka piersi” . Indian Journal of Human Genetics . 14 (1): 7-8. doi : 10.4103/0971-6866.42320 . ISSN 0971-6866 . PMC 2840782 . PMID 20300284 .
Dalsza lektura
- Alberts, B.; Johnson, A.; Lewis, J.; Raff, M.; Roberts, K.; Walter P. (2002). Biologia molekularna komórki, wydanie czwarte . Nauka o girlandach. s. 428-429. Numer ISBN 978-0-8153-4072-0. (Wersja internetowa, bezpłatny dostęp)
- Turnpenny i Ellard: Emery's Elements of Medical Genetics 13E ( http://www.studentconsult.com/content/default.cfm?ISBN=9780702029172&ID=HC006029 )