Brachyterapia - Brachytherapy
| Brachyterapia | |
|---|---|
 Strzałka wskazuje na koraliki do brachyterapii stosowane w leczeniu raka prostaty.
| |
| Inne nazwy | radioterapia wewnętrzna, radioterapia zamkniętymi źródłami, curieterapia, endocurieterapia |
| ICD-10-SZT | D ?1? |
| ICD-9-CM | 92,27 |
| Siatka | D001918 |
Brachyterapia to forma radioterapii, w której zamknięte źródło promieniowania umieszcza się wewnątrz lub obok obszaru wymagającego leczenia. Brachy to w skrócie grecki . Brachyterapia jest powszechnie stosowana jako skuteczne leczenie raka szyjki macicy , prostaty , piersi , przełyku i skóry, a także może być stosowana w leczeniu guzów w wielu innych miejscach ciała. Wyniki leczenia wykazały, że współczynniki wyleczenia raka w brachyterapii są albo porównywalne z chirurgią i radioterapią wiązką zewnętrzną (EBRT), albo są lepsze, gdy stosuje się je w połączeniu z tymi technikami. Brachyterapia może być stosowana samodzielnie lub w połączeniu z innymi terapiami, takimi jak chirurgia, EBRT i chemioterapia .
Brachyterapia kontrastuje z radioterapią z nieuszczelnionym źródłem , w której terapeutyczny radionuklid (radioizotop) jest wstrzykiwany do organizmu w celu chemicznej lokalizacji w tkance wymagającej zniszczenia. Kontrastuje to również z radioterapią wiązką zewnętrzną (EBRT), w której promieniowanie rentgenowskie o wysokiej energii (lub czasami promieniowanie gamma z radioizotopu, takiego jak kobalt-60 ) jest kierowane na guz z zewnątrz ciała. Zamiast tego brachyterapia polega na precyzyjnym umieszczeniu źródeł promieniowania krótkiego zasięgu (na przykład radioizotopów, jodu-125 lub cezu-131 ) bezpośrednio w miejscu guza nowotworowego. Są one zamknięte w ochronnej kapsułce lub drucie, który umożliwia ucieczkę promieniowania jonizującego w celu leczenia i zabijania otaczającej tkanki, ale zapobiega przemieszczaniu się lub rozpuszczaniu ładunku promieniotwórczego w płynach ustrojowych. Kapsułka może zostać usunięta później lub (w przypadku niektórych radioizotopów) może pozostać na swoim miejscu.
Cechą brachyterapii jest to, że napromienianie wpływa tylko na bardzo zlokalizowany obszar wokół źródeł promieniowania. Zmniejsza się zatem ekspozycja na promieniowanie zdrowych tkanek znajdujących się dalej od źródeł. Ponadto, jeśli pacjent się poruszy lub wystąpi jakikolwiek ruch guza w ciele podczas leczenia, źródła promieniowania zachowują swoje prawidłowe położenie w stosunku do guza. Te cechy brachyterapii dają przewagę nad EBRT – guz można leczyć bardzo wysokimi dawkami promieniowania miejscowego, przy jednoczesnym zmniejszeniu prawdopodobieństwa niepotrzebnego uszkodzenia otaczających zdrowych tkanek.
Kurs brachyterapii można ukończyć w krótszym czasie niż inne techniki radioterapii. Może to pomóc w zmniejszeniu szansy przeżycia komórek rakowych na podział i wzrost w przerwach między każdą dawką radioterapii. Pacjenci zazwyczaj muszą składać mniej wizyt w poradni radioterapii w porównaniu z EBRT i mogą otrzymać leczenie w trybie ambulatoryjnym. To sprawia, że leczenie jest dostępne i wygodne dla wielu pacjentów. Te cechy brachyterapii sprawiają, że większość pacjentów bardzo dobrze znosi zabieg brachyterapii.
Światowy rynek brachyterapii osiągnął w 2013 roku 680 mln USD, z czego segmenty wysokodawkowe (HDR) i LDR stanowiły 70%. Pozostałe 30% stanowiły mikrosfery i brachyterapia elektroniczna. Jedna z analiz przewiduje, że rynek brachyterapii może osiągnąć w 2030 r. ponad 2,4 mld USD, rosnąc o 8% rocznie, głównie dzięki rynkowi mikrosfer oraz brachyterapii elektronicznej, która jako technologia przyjazna dla użytkownika zyskuje duże zainteresowanie na całym świecie.
Zastosowania medyczne
Brachyterapia jest powszechnie stosowana w leczeniu raka szyjki macicy , prostaty , piersi i skóry .
Brachyterapię można również stosować w leczeniu nowotworów mózgu , oka , okolicy głowy i szyi (wargi, dna jamy ustnej , języka, nosogardła i części ustnej gardła ), dróg oddechowych ( tchawicy i oskrzeli ), przewodu pokarmowego ( przełyku , pęcherzyka żółciowego , dróg żółciowych , odbytnicy , odbytu ), dróg moczowych ( pęcherz moczowy , cewka moczowa , prącie ), żeńskich dróg rodnych ( macica , pochwa , srom ) i tkanek miękkich.
Ponieważ źródła promieniowania mogą być precyzyjnie umiejscowione w miejscu leczenia nowotworu, brachyterapia umożliwia zastosowanie dużej dawki promieniowania na niewielkim obszarze. Ponadto, ponieważ źródła promieniowania są umieszczone w guzie docelowym lub obok niego, źródła utrzymują swoją pozycję w stosunku do guza, gdy pacjent się porusza lub jeśli guz się porusza w ciele. Dlatego źródła promieniowania pozostają dokładnie ukierunkowane. Umożliwia to klinicystom osiągnięcie wysokiego poziomu zgodności dawki – tj. zapewnienie, że cały guz otrzyma optymalny poziom promieniowania. Zmniejsza również ryzyko uszkodzenia zdrowej tkanki, narządów lub struktur wokół guza, zwiększając w ten sposób szanse na wyleczenie i zachowanie funkcji narządów.
Zastosowanie brachyterapii HDR umożliwia skrócenie całkowitego czasu leczenia w porównaniu z EBRT. Pacjenci poddawani brachyterapii zazwyczaj muszą odbyć mniej wizyt na radioterapię w porównaniu z EBRT, a ogólne plany leczenia radioterapią można zrealizować w krótszym czasie. Wiele zabiegów brachyterapii wykonywanych jest w warunkach ambulatoryjnych. Ta wygoda może być szczególnie istotna dla pacjentów, którzy muszą pracować, starszych pacjentów lub pacjentów mieszkających w pewnej odległości od ośrodków leczenia, aby zapewnić im dostęp do leczenia radioterapią i przestrzegać planów leczenia. Krótszy czas leczenia i procedury ambulatoryjne mogą również pomóc w poprawie efektywności klinik radioterapii.
Brachyterapia może być stosowana w celu wyleczenia nowotworu w przypadku małych lub miejscowo zaawansowanych guzów, pod warunkiem, że nowotwór nie dał przerzutów (rozprzestrzenił się na inne części ciała). W odpowiednio dobranych przypadkach brachyterapia guzów pierwotnych często stanowi porównywalne podejście do operacji, osiągając takie samo prawdopodobieństwo wyleczenia i z podobnymi skutkami ubocznymi. Jednak w przypadku guzów miejscowo zaawansowanych operacja może nie zapewniać rutynowo największej szansy na wyleczenie i często nie jest technicznie wykonalna. W takich przypadkach radioterapia, w tym brachyterapia, daje jedyną szansę na wyleczenie. W bardziej zaawansowanych stadiach choroby brachyterapia może być stosowana jako leczenie paliatywne w celu złagodzenia objawów bólu i krwawienia.
W przypadkach, gdy guz nie jest łatwo dostępny lub jest zbyt duży, aby zapewnić optymalną dystrybucję promieniowania na leczony obszar, brachyterapię można łączyć z innymi metodami leczenia, takimi jak EBRT i/lub zabieg chirurgiczny. Terapia skojarzona brachyterapii wyłącznie z chemioterapią jest rzadkością.
Rak szyjki macicy
Brachyterapia jest powszechnie stosowana w leczeniu wczesnego lub miejscowo ograniczonego raka szyjki macicy i jest standardem leczenia w wielu krajach. Rak szyjki macicy można leczyć za pomocą brachyterapii LDR, PDR lub HDR. Brachyterapia stosowana w połączeniu z EBRT może zapewnić lepsze wyniki niż sama EBRT. Precyzja brachyterapii umożliwia dostarczenie do szyjki macicy dużej dawki promieniowania celowanego, przy jednoczesnym zminimalizowaniu narażenia na promieniowanie sąsiednich tkanek i narządów.
Szanse na pozostanie wolnym od choroby (przeżycie wolne od choroby) i przeżycie (przeżycie całkowite) są podobne w przypadku terapii LDR, PDR i HDR. Jednak kluczową zaletą leczenia HDR jest to, że każda dawka może być dostarczona w warunkach ambulatoryjnych z krótkim czasem podania, co zapewnia większą wygodę wielu pacjentom.
Badania pokazują, że miejscowo zaawansowany rak szyjki macicy musi być leczony kombinacją radioterapii wiązką zewnętrzną (EBRT) i brachyterapii wewnątrzjamowej (ICBT).
Rak prostaty
Brachyterapia w leczeniu raka prostaty może być stosowana jako stała implantacja nasion LDR lub jako tymczasowa brachyterapia HDR.
Implantacja nasion na stałe jest odpowiednia dla pacjentów ze zlokalizowanym guzem i dobrym rokowaniem. Wykazano, że jest wysoce skuteczną metodą zapobiegania nawrotom nowotworu. Wskaźnik przeżycia jest podobny do EBRT lub operacji ( prostatektomii radykalnej ), ale z mniejszą liczbą skutków ubocznych, takich jak impotencja i nietrzymanie moczu . Zabieg można szybko zakończyć, a pacjenci są zazwyczaj w stanie wrócić do domu w tym samym dniu leczenia i powrócić do normalnych zajęć po 1 do 2 dniach. Implantacja nasion na stałe jest często mniej inwazyjną opcją leczenia w porównaniu z chirurgicznym usunięciem prostaty.
Brachyterapia tymczasowa HDR jest nowszym podejściem do leczenia raka prostaty, ale obecnie jest mniej powszechna niż implantacja nasion. Stosowany jest głównie w celu zapewnienia dodatkowej dawki oprócz EBRT (znanej jako terapia „boost”), ponieważ oferuje alternatywną metodę dostarczania wysokiej dawki radioterapii, która dopasowuje się do kształtu guza w obrębie prostaty, przy jednoczesnym oszczędzaniu promieniowania narażenie na otaczające tkanki. Brachyterapia HDR jako wzmocnienie w przypadku raka prostaty oznacza również, że kurs EBRT może być krótszy niż w przypadku samego EBRT.
Rak piersi
Radioterapia jest standardem opieki dla kobiet po lumpektomii lub mastektomii i jest integralną częścią terapii oszczędzającej pierś. Brachyterapię można stosować po zabiegu chirurgicznym, przed chemioterapią lub paliatywnie w przypadku zaawansowanej choroby. Brachyterapia w leczeniu raka piersi jest zwykle wykonywana za pomocą tymczasowej brachyterapii HDR. Brachyterapia piersi po zabiegu chirurgicznym może być stosowana jako „wzmocnienie” po napromieniowaniu całej piersi (WBI) za pomocą EBRT. Ostatnio sama brachyterapia jest stosowana do dostarczania APBI (akcelerowane częściowe napromienianie piersi), polegające na dostarczaniu promieniowania tylko do bezpośredniego obszaru otaczającego pierwotny guz.
Główną zaletą brachyterapii piersi w porównaniu z napromienianiem całej piersi jest to, że wysoka dawka promieniowania może być precyzyjnie zastosowana do guza, przy jednoczesnym zmniejszeniu napromieniania zdrowych tkanek piersi i struktur leżących poniżej, takich jak żebra i płuca. APBI można zazwyczaj wypełnić w ciągu tygodnia. Opcja brachyterapii może być szczególnie istotna w zapewnieniu kobietom pracującym, osobom starszym lub kobietom bez łatwego dostępu do ośrodka leczenia, możliwości skorzystania z terapii oszczędzającej pierś ze względu na krótki czas leczenia w porównaniu z WBI (co często wymaga większej liczby wizyt w ciągu 1–2 miesięcy).
Istnieje pięć metod, które można zastosować w brachyterapii piersi: brachyterapia śródmiąższowa piersi, brachyterapia wewnątrzjamowa piersi, radioterapia śródoperacyjna, trwała implantacja nasion piersi oraz nieinwazyjna brachyterapia piersi z wykorzystaniem mammografii do lokalizacji docelowej i źródła HDR.
Brachyterapia śródmiąższowa piersi
Brachyterapia śródmiąższowa piersi polega na tymczasowym umieszczeniu kilku elastycznych plastikowych cewników w tkance piersi. Są one starannie rozmieszczone, aby umożliwić optymalne skierowanie promieniowania na leczony obszar, jednocześnie oszczędzając otaczającą tkankę piersi. Cewniki połączone są z ładowaczem końcowym , który dostarcza zaplanowaną dawkę promieniowania na obszar zabiegowy. Brachyterapia śródmiąższowa piersi może być stosowana jako „wzmocnienie” po EBRT lub jako APBI.
Radioterapia śródoperacyjna
Radioterapia śródoperacyjna (IORT) polega na napromienianiu w tym samym czasie co operacja usunięcia guza (lumpektomia). W ubytku po usunięciu guza umieszczany jest aplikator, a mobilne urządzenie elektroniczne generuje promieniowanie (rentgen lub elektrony) i dostarcza je za pomocą aplikatora. Promieniowanie jest dostarczane od razu, a aplikator usuwany przed zamknięciem nacięcia.
Brachyterapia wewnątrzjamowa piersi
Brachyterapia wewnątrzjamowa piersi (znana również jako „brachyterapia balonowa”) polega na umieszczeniu pojedynczego cewnika w jamie piersi pozostawionej po usunięciu guza (lumpektomia). Cewnik można założyć w czasie lumpektomii lub pooperacyjnie. Za pomocą cewnika balon jest następnie nadmuchiwany w jamie. Cewnik jest następnie podłączany do urządzenia ładującego , które dostarcza dawkę promieniowania przez cewnik do balonika. Obecnie brachyterapia wewnątrzjamowa piersi jest stosowana jedynie rutynowo w APBI.
Istnieją również urządzenia łączące cechy brachyterapii śródmiąższowej i dojamowej piersi (np. SAVI). Urządzenia te wykorzystują wiele cewników, ale są wprowadzane przez punkt jednokrotnego wejścia w piersi. Badania sugerują, że użycie wielu cewników umożliwia lekarzom dokładniejsze ukierunkowanie promieniowania.
Trwała implantacja nasion piersi
Trwała implantacja nasion piersi (PBSI) wszczepia wiele radioaktywnych „nasion” (małych granulek) do piersi w okolicy miejsca guza, podobnie jak w przypadku trwałej brachyterapii nasion gruczołu krokowego. Nasiona są wszczepiane w jednej 1-2 godzinnej procedurze i dostarczają promieniowanie przez kolejne miesiące, gdy materiał radioaktywny w nich rozpada się. Przebadano ryzyko napromieniowania z implantów innych osób (np. partnera/małżonka) i uznano je za bezpieczne.
Nowotwór mózgu
Radioterapia celowana chirurgicznie (STaRT), znana również jako terapia GammaTile , to nowy rodzaj implantu do brachyterapii zaprojektowanego specjalnie do stosowania wewnątrz mózgu. GammaTile jest dopuszczony przez FDA do leczenia nowo zdiagnozowanych, operacyjnych złośliwych nowotworów śródczaszkowych (tj. guzów mózgu) i operacyjnych nawracających nowotworów śródczaszkowych, w tym oponiaków, przerzutów, glejaków wysokiego stopnia i glejaków wielopostaciowych.
W badaniu klinicznym terapia GammaTile poprawiła miejscową kontrolę guza w porównaniu z poprzednimi metodami leczenia w tym samym miejscu bez zwiększonego ryzyka wystąpienia działań niepożądanych.
Rak przełyku
W przypadku radioterapii raka przełyku brachyterapia jest jedną z opcji skutecznego leczenia, która obejmuje definitywną radioterapię (boost) lub leczenie paliatywne. Ostateczna radioterapia (boost) umożliwia precyzyjne podanie dawki i leczenie paliatywne w celu złagodzenia dysfagii. Aplikatory o dużej średnicy lub cewnik typu balonikowego są używane z ładowaczem końcowym w celu rozszerzenia przełyku i ułatwienia podania dawki promieniowania do guza z zachowaniem pobliskiej normalnej tkanki.
Wykazano, że brachyterapia po EBRT lub zabiegu chirurgicznym może poprawić przeżywalność i odsetek nawrotów miejscowych niż EBRT lub zabieg chirurgiczny tylko u pacjentów z rakiem przełyku.
Nowotwór skóry
Brachyterapia HDR w przypadku nieczerniakowego raka skóry , takiego jak rak podstawnokomórkowy i rak płaskonabłonkowy , stanowi alternatywną opcję leczenia do zabiegu chirurgicznego. Jest to szczególnie istotne w przypadku nowotworów nosa, uszu, powiek lub ust, gdzie operacja może spowodować oszpecenie lub wymagać rozległej rekonstrukcji. W celu zapewnienia bliskiego kontaktu między źródłem (źródłami) promieniowania a skórą można stosować różne aplikatory, które dopasowują się do krzywizny skóry i pomagają zapewnić precyzyjne dostarczanie optymalnej dawki promieniowania.
Innym rodzajem brachyterapii, który ma podobne zalety jak HDR, jest terapia Rhenium-SCT ( Terapia Raka Skóry ). Wykorzystuje emisje promieni beta Renu- 188 do leczenia raka podstawnokomórkowego lub płaskonabłonkowego . źródło promieniowania jest zamknięte w związku, który nakłada się na cienką folię ochronną bezpośrednio nad zmianą. W ten sposób źródło promieniowania może być zastosowane w złożonych miejscach i zminimalizować promieniowanie do zdrowej tkanki.
Brachyterapia raka skóry zapewnia dobre wyniki kosmetyczne i skuteczność kliniczną; badania z okresem obserwacji do 5 lat wykazały, że brachyterapia jest wysoce skuteczna pod względem kontroli miejscowej i jest porównywalna z EBRT. Czasy leczenia są zazwyczaj krótkie, co zapewnia wygodę pacjentom. Sugeruje się, że w niedalekiej przyszłości brachyterapia może stać się standardem leczenia raka skóry.
Naczynia krwionośne
Brachyterapia może być stosowana w leczeniu restenozy wieńcowej w stencie , w której cewnik umieszczany jest wewnątrz naczyń krwionośnych, przez które wprowadzane i usuwane są źródła. Stwierdzono, że w leczeniu restenozy w stencie (ISR) stenty uwalniające lek (ang. Drug Eluting stents, DES) są lepsze od brachyterapii wewnątrzwieńcowej (ICBT). Jednak istnieje ciągłe zainteresowanie brachyterapią naczyniową w przypadku uporczywej restenozy w przypadku uszkodzonych stentów i przeszczepów żylnych. Terapię badano również pod kątem zastosowania w leczeniu zwężenia naczyń obwodowych i rozważano w leczeniu migotania przedsionków .
Skutki uboczne
Prawdopodobieństwo i charakter potencjalnych ostrych, podostrych lub długotrwałych skutków ubocznych związanych z brachyterapią zależy od lokalizacji leczonego guza i rodzaju stosowanej brachyterapii.
Ostry
Ostre skutki uboczne związane z brachyterapią obejmują miejscowe siniaki, obrzęk, krwawienie, wydzielinę lub dyskomfort w obszarze implantu. Zwykle ustępują w ciągu kilku dni po zakończeniu leczenia. Pacjenci mogą również odczuwać zmęczenie przez krótki okres po leczeniu.
Brachyterapia raka szyjki macicy lub prostaty może powodować ostre i przemijające objawy ze strony układu moczowego, takie jak zatrzymanie moczu, nietrzymanie moczu lub bolesne oddawanie moczu (dyzuria). Może również wystąpić przemijające zwiększenie częstości wypróżnień, biegunka, zaparcia lub niewielkie krwawienia z odbytu. Ostre i podostre skutki uboczne zwykle ustępują w ciągu kilku dni lub kilku tygodni. W przypadku trwałej (nasionowej) brachyterapii raka prostaty, istnieje niewielka szansa, że niektóre nasiona mogą migrować z obszaru leczenia do pęcherza lub cewki moczowej i być wydalane z moczem.
Brachyterapia raka skóry może skutkować złuszczaniem zewnętrznych warstw skóry (złuszczaniem) wokół leczonego obszaru w ciągu kilku tygodni po terapii, która zwykle goi się w ciągu 5–8 tygodni. Jeśli nowotwór zlokalizowany jest na wardze, w wyniku brachyterapii może wystąpić owrzodzenie, które zwykle ustępuje po 4–6 tygodniach.
Większość ostrych skutków ubocznych związanych z brachyterapią można leczyć lekami lub poprzez zmiany w diecie i zwykle ustępują z czasem (zwykle w ciągu kilku tygodni) po zakończeniu leczenia. Ostre skutki uboczne brachyterapii HDR są zasadniczo podobne do EBRT.
Długoterminowy
U niewielkiej liczby osób brachyterapia może powodować długotrwałe skutki uboczne z powodu uszkodzenia lub rozerwania sąsiednich tkanek lub narządów. Długotrwałe działania niepożądane mają zwykle łagodny lub umiarkowany charakter. Na przykład problemy z układem moczowym i trawiennym mogą utrzymywać się w wyniku brachyterapii raka szyjki macicy lub prostaty i mogą wymagać ciągłego leczenia.
Brachyterapia raka prostaty może powodować zaburzenia erekcji u około 15-30% pacjentów. Jednak ryzyko zaburzeń erekcji jest związane z wiekiem (starsi mężczyźni są bardziej zagrożeni niż młodsi mężczyźni), a także z poziomem erekcji przed otrzymaniem brachyterapii. U pacjentów, u których występują zaburzenia erekcji, większość przypadków można z powodzeniem leczyć lekami takimi jak Viagra . Co ważne, ryzyko zaburzeń erekcji po brachyterapii jest mniejsze niż po radykalnej prostatektomii .
Brachyterapia w przypadku raka piersi lub skóry może powodować tworzenie się blizn wokół leczonego obszaru. W przypadku brachyterapii piersi, martwica tkanki tłuszczowej może wystąpić na skutek dostania się kwasów tłuszczowych do tkanek piersi. Może to spowodować obrzęk i tkliwość tkanki piersi. Martwica tkanki tłuszczowej jest stanem łagodnym i zwykle pojawia się 4–12 miesięcy po leczeniu i dotyka około 2% pacjentów.
Bezpieczeństwo wokół innych
Pacjenci często pytają, czy po brachyterapii muszą zachować szczególne środki ostrożności w pobliżu rodziny i przyjaciół. Jeśli stosowana jest czasowa brachyterapia, po leczeniu w organizmie nie pozostają żadne źródła promieniotwórcze. W związku z tym nie ma ryzyka napromieniowania przyjaciół lub rodziny z powodu przebywania w ich bliskiej odległości.
W przypadku stosowania trwałej brachyterapii, po leczeniu w organizmie pozostają niskodawkowe źródła promieniotwórcze (nasiona) – poziomy promieniowania są bardzo niskie i zmniejszają się z czasem. Ponadto napromienianie wpływa tylko na tkanki w odległości kilku milimetrów od źródeł promieniotwórczych (tj. leczonego guza). Jako środek ostrożności, niektórym osobom otrzymującym stałą brachyterapię można zalecić, aby nie trzymały małych dzieci lub przebywały zbyt blisko kobiet w ciąży przez krótki czas po leczeniu. Onkolodzy zajmujący się radioterapią lub pielęgniarki mogą udzielić pacjentom szczegółowych instrukcji i doradzić, jak długo powinni zachować ostrożność.
Rodzaje
Różne rodzaje brachyterapii można zdefiniować w zależności od (1) umiejscowienia źródeł promieniowania w docelowym obszarze leczenia, (2) szybkości lub „intensywności” dawki promieniowania dostarczanej do guza oraz (3) czasu trwania dawki dostawa .
Umieszczenie źródła
Dwa główne rodzaje leczenia brachyterapii pod względem umiejscowienia źródła promieniotwórczego to śródmiąższowe i kontaktowe.
W przypadku brachyterapii śródmiąższowej źródła umieszcza się bezpośrednio w tkance docelowej dotkniętego miejsca, np. prostacie lub piersi.
Brachyterapia kontaktowa polega na umieszczeniu źródła promieniowania w przestrzeni obok tkanki docelowej. Przestrzeń tą może stanowić jama ciała (brachyterapia wewnątrzjamowa) np. szyjka macicy , macica lub pochwa ; światło ciała (brachyterapia wewnątrz światła), takie jak tchawica lub przełyk ; lub zewnętrznie (brachyterapia powierzchniowa), np. na skórę . Źródło promieniowania można również umieścić w naczyniach krwionośnych (brachyterapia wewnątrznaczyniowa) w celu leczenia restenozy wieńcowej w stencie .
Dawka
Wielkość dawki brachyterapii odnosi się do poziomu lub „intensywności”, z jaką promieniowanie jest dostarczane do otaczającego środowiska i jest wyrażona w grejach na godzinę (Gy/h).
Brachyterapia niskodawkowa (LDR) polega na wszczepieniu źródeł promieniowania, które emitują promieniowanie do 2 Gy·h- 1 . Brachyterapia LDR jest powszechnie stosowana w przypadku nowotworów jamy ustnej, jamy ustnej i gardła , mięsaków i raka prostaty
Brachyterapia ze średnią dawką (MDR) charakteryzuje się średnim tempem dostarczania dawki, mieszczącym się w zakresie od 2 Gy·h- 1 do 12 Gy·h- 1 .
Brachyterapia wysokimi dawkami (HDR) ma miejsce, gdy szybkość dostarczania dawki przekracza 12 Gy·h- 1 . Najczęstsze zastosowania brachyterapii HDR to guzy szyjki macicy , przełyku , płuc , piersi i prostaty . Większość zabiegów HDR jest wykonywana w warunkach ambulatoryjnych, ale zależy to od miejsca zabiegu.
Brachyterapia impulsowa (PDR) obejmuje krótkie impulsy promieniowania, zwykle raz na godzinę, w celu symulacji ogólnego tempa i skuteczności leczenia LDR. Typowe miejsca nowotworowe leczone brachyterapią PDR to nowotwory ginekologiczne oraz nowotwory głowy i szyi.
Czas podawania dawki
Umieszczenie źródeł promieniowania w obszarze docelowym może być tymczasowe lub stałe.
Brachyterapia tymczasowa polega na umieszczeniu źródeł promieniowania na określony czas (zwykle kilka minut lub godzin) przed ich wycofaniem. Konkretny czas trwania leczenia będzie zależał od wielu różnych czynników, w tym wymaganej szybkości dostarczania dawki oraz rodzaju, wielkości i lokalizacji nowotworu. W brachyterapii LDR i PDR źródło zwykle pozostaje na miejscu do 24 godzin przed usunięciem, podczas gdy w brachyterapii HDR ten czas wynosi zwykle kilka minut.
Brachyterapia trwała, znana również jako implantacja nasion, polega na umieszczeniu małych radioaktywnych nasion lub granulek LDR (wielkości ziarna ryżu) w guzie lub miejscu leczenia i pozostawieniu ich tam na stałe, aby stopniowo rozpadły się. W ciągu kilku tygodni lub miesięcy poziom promieniowania emitowanego przez źródła spadnie prawie do zera. Nieaktywne nasiona pozostają następnie w miejscu zabiegu bez trwałego efektu. W leczeniu raka prostaty najczęściej stosuje się brachyterapię stałą .
Procedura
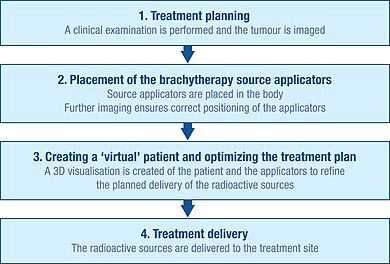
Wstępne planowanie
W celu dokładnego zaplanowania zabiegu brachyterapii przeprowadza się dokładne badanie kliniczne w celu poznania charakterystyki guza. Ponadto do wizualizacji kształtu i wielkości guza oraz jego relacji z otaczającymi tkankami i narządami można wykorzystać szereg metod obrazowania. Należą do nich radiografia rentgenowska, ultrasonografia, tomografia komputerowa osiowa (CT lub CAT) i obrazowanie metodą rezonansu magnetycznego (MRI). Dane z wielu z tych źródeł można wykorzystać do stworzenia wizualizacji 3D guza i otaczających tkanek.
Wykorzystując te informacje można opracować plan optymalnego rozmieszczenia źródeł promieniowania. Obejmuje to rozważenie, w jaki sposób należy umieścić i ustawić nośniki źródła (aplikatory), które są używane do dostarczania promieniowania do miejsca leczenia. Aplikatory są nieradioaktywne i zazwyczaj są to igły lub plastikowe cewniki. Konkretny typ stosowanego aplikatora będzie zależał od rodzaju leczonego nowotworu i charakterystyki guza docelowego.
To wstępne planowanie pomaga zapewnić, że podczas leczenia unika się „zimnych punktów” (zbyt małe napromieniowanie) i „gorących punktów” (zbyt duże napromieniowanie), ponieważ mogą one odpowiednio skutkować niepowodzeniem leczenia i działaniami niepożądanymi.
Wprowadzenie
Zanim źródła radioaktywne będą mogły być dostarczone do miejsca guza, aplikatory muszą być włożone i prawidłowo ustawione zgodnie z początkowym planem.
Techniki obrazowania, takie jak prześwietlenie rentgenowskie, fluoroskopia i ultradźwięki, są zwykle stosowane w celu ułatwienia prawidłowego umieszczenia aplikatorów i dalszego dopracowania planu leczenia. Można również użyć skanów CAT i MRI. Po włożeniu aplikatorów przytrzymuje się je przy skórze za pomocą szwów lub taśmy samoprzylepnej, aby zapobiec ich przemieszczaniu się. Po potwierdzeniu, że aplikatory znajdują się we właściwej pozycji, można przeprowadzić dalsze obrazowanie w celu ukierunkowania szczegółowego planowania leczenia.
Stworzenie wirtualnego pacjenta
Obrazy pacjenta z aplikatorami in situ są importowane do oprogramowania do planowania leczenia, a pacjent jest przenoszony do wydzielonego, osłoniętego pomieszczenia na zabieg. Oprogramowanie do planowania leczenia umożliwia przekształcenie wielu obrazów 2D miejsca leczenia na „wirtualnego pacjenta” 3D, w ramach którego można zdefiniować położenie aplikatorów. Przestrzenne relacje między aplikatorami, miejscem zabiegu i otaczającymi zdrowymi tkankami w obrębie tego „wirtualnego pacjenta” są kopią relacji u rzeczywistego pacjenta.
Optymalizacja planu napromieniania
Aby zidentyfikować optymalny przestrzenny i czasowy rozkład źródeł promieniowania w aplikatorach wszczepionej tkanki lub jamy, oprogramowanie do planowania leczenia umożliwia umieszczenie wirtualnych źródeł promieniowania wewnątrz wirtualnego pacjenta. Oprogramowanie pokazuje graficzną reprezentację rozkładu napromieniowania. Służy to zespołowi brachyterapii jako wskazówka do udoskonalenia dystrybucji źródeł i zapewnienia planu leczenia, który jest optymalnie dostosowany do anatomii każdego pacjenta przed rozpoczęciem rzeczywistego napromieniania. Takie podejście jest czasami nazywane „malowaniem dawki”.
Dostawa leczenia
Źródła promieniowania wykorzystywane do brachyterapii są zawsze zamknięte w nieradioaktywnej kapsułce. Źródła można dostarczać ręcznie, ale częściej są one dostarczane za pomocą techniki znanej jako „po załadowaniu”.
Ręczne prowadzenie brachyterapii jest ograniczone do kilku zastosowań LDR, ze względu na ryzyko narażenia personelu klinicznego na promieniowanie.
W przeciwieństwie do tego, ładowanie następcze polega na dokładnym pozycjonowaniu nieradioaktywnych aplikatorów w miejscu leczenia, które są następnie ładowane źródłami promieniowania. Przy ręcznym doładowaniu źródło jest dostarczane do aplikatora przez operatora.
Zdalne systemy doładowania wtórnego zapewniają ochronę przed narażeniem na promieniowanie pracowników służby zdrowia, zabezpieczając źródło promieniowania w osłoniętym sejfie. Po prawidłowym umieszczeniu aplikatorów w ciele pacjenta, podłącza się je do urządzenia „afterloader” (zawierającego źródła radioaktywne) za pomocą szeregu łączących rurek prowadzących. Plan leczenia jest wysyłany do modułu ładującego, który następnie kontroluje dostarczanie źródeł wzdłuż rurek prowadzących do wstępnie określonych pozycji w aplikatorze. Proces ten jest realizowany dopiero po usunięciu personelu z sali zabiegowej. Źródła pozostają na miejscu przez określony czas, ponownie zgodnie z planem oczyszczania, po czym są zwracane wzdłuż rur do urządzenia ładującego.
Po dostarczeniu źródeł promieniotwórczych aplikatory są ostrożnie usuwane z ciała. Pacjenci zazwyczaj szybko wracają do zdrowia po zabiegu brachyterapii, co pozwala na częste jej wykonywanie w warunkach ambulatoryjnych.
W latach 2003-2012 w szpitalach środowiskowych w Stanach Zjednoczonych wskaźnik hospitalizacji z brachyterapią (wewnętrzną radioterapią) miał 24,4 procentowy średni roczny spadek wśród dorosłych w wieku 45-64 lata i 27,3 procentowy średni roczny spadek wśród dorosłych w wieku 65-84 lata . Brachyterapia była zabiegiem OR o największej zmianie częstości wśród pobytów w szpitalu opłacanych przez Medicare i ubezpieczenie prywatne.
Źródła promieniowania
Powszechnie stosowane źródła promieniowania (radionuklidy) do brachyterapii.
| Radionuklid | Rodzaj | Pół życia | Energia |
|---|---|---|---|
| Cez-131 ( 131 Cs) | Przechwytywanie elektronów, ε | 9,7 dni | 30,4 keV (średnia) |
| Cez-137 ( 137 Cs) | β − - cząstki, promienie γ | 30,17 lat | 0,512, 0,662 MeV promienie γ |
| Kobalt-60 ( 60 Co) | β − - cząstki, promienie γ | 5,26 lat | 1,17, 1,33 MeV promienie γ |
| Iryd-192 ( 192 Ir) | promienie γ | 73,8 dni | 0,38 MeV (średnia) |
| Jod-125 ( 125 I) | Przechwytywanie elektronów, ε | 59,6 dni | 27,4, 31,4 i 35,5 keV |
| Pallad-103 ( 103 Pd) | Przechwytywanie elektronów, ε | 17,0 dni | 21 keV (średnia) |
| Ruten-106 ( 106 Ru) | β − - cząstki | 1,02 lat | 3,54 MeV |
| Rad-226 ( 226 Ra) | α- cząstki | 1599 lat |
Historia
Brachyterapia datuje się na rok 1901 (niedługo po odkryciu radioaktywności przez Henri Becquerela w 1896), kiedy Pierre Curie zasugerował Henri-Alexandre Danlosowi, że radioaktywne źródło można wprowadzić do guza. Stwierdzono, że promieniowanie spowodowało kurczenie się guza. Niezależnie Alexander Graham Bell również sugerował wykorzystanie w ten sposób promieniowania. Na początku XX wieku techniki zastosowania brachyterapii zostały zapoczątkowane w Instytucie Curie w Paryżu przez Danlosa oraz w St Luke's and Memorial Hospital w Nowym Jorku przez Roberta Abbe .
Współpracując z Curie w ich laboratorium badawczym radu na Uniwersytecie Paryskim, amerykański fizyk William Duane udoskonalił technikę ekstrakcji gazu radon-222 z roztworów siarczanu radu. Roztwory zawierające 1 gram radu „dojono” w celu wytworzenia „ziarn” radonu o wielkości około 20 milicurii każde. Te „nasiona” były rozprowadzane po całym Paryżu do stosowania we wczesnej formie brachyterapii zwanej endocurieterapią. Duane udoskonalił tę technikę „dojenia” podczas swojego pobytu w Paryżu i określił urządzenie jako „krowę radową”.
Duane wrócił do Stanów Zjednoczonych w 1913 roku i pracował wspólnie jako adiunkt fizyki na Harvardzie oraz Research Fellow in Physics of the Harvard Cancer Commission. Komisja ds. Raka została założona w 1901 roku i zatrudniła Duane'a do zbadania zastosowania emanacji radu w leczeniu raka. W 1915 roku zbudował pierwszą w Bostonie „krowę radową” i wytworzonym z niej radonem-222 leczono tysiące pacjentów.
W latach trzydziestych powszechna była śródmiąższowa terapia radem. Nasiona złota wypełnione radonem były używane już od 1942 do co najmniej 1958. Złote muszle zostały wybrane przez Gino Failla około 1920 roku, aby chronić promienie beta podczas przepuszczania promieni gamma . Igły kobaltowe były również krótko używane po II wojnie światowej. Radon i kobalt zostały zastąpione radioaktywnym tantalem i złotem, zanim iryd zyskał na znaczeniu. Po raz pierwszy użyty w 1958 roku iryd jest obecnie najczęściej używanym sztucznym źródłem do brachyterapii.
Po początkowym zainteresowaniu brachyterapią w Europie i Stanach Zjednoczonych, jej zastosowanie spadło w połowie XX wieku ze względu na problem narażenia operatorów na promieniowanie z ręcznego stosowania źródeł promieniotwórczych. Jednak rozwój zdalnych systemów doładowania , które pozwalają na dostarczanie promieniowania z osłoniętego sejfu, oraz zastosowanie nowych źródeł promieniotwórczych w latach 50. i 60. zmniejszyło ryzyko niepotrzebnego narażenia operatora i pacjentów na promieniowanie. To, wraz z nowszymi postępami w trójwymiarowych metodach obrazowania, skomputeryzowanym systemom planowania leczenia i sprzętowi do podawania, sprawiło, że brachyterapia jest obecnie bezpieczną i skuteczną metodą leczenia wielu rodzajów raka.
Słowo „brachyterapia” pochodzi od greckiego słowa βραχύς brachys , co oznacza „krótki dystans” lub „krótki”.
Zagrożenie dla środowiska
Ze względu na mały rozmiar źródeł brachyterapii i niską kontrolę w pierwszych dziesięcioleciach istnieje ryzyko, że niektóre z nich uciekły do środowiska i stały się źródłami osieroconymi . Igła radowa została znaleziona na praskim placu zabaw w 2011 roku, promieniująca 500 µSv/h z odległości jednego metra.
Zobacz też
- Radioterapia wiązką zewnętrzną
- Brachyterapia prostaty
- Celowana radioterapia śródoperacyjna
- Radioterapia z nieuszczelnionym źródłem
- Medycyna nuklearna
- Radioterapia śródoperacyjna
- Kontaktowa brachyterapia rentgenowska (zwana również „brachyterapią elektroniczną”)
Bibliografia
Zewnętrzne linki