Durwalumab - Durvalumab
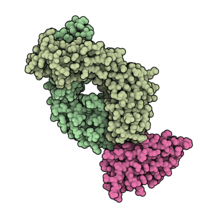
Wiążący antygen fragment durwalumabu (jasnozielony) w kompleksie z PD-L1 (różowy). WPB : 5X8M .
| |
| Przeciwciało monoklonalne | |
|---|---|
| Rodzaj | Całe przeciwciało |
| Źródło | Człowiek |
| Cel | CD274 |
| Dane kliniczne | |
| Nazwy handlowe | Imfinzi |
| Inne nazwy | MEDI4736, MEDI-4736 |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a617030 |
| Dane licencyjne | |
Kategoria ciąży |
|
| Drogi administracji |
Dożylny |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| Dane chemiczne i fizyczne | |
| Formuła | C 6502 H 10018 N 1742 O 2024 S 42 |
| Masa cząsteczkowa | 146 322 0,36 g·mol- 1 |
Durvalumab (nazwa handlowa Imfinzi ) to zatwierdzona przez FDA immunoterapia raka, opracowana przez Medimmune / AstraZeneca . Jest to ludzkie przeciwciało monoklonalne immunoglobuliny G1 kappa (IgG1κ), które blokuje interakcję liganda programowanej śmierci komórki 1 (PD-L1) z PD-1 (CD279).
Durwalumab jest znany jako lek hamujący punkty kontrolne .
Zastosowania medyczne
Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła durwalumab w przypadku niektórych rodzajów raka pęcherza i płuc:
- Dorośli z miejscowo zaawansowanym lub przerzutowym rakiem urotelialnym, u których nastąpiła progresja choroby podczas lub po chemioterapii zawierającej platynę lub progresja choroby wystąpiła w ciągu 12 miesięcy od leczenia neoadiuwantowego lub uzupełniającego chemioterapią zawierającą platynę.
- Dorośli z nieoperacyjnym niedrobnokomórkowym rakiem płuca w stadium III, u których choroba nie postępuje po jednoczesnej chemioterapii i radioterapii opartej na platynie.
- W skojarzeniu z etopozydem i karboplatyną lub cisplatyną jako leczenie pierwszego rzutu u dorosłych z rozległym drobnokomórkowym rakiem płuca.
Badania kliniczne
Badanie kliniczne fazy IB durwalumabu i tremelimumabu wykazało pewną aktywność w niedrobnokomórkowym raku płuca (NDRP). Dane I fazy dotyczące zaawansowanego przerzutowego pęcherza moczowego (badanie 1108) doprowadziły do wyznaczenia przez FDA przełomowej terapii . Wczesne wyniki badania I fazy łączącego durwalumab i gefitynib u pacjentów z rakiem płuc „okazały się obiecujące”. Obecnie trwa faza I badania klinicznego z użyciem durwalumabu z agonistą TLR 7/8 (MEDI 9197) w guzach litych. Trwa badanie fazy 1b/2a łączące durwalumab ze szczepionką HPV DNA (MEDI 0457) u pacjentów z nawrotowym/przerzutowym rakiem głowy i szyi związanym z HPV .
MISTYK
W lipcu 2017 r. firma AstraZeneca ogłosiła, że w badaniu III fazy dotyczącym durwalumabu z tremelimumabem jako leczenia pierwszego rzutu niedrobnokomórkowego raka płuca nie udało się osiągnąć pierwszorzędowego punktu końcowego, jakim było przeżycie bez progresji choroby.
PACYFIK
W listopadzie 2017 r . podwójnie zaślepione badanie kliniczne III fazy AstraZeneca PACIFIC wykazało skuteczność durwalumabu w leczeniu niedrobnokomórkowego raka płuca w stadium III . 709 pacjentów z NSCLC w III stopniu zaawansowania, u których nie wystąpiła progresja choroby po dwóch lub więcej cyklach chemioterapii opartej na platynie, zostało losowo przydzielonych do grupy otrzymującej durwalumab lub placebo jako terapię konsolidacyjną raka płuca. Durwalumab zwiększył medianę przeżycia wolnego od progresji z 5,6 miesiąca (placebo) do 16,8 miesiąca (durwalumab); 12-miesięczny wskaźnik przeżycia bez progresji wzrósł z 35,3% (placebo) do 55,9% (durwalumab), a wskaźnik 18-miesięcznego przeżycia bez progresji wzrósł z 27,0% (placebo) do 44,2% (durwalumab). Mediana czasu do zgonu lub przerzutów odległych również wzrosła z 14,6 miesiąca (placebo) do 23,2 miesiąca (durvalumab). Skrajne działania niepożądane również wzrosły z 26,1% pacjentów (placebo) do 29,9% pacjentów (durvalumab).
KASPIJSKI
W marcu 2021 r. w 209 ośrodkach leczenia raka w 23 krajach na całym świecie (CASPIAN) otwarte, randomizowane, kontrolowane badanie III fazy (AstraZeneca) wykazało skuteczność durwalumabu w skojarzeniu z chemioterapią opartą na platynie w leczeniu drobnokomórkowy rak płuc. Od 27 marca 2017 r. do 29 maja 2018 r. przebadano 972 pacjentów i losowo przydzielono 805 pacjentów (268 do grupy durwalumab plus tremelimumab plus platyna–etopozyd, 268 do durwalumabu plus platyna–etopozyd, a 269 do grupy platyna–etopozyd). Na dzień 27 stycznia 2020 r. mediana okresu obserwacji wyniosła 25,1 miesiąca (IQR 22,3–27,9). Durwalumab plus tremelimumab plus platyna–etopozyd nie wiązał się z istotną poprawą przeżycia całkowitego w porównaniu z platyną–etopozydem (współczynnik ryzyka [HR] 0,82 [95% CI 0,68–1,00]; p=0,045); mediana przeżycia całkowitego wyniosła 10,4 miesiąca (95% CI 9,6–12,0) wobec 10,5 miesiąca (9,3–11,2). Durwalumab plus platyna–etopozyd wykazały trwałą poprawę przeżycia całkowitego w porównaniu z platyną–etopozydem (HR 0,75 [95% CI 0,62–0,91]; nominalne p=0,032); mediana przeżycia całkowitego wyniosła 12,9 miesiąca (95% CI 11,3–14,7) wobec 10,5 miesiąca (9,3–11,2). Najczęstszymi zdarzeniami niepożądanymi stopnia 3. lub gorszego z jakiejkolwiek przyczyny była neutropenia (85 [32%] z 266 pacjentów w grupie durwalumab plus tremelimumab plus platyna–etopozyd, 64 [24%] z 265 pacjentów w grupie durwalumab plus platyna–etopozyd i 88 [33%] z 266 pacjentów w grupie platyny–etopozyd) oraz niedokrwistość (34 [13%], 24 [9%] i 48 [18%]). Poważne zdarzenia niepożądane z jakiejkolwiek przyczyny zgłoszono u 121 (45%) pacjentów w grupie durwalumab plus tremelimumab plus platyna–etopozyd, 85 (32%) w grupie durwalumab plus platyna–etopozyd i 97 (36%) w grupie platyna– grupa etopozydów. Zgony związane z leczeniem wystąpiły u 12 (5%) pacjentów w grupie durwalumab plus tremelimumab plus platyna–etopozyd (zgon, gorączka neutropeniczna i zatorowość płucna [n=2 każdy]; zapalenie jelit, ogólne pogorszenie stanu zdrowia i zespół dysfunkcji wielonarządowych, zapalenie płuc, zapalenie płuc i zapalenie wątroby, niewydolność oddechowa i nagły zgon [n=1 każdy]), sześciu (2%) pacjentów w grupie durwalumabu plus platyna–etopozyd (zatrzymanie akcji serca, odwodnienie, hepatotoksyczność, choroba śródmiąższowa płuc, pancytopenia i posocznica [n=1 każdy]) i dwóch (1%) w grupie platyny–etopozyd (pancytopenia i trombocytopenia [n=1 każdy]).
Bibliografia
Zewnętrzne linki
- „Durwalumab” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
- „Durwalumab” . Słownik leków NCI . Narodowy Instytut Raka.</ref>
- „Durwalumab” . Narodowy Instytut Raka .
