Dwuskładnikowy system EnvZ / OmpR - EnvZ/OmpR two-component system
EnvZ / OmpR to dwuskładnikowy system regulacyjny szeroko rozpowszechniony w bakteriach i szczególnie dobrze scharakteryzowany u Escherichia coli . Jego funkcja jest w osmoregulacji , reagując na zmiany środowiska osmolalności regulując ekspresję w błonie zewnętrznej Porins OmpF i OMPC . EnvZ jest kinazą histydynową, która posiada również cytoplazmatyczną domenę osmosensoryczną, a OmpR jest odpowiadającym jej białkiem regulującym odpowiedź.
Przegląd
EnvZ jest czujnikiem-przekaźnikiem, który obejmuje wewnętrzną błonę cytoplazmatyczną i został w przeszłości podzielony na dwie domeny , sensoryczną i nadajnikową. Białko składa się z krótkiego N-końcowego ogona w peryplazmie , dwóch regionów transbłonowych z interwencyjną pętlą peryplazmatyczną oraz domeny cytoplazmatycznej zawierającej autofosforylowaną resztę histydyny , która znajduje się w dimerycznej wiązce czterech helis . Różnice w osmolalności wyzwalają zmiany konformacyjne w EnvZ, które zostały zlokalizowane w cytoplazmatycznej wiązce czterech helis i które wpływają na transfer fosforylu do OmpR. Po fosforylacji OmpR staje się aktywnym dimerem, który wykazuje zwiększoną zdolność wiązania DNA, specyficzną zarówno dla genów ompC, jak i ompF . Kaskadę sygnalizacyjną można wyjaśnić w następujący sposób:
- Aktywacja czujnika błony wewnętrznej kinazy histydynowej EnvZ,
- Autofosforylacja EnvZ w His243 ,
- Transfer fosforanów do OmpR w Asp 55 ,
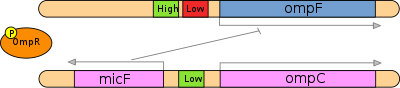
- Wiązanie ompR-P do początkowych miejscami na ompF i OMPC Pořín promotorów do różnie modulowania transkrypcji.
- Defosforylacja OmpR-P przez funkcję fosfatazy EnvZ.
Należy zauważyć, że ompF i ompC są wyrażane przez cały czas na stałych poziomach; Jednakże poszczególne Porins OmpF i OMPC są obecne w różnych względem częstości na podstawie średniej osmolarności. Ponadto ilość OmpF i OmpC jest kontrolowana przez różne mechanizmy; na przykład synteza OmpF jest również hamowana przez wysoką temperaturę. Podobnie, para EnvZ-OmpR jest zaangażowana w system tripeptydów, który jest całkowicie wolny od kontroli osmotycznej. Jednak kontrola EnvZ-OmpR nad OmpF i OmpC jest istotnym mechanizmem.
Niska odpowiedź osmolarności
Gdy średnia osmolarność jest niska , EnvZ wykazuje stosunkowo niską aktywność kinazy (tj. Wysoką aktywność fosfatazy) wobec OmpR. Stąd ilość fosforylowanej formy OmpR w komórkach jest stosunkowo niewielka. W tej konkretnej sytuacji kompleks OmpR-P wiąże się kooperatywnie z miejscami aktywatora F1 , F2 i F3 genu ompF i zwiększa jego transkrypcję . Miejsca te mają wysokie względne powinowactwo do kompleksu OmpR-P w porównaniu z miejscami aktywatora C1 , C2 i C3 ompC . Dlatego poziomy transkrypcji ompC są niższe w porównaniu z ompF w warunkach niskiej osmolarności. Zjawisko to zostało przypisane faktowi, że OmpF ma większą średnicę porów (1,12 nm) niż OmpC (1,08 nm), co skutkuje 10-krotnie większą szybkością dyfuzji, która zapewnia selektywną przewagę przy niskiej osmolarności do szybkiego wychwytywania rzadkich składników odżywczych.
Wysoka odpowiedź osmolarności
W przypadku wysokiej średniej osmolarności EnvZ aktywnie ulega autofosforylacji, a następnie skutecznie przenosi swoje grupy fosforylowe do N-końcowej domeny odbiorczej OmpR poprzez tworzenie kompleksu EnvZ-OmpR. Ponieważ liczba fosforylowanej ompR cząsteczek białka wzrasta dwa zdarzenia: ompR wiąże się nie tylko wysokie powinowactwo miejsc wiązania Upstream z ompF promotora ale również z jednej strony niskiego powinowactwa wiązania. Wiązanie się z tym miejscem o niskim powinowactwie skutkuje represją genu ompF . Ponadto OmpR wiąże się z trzema miejscami aktywatora o niskim powinowactwie powyżej promotorów OmpC, w wyniku czego ekspresja genu ompC jest stymulowana i więcej białka OmpC poryny jest wyrażane na zewnętrznej błonie komórki. Również transkrypcja antysensownego mRNA micF jest inicjowana przy wysokiej średniej osmolarności. micF wiąże się z komplementarną sekwencją mRNA ompF, blokując jego translację. Te dwa mechanizmy zapewniają stosunkowo wyższą ekspresję OmpC w porównaniu z OmpF w warunkach wysokiej średniej osmolarności.