Naskórkowy czynnik wzrostu - Epidermal growth factor
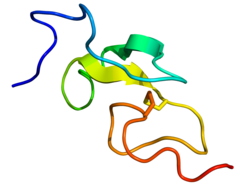
Czynnik wzrostu naskórka ( EGF ) to białko, które stymuluje wzrost i różnicowanie komórek poprzez wiązanie się ze swoim receptorem EGFR . Ludzki EGF ma 6 kDa i ma 53 reszty aminokwasowe oraz trzy wewnątrzcząsteczkowe wiązania dwusiarczkowe .
EGF opisano początkowo jako wydzielony peptyd znaleźć w podszczękowych gruczołów z myszy i ludzi moczu . Od tego czasu EGF znaleziono w wielu tkankach ludzkich, w tym w śliniance podżuchwowej (podżuchwowej) i przyusznicy . Początkowo ludzki EGF był znany jako urogastron .
Struktura
U ludzi EGF ma 53 aminokwasy (sekwencja NSDSECPLSHDGYCLHDGVCMYIEALDKYACNCVVGYIGERCQYRDLKWWELR) o masie cząsteczkowej około 6 kDa . Zawiera trzy mostki dwusiarczkowe (Cys6-Cys20, Cys14-Cys31, Cys33-Cys42).
Funkcjonować
EGF, poprzez wiązanie z pokrewnym receptorem , powoduje proliferację, różnicowanie i przeżycie komórek.
Ślinowy EGF, który wydaje się być regulowany przez nieorganiczny jod w diecie , odgrywa również ważną fizjologiczną rolę w utrzymaniu integralności tkanek jamy ustnej przełyku i żołądka. Biologiczne działanie EGF w ślinie obejmuje gojenie owrzodzeń jamy ustnej i przełyku, hamowanie wydzielania kwasu żołądkowego, stymulację syntezy DNA, a także ochronę śluzówki przed czynnikami uszkadzającymi wewnątrz światła przewodu, takimi jak kwas żołądkowy, kwasy żółciowe, pepsyna i trypsyna oraz przed czynnikami fizycznymi i chemicznymi. i czynniki bakteryjne.
Źródła biologiczne
Czynnik wzrostu naskórka można znaleźć w moczu , ślinie , mleku , łzach i osoczu krwi . Można go również znaleźć w śliniankach podżuchwowych i śliniankach przyusznych . Stwierdzono, że testosteron pobudza produkcję EGF .
Polipeptydowe czynniki wzrostu
Polipeptydowe czynniki wzrostu obejmują:
| Sr.No | Czynnik wzrostu | Źródło | Główna funkcja |
|---|---|---|---|
| 1 | Naskórkowy czynnik wzrostu (EGF) | Gruczoł ślinowy | Stymuluje wzrost komórek naskórka i nabłonka |
| 2 | Płytkowy czynnik wzrostu | Płytki krwi | Stymuluje wzrost komórek mezenchymalnych, wspomaga gojenie ran |
| 3 | Transformujący czynnik wzrostu (alfa) | Komórka nabłonkowa | Podobne do EGF |
| 4 | Transformujący czynnik wzrostu (Beta) | Płytki krwi, nerki, łożysko | Działanie hamujące na hodowle komórek nowotworowych |
| 5 | Erytropoetyna | Nerka | Stymuluje rozwój komórek erytropoetycznych |
| 6 | Czynnik wzrostu nerwów (NGF) | Gruczoł ślinowy | Stymuluje wzrost nerwów czuciowych |
| 7 | Insulinopodobny czynnik wzrostu | Serum | Stymuluje wbudowywanie siarczanów do chrząstki, wywiera działanie insulinopodobne na niektóre komórki |
| 8 | Czynnik martwicy nowotworu | Monocyty | Martwica komórek nowotworowych |
| 9 | Interleukina-1 | Monocyty, leukocyty | Stymuluje syntezę IL-2 |
| 10 | Interleukina-2 | Limfocyty | Stymuluje wzrost i dojrzewanie komórek T |
Mechanizm

EGF działa poprzez wiązanie z wysokim powinowactwem do receptora naskórkowego czynnika wzrostu (EGFR) na powierzchni komórki . Stymuluje to dimeryzację indukowaną przez ligand, aktywując wewnętrzną aktywność kinazy białkowo-tyrozynowej receptora (patrz drugi diagram). Kinazy tyrozynowej aktywność kolei inicjuje sygnału transdukcji kaskadę, która powoduje w wielu biochemicznych zmian w komórce - wzrost wewnątrzkomórkowego wapnia poziomach, zwiększenie glikolizy i syntezy białka i wzrostu w ekspresji pewnych genów, łącznie genu EGFR – które ostatecznie prowadzą do syntezy DNA i proliferacji komórek.
Rodzina EGF / domena podobna do EGF
EGF jest członkiem-założycielem rodziny białek EGF . Członkowie tej rodziny białek mają bardzo podobne cechy strukturalne i funkcjonalne. Oprócz samego EFG do innych członków rodziny należą:
- Wiążący heparynę czynnik wzrostu podobny do EGF (HB-EGF)
- transformujący czynnik wzrostu-α (TGF-α)
- Amfiregulina (AR)
- Epiregulina (EPR)
- Epigen
- Betacellulina (BTC)
- neuregulina-1 (NRG1)
- neuregulina-2 (NRG2)
- neuregulina-3 (NRG3)
- neuregulina-4 (NRG4).
Wszyscy członkowie rodziny zawierają jedno lub więcej powtórzeń konserwowanej sekwencji aminokwasowej:
CX 7 CX 4-5 CX 10-13 CXCX 8 GXRC
Gdzie C oznacza cysteinę , G oznacza glicynę , R oznacza argininę , a X oznacza dowolny aminokwas .
Ta sekwencja zawiera sześć reszt cysteinowych, które tworzą trzy wewnątrzcząsteczkowe wiązania dwusiarczkowe . Tworzenie wiązań dwusiarczkowych generuje trzy pętle strukturalne, które są niezbędne do wiązania z wysokim powinowactwem między członkami rodziny EGF i ich receptorami na powierzchni komórki.
Interakcje
Wykazano, że naskórkowy czynnik wzrostu oddziałuje z receptorem naskórkowego czynnika wzrostu .
Zastosowania medyczne
Rekombinowany ludzki naskórkowy czynnik wzrostu, sprzedawany pod marką Heberprot-P, jest stosowany w leczeniu owrzodzeń stopy cukrzycowej . Może być podawany we wstrzyknięciu w miejsce rany lub może być stosowany miejscowo. Wstępne dowody wskazują na lepsze gojenie się ran. Bezpieczeństwo zostało słabo zbadane.
EGF jest stosowany do modyfikacji rusztowań syntetycznych do produkcji bioinżynieryjnych szczepów metodą elektroprzędzenia emulsyjnego lub metodami modyfikacji powierzchni.
Regeneracja kości
EGF odgrywa rolę wzmacniającą w różnicowaniu osteogennym komórek macierzystych miazgi zębowej (DPSC), ponieważ jest zdolny do zwiększania mineralizacji macierzy zewnątrzkomórkowej. Niskie stężenie EGF (10 ng/ml) wystarcza do wywołania zmian morfologicznych i fenotypowych. Dane te sugerują, że DPSC w połączeniu z EGF mogą być skuteczną terapią opartą na komórkach macierzystych w zastosowaniach inżynierii tkanki kostnej w periodontologii i implantologii jamy ustnej .
Historia
Drugim zidentyfikowanym czynnikiem wzrostu był EGF . Początkowo ludzki EGF był znany jako urogastron . Stanly Cohen odkrył EGF podczas pracy z Ritą Levi-Montalcini na Uniwersytecie Waszyngtońskim w St. Louis podczas eksperymentów badających czynnik wzrostu nerwów (NGF). Za te odkrycia Levi-Montalcini i Cohen otrzymali w 1986 roku Nagrodę Nobla w dziedzinie fizjologii lub medycyny .
Bibliografia
Dalsza lektura
- Boonstra J, Rijken P, Humbel B, Cremers F, Verkleij A, van Bergen en Henegouwen P (maj 1995). „Naskórkowy czynnik wzrostu”. Międzynarodowa biologia komórki . 19 (5): 413–30. doi : 10.1006/cbir.1995.1086 . PMID 7640657 . S2CID 20186286 .
- Dworak B (marzec 2004). „Naskórkowy czynnik wzrostu i martwicze zapalenie jelit”. Kliniki perinatologii . 31 (1): 183–92. doi : 10.1016/j.clp.2004.03.015 . PMID 15183666 .
- Howell WM (październik 2004). "Polimorfizm genu naskórkowego czynnika wzrostu a rozwój czerniaka skóry" . Czasopismo Dermatologii Śledczej . 123 (4): xx-xxi. doi : 10.1111/j.0022-202X.2004.23308.x . PMID 15373802 .
Zewnętrzne linki
- Shaanxi Zhongbang Pharma-Tech Co., Ltd.-dostawa naskórkowego czynnika wzrostu
- EGF w bazie danych referencyjnych białek ludzkich .
- Naskórek + czynnik wzrostu + w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- Model EGF w bazie danych BioModels