Postępująca fibrodysplazja kostniejąca - Fibrodysplasia ossificans progressiva
| Postępowanie fibrodysplazji kostnej | |
|---|---|
| Inne nazwy | FOP, choroba Stonemana, choroba Münchmeyera |
 | |
| Skutki postępującej fibrodysplazji kostnej, choroby, która powoduje odrastanie uszkodzonej tkanki miękkiej jako kości. | |
| Wymowa | |
| Specjalność | Genetyka medyczna , reumatologia |
| Objawy | Ciągły wzrost kości |
| Zwykły początek | Przed 10 rokiem życia |
| Diagnostyka różnicowa | Dysplazja włóknista |
| Leczenie | Nic |
| Rokowanie | Mediana oczekiwanej długości życia ≈ 40 lat (jeśli jest właściwie zarządzana) |
| Częstotliwość | 801 potwierdzonych przypadków na całym świecie (2017); wskaźnik zachorowalności szacowany na 0,5 przypadku na milion osób (1 na 2 miliony) |
Postępujące kostniejące zapalenie mięśni ( FOP ), czasami nazywany chorobą Münchmeyer jest niezwykle rzadkie choroby tkanki łącznej, wynikające z mutacji w ACVR1 genu. Jest to ciężkie, powodujące kalectwo zaburzenie, którego nie można obecnie leczyć ani leczyć. Jest to jedyny znany stan chorobowy, w którym jeden układ narządów zmienia się w inny.
Postępująca fibrodysplazja kostniejąca jest spowodowana mutacją genu ACVR1 . Mutacja wpływa na mechanizm naprawy organizmu, powodując tkanka włóknista w tym mięśni , ścięgien i więzadeł , by stać się skostniałe , samoistnie lub w przypadku jego zniszczenia w wyniku urazu. W wielu przypadkach drobne urazy mogą spowodować trwałe zrośnięcie stawów w postaci nowych kości, zastępujących uszkodzoną tkankę mięśniową. Ta nowa formacja kości (znana jako „kostnienie heterotopowe”) ostatecznie tworzy szkielet wtórny i stopniowo ogranicza zdolność pacjenta do poruszania się. Kość powstająca w wyniku tego procesu jest identyczna jak „normalna” kość, po prostu w niewłaściwych miejscach. Dowody poszlakowe sugerują, że choroba może powodować degradację stawu niezależnie od jego charakterystycznego wzrostu kości.
Wykazano, że chirurgiczne usunięcie dodatkowego wzrostu kości powoduje, że organizm „naprawia” dotknięty obszar dodatkową kością. Chociaż tempo wzrostu kości może się różnić w zależności od pacjenta, stan ostatecznie pozostawia osoby dotknięte stanem unieruchomionym, ponieważ nowa kość zastępuje muskulaturę i łączy się z istniejącym szkieletem.
Podczas nawrotów niektórzy pacjenci próbowali ustawić swoje ciało w taki sposób, w jaki woleliby pozostać na stałe w celu poprawy jakości życia.
Symptomy i objawy
Z nieznanych powodów dzieci urodzone z FOP często mają zniekształcone duże palce u stóp , czasami brak stawu lub, w innych przypadkach, po prostu mają widoczny guzek w mniejszym stawie. Pierwsze „zaostrzenie”, które prowadzi do powstania kości FOP, zwykle występuje przed 10 rokiem życia. Wzrost kości zwykle postępuje od górnej części ciała w dół, tak jak kości rosną u płodów. Dziecko z FOP zazwyczaj rozwija dodatkowe kości, zaczynając od szyi, następnie ramion, ramion, klatki piersiowej i wreszcie stóp.
W szczególności, kostnienie jest zazwyczaj po raz pierwszy widoczne w grzbietowych, osiowych, czaszkowych i proksymalnych obszarach ciała. Później choroba postępuje w okolicy brzusznej, wyrostka robaczkowego, ogonowego i dystalnego. Jednak niekoniecznie występuje w tej kolejności z powodu zaostrzeń spowodowanych urazami. Często guzki przypominające guzy, które charakteryzują nawrót choroby, pojawiają się nagle.
Wzrost kości występujący podczas zaostrzeń może powodować utratę ruchomości dotkniętych stawów, w tym, jeśli dotyczy to szczęki/żuchwy, niemożność pełnego otwarcia ust, ograniczając mowę i jedzenie. Specyficzne wystąpienie zaostrzenia tego stanu w stawach stopy/kostki może skutkować ograniczoną możliwością postawienia stopy płasko na ziemi. Wzrost kości może również skutkować unieruchomieniem biodra lub kolana, wpływając na zdolność chodzenia. Dodatkowa formacja kości wokół klatki piersiowej ogranicza rozszerzanie się płuc i przepony, powodując komplikacje oddechowe.
Ponieważ zaburzenie jest tak rzadkie, stan może zostać błędnie zdiagnozowany jako rak lub zwłóknienie . Skłania to lekarzy do zlecania biopsji, które mogą zaostrzyć wzrost kości FOP. Obecność zniekształconych palców u nóg lub kciuków u osób urodzonych z FOP pomaga odróżnić to zaburzenie od innych problemów szkieletowych.
Przy odpowiednim postępowaniu medycznym mediana wieku przeżycia wynosi 40 lat. Jednak opóźniona diagnoza, uraz i infekcje mogą skrócić oczekiwaną długość życia.
Powoduje
FOP jest wywoływany przez autosomalny dominujący allel na chromosomie 2q23-24. Allel ma zmienną ekspresję , ale całkowitą penetrację . Większość przypadków jest spowodowana spontaniczną mutacją w gametach ; większość osób z FOP nie może lub nie decyduje się na posiadanie dzieci. Podobną , ale mniej katastrofalną chorobą , jest dysplazja włóknista , spowodowana mutacją pozygotyczną .
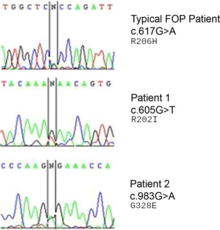
Za chorobę odpowiada mutacja w genie ACVR1 (znanym również jako kinaza aktywinopodobna 2 (ALK2)). ACVR1 koduje receptor aktywiny typu-1, receptor BMP typu-1. Mutacja powoduje substytucję kodonu 206 z argininy na histydynę w białku ACVR1. Ta substytucja powoduje nieprawidłową aktywację ACVR1, prowadząc do przekształcenia tkanki łącznej i tkanki mięśniowej w szkielet wtórny. Powoduje to przekształcenie komórek śródbłonka w mezenchymalne komórki macierzyste, a następnie w kości.
Genetyka
FOP jest zaburzeniem autosomalnym dominującym . Zatem dziecko chorego heterozygotycznego rodzica i zdrowego rodzica ma 50% prawdopodobieństwa dotknięcia chorobą. Dwie osoby dotknięte chorobą mogą urodzić zdrowe dzieci. Dwie zdrowe osoby mogą wydać chore potomstwo w wyniku mutacji genu. Forma homozygotyczna dominująca jest cięższa niż forma heterozygotyczna.
Białko powodujące kostnienie jest zwykle dezaktywowane przez białko hamujące po uformowaniu się kości płodu w macicy, ale u pacjentów z FOP białko nadal działa. Nieprawidłowe tworzenie kości u pacjentów z FOP występuje, gdy uszkodzona tkanka łączna lub komórki mięśniowe w miejscach uszkodzenia lub wzrostu nieprawidłowo wyrażają enzym naprawy kości podczas apoptozy (samoregulującej się śmierci komórki), co powoduje, że limfocyty zawierają nadmiar białka morfogenetycznego kości 4 (BMP4 ) dostarczone podczas odpowiedzi układu odpornościowego. Powstała kość występuje niezależnie od normalnego szkieletu, tworząc własne odrębne elementy szkieletu. Te elementy mogą jednak łączyć się z normalną kością szkieletową. W procesie tym oszczędzana jest przepona, język i mięśnie zewnątrzgałkowe, a także mięśnie sercowe i gładkie . Ponieważ nieprawidłowy enzym pozostaje nierozwiązany w odpowiedzi immunologicznej, organizm nadal dostarcza nieprawidłowe limfocyty zawierające BMP4. BMP4 to produkt, który przyczynia się do rozwoju szkieletu w zdrowym zarodku.
ACVR1 gen koduje białko morfogenetyczne kości (BMP), receptor; ten gen jest zmutowany w FOP. Odpowiada za wzrost i rozwój kości oraz mięśni. Typowa mutacja, R202H, sprawia, że inhibitor FKBP1A słabiej wiąże się z pętlą aktywacji GS. Efektem końcowym jest to, że ACVR1 nie jest skutecznie wyłączany i dochodzi do przerostu kości i chrząstki oraz zrostu stawów. Podobnie działają nietypowe mutacje obejmujące inne reszty. W niektórych przypadkach receptor może zasygnalizować, że jest aktywny, nie będąc związanym ze swoim aktywującym ligandem.
Większość przypadków FOP była wynikiem nowej mutacji genu: osoby te nie miały historii tej konkretnej choroby w swojej rodzinie. W niektórych przypadkach osoba odziedziczyła mutację od jednego chorego rodzica.
Diagnoza
Epidemie mogą być mierzalne klinicznie na podstawie podwyższonego poziomu fosfatazy alkalicznej i fosfatazy alkalicznej specyficznej dla kości . Innym charakterystycznym objawem FOP jest skrócony paluch z wadliwie ukształtowanym dystalnym pierwszym kością śródstopia oraz brakiem lub nieprawidłowym pierwszym paliczkiem i/lub stawem międzypaliczkowym.
Leczenie
Nie ma lekarstwa ani zatwierdzonego leczenia FOP. Próby chirurgicznego usunięcia kości u pacjenta z FOP mogą spowodować gwałtowny wzrost nowej kości. Podczas znieczulenia osoby z FOP mogą napotkać trudności z intubacją , restrykcyjną chorobą płuc oraz zmianami w układzie przewodnictwa elektrycznego serca . Należy unikać czynności zwiększających ryzyko upadku lub uszkodzenia tkanek miękkich, ponieważ nawet niewielki uraz może wywołać heterotopowe tworzenie kości.
Epidemiologia
Do 2017 r. na całym świecie potwierdzono około 800 przypadków FOP, co czyni FOP jedną z najrzadszych znanych chorób. Szacowana częstość występowania FOP wynosi 0,5 przypadku na milion osób i dotyczy wszystkich grup etnicznych.
Historia
Doniesienia medyczne opisujące osoby dotknięte FOP pochodzą z XVII wieku. FOP był pierwotnie nazywany postępującym zapaleniem kostnym mięśni i uważano, że jest spowodowany zapaleniem mięśni ( zapaleniem mięśni ), które powoduje tworzenie się kości. Choroba została przemianowana przez Victora A. McKusicka w 1970 roku po odkryciu, że proces chorobowy dotyczy również tkanek miękkich innych niż mięśnie (np. więzadeł ).
Najbardziej znanym przypadkiem FOP jest przypadek Harry'ego Eastlacka (1933-1973). Jego stan zaczął się rozwijać w wieku dziesięciu lat, a do czasu jego śmierci z powodu zapalenia płuc w listopadzie 1973 roku, na sześć dni przed 40. urodzinami, jego ciało uległo całkowitemu skostnieniu, pozwalając mu poruszać tylko ustami. Eastlack nigdy w swoim życiu nie spotkał innej osoby z FOP.
Eastlack podarował swoje ciało nauce, a jego szkielet znajduje się obecnie w Muzeum Müttera w Filadelfii i okazał się nieocenionym źródłem informacji w badaniach nad FOP. Inna chora na FOP, Carol Orzel (20 kwietnia 1959 – luty 2018), również przekazała swoje ciało do muzeum, a jej szkielet został tam umieszczony na wystawie, obok Eastlack, w lutym 2019.
Badania
Badania kliniczne izotretynoiny , etidronianu z doustnymi kortykosteroidami i maleinianu perheksyliny nie wykazały skuteczności, chociaż zmienny przebieg choroby i mała częstość występowania wywołują niepewność.
Kilka firm farmaceutycznych zajmujących się chorobami rzadkimi znajduje się obecnie na różnych etapach badań nad różnymi podejściami terapeutycznymi do FOP.
W sierpniu 2015 r. Urząd ds. Rozwoju Produktów Sierocych (FDA) Amerykańskiej Agencji ds. Rozwoju Produktów Sierocych przyznał firmie La Jolla Pharmaceuticals oznaczenie sierocego leku dla dwóch nowych związków na FOP. Związki te są drobnocząsteczkowymi inhibitorami kinazy białkowej przeznaczonymi do selektywnego blokowania ACVR1 (ALK2).
W sierpniu 2015 r. Clementia Pharmaceuticals rozpoczęła również rekrutację dzieci (w wieku 6 lat i starszych) do badania klinicznego fazy II, w którym badano palowaroten w leczeniu FOP. Badania przedkliniczne wykazały, że palowaroten, agonista receptora gamma kwasu retinowego, blokował nieprawidłowe tworzenie kości w modelach zwierzęcych poprzez hamowanie wtórnych układów przekaźnikowych w szlaku BMP. Clementia licencjonowana palowaroten z Roche Pharmaceuticals, która wcześniej oceniła związek u ponad 800 osób, w tym zdrowych ochotników i pacjentów z przewlekłą obturacyjną chorobą płuc. Palowaroten otrzymał oznaczenie Fast Track od FDA i oznaczenie sieroce do leczenia FOP zarówno przez FDA, jak i Europejską Agencję Leków (EMA).
We wrześniu 2015 r. firma Regeneron ogłosiła nowe spojrzenie na mechanizm choroby polegający na aktywacji receptora ACVR1 przez aktywinę A. W 2016 r. firma zainicjowała fazę 1 badania swojego przeciwciała przeciwko aktywinie, REGN 2477, u zdrowych ochotników; badanie II fazy u pacjentów z FOP przeprowadzono w 2017 roku.
Inne potencjalne podejście terapeutyczne obejmuje interferencję RNA specyficzną dla allelu, która jest ukierunkowana na degradację zmutowanego mRNA, zachowując normalną ekspresję genu ACVR1.
Dalsze badania mechanizmów heterotopowego tworzenia kości w FOP mogą pomóc w opracowaniu metod leczenia innych zaburzeń związanych z pozaszkieletowym tworzeniem kości.
Fibro/adipogeniczne komórki progenitorowe (FAP) mogą być typem komórek powodujących chorobę, odpowiedzialnym za zależne od aktywiny A ektopowe tworzenie kości zarówno w mięśniach, jak i ścięgnach myszy z FOP powodującym mutację ACVR1(R206H).
Badania kliniczne kilku potencjalnych terapii trwają od 2019 roku.
Zobacz też
- Międzynarodowe Stowarzyszenie FOP
- Osteogenesis imperfecta , stan charakteryzujący się niezwykle łatwym łamaniem kości, spowodowany mutacjami w genach związanych z tymi odpowiedzialnymi za FOP
- Postępująca heteroplazja kostna
- Przyjaciele FOP
Bibliografia
Dalsza lektura
- Cohen, M. Michael; Howell, Robin E. (październik 1999). „Etiologia dysplazji włóknistej i zespołu McCune-Albrighta”. Międzynarodowy Dziennik Chirurgii Szczękowo-Twarzowej . 28 (5): 366-371. doi : 10.1016/s0901-5027(99)80085-x . PMID 10535539 .
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |