Glicyna - Glycine
|
|||
|
|||
|
|||
| Nazwy | |||
|---|---|---|---|
|
Nazwa IUPAC
kwas aminooctowy
|
|||
| Inne nazwy
Kwas 2-aminoetanowy, Glikokol
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| Skróty | Gly , G | ||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Karta informacyjna ECHA |
100.000.248 |
||
| Numer WE | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
| Nieruchomości | |||
| C 2 H 5 N O 2 | |||
| Masa cząsteczkowa | 75,067 g·mol -1 | ||
| Wygląd zewnętrzny | Białe ciało stałe | ||
| Gęstość | 1.1607 g/cm 3 | ||
| Temperatura topnienia | 233 ° C (451 ° F; 506 K) (rozkład) | ||
| 24,99 g/100 ml (25°C) | |||
| Rozpuszczalność | rozpuszczalny w pirydynie trudno rozpuszczalny w etanolu nierozpuszczalny w eterze |
||
| Kwasowość (p K a ) | 2,34 (karboksyl), 9,6 (amino) | ||
| -40,3 x 10 -6 cm 3 / mol | |||
| Farmakologia | |||
| B05CX03 ( KTO ) | |||
| Zagrożenia | |||
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych | ||
| Dawka lub stężenie śmiertelne (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
2600 mg/kg (mysz, doustnie) | ||
| Strona z danymi uzupełniającymi | |||
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|||
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe-ciecz-gaz |
||
| UV , IR , NMR , MS | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
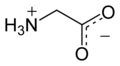
Glicyna (symbol Gly lub G ; / ɡ l aɪ s ı n / ) jest aminokwasem , który ma jeden wodoru, atom jako jego bocznym łańcuchu . Jest to najprostszy stabilny aminokwas (kwas karbaminowy jest niestabilny), o wzorze chemicznym NH 2 - CH 2 - COOH . Glicyna jest jednym z aminokwasów proteinogennych . Jest kodowany przez wszystkie kodony zaczynające się od GG (GGU, GGC, GGA, GGG). Glicyna jest integralną częścią tworzenia alfa-helis w drugorzędowej strukturze białka ze względu na jej zwartą formę. Z tego samego powodu jest to aminokwas najobficiej występujący w potrójnych helisach kolagenowych . Glicyna jest również neuroprzekaźnikiem hamującym – ingerencja w jej uwalnianie w obrębie rdzenia kręgowego (np. podczas infekcji Clostridium tetani ) może powodować porażenie spastyczne z powodu niehamowanego skurczu mięśni.
Glicyna to bezbarwne, krystaliczne ciało stałe o słodkim smaku. Jest to jedyny achiralny aminokwas proteinogenny . Może pasować do środowisk hydrofilowych lub hydrofobowych , ze względu na minimalny łańcuch boczny tylko jednego atomu wodoru. Rodnikiem acylowym jest glicyl .
Historia i etymologia
Glicyna została odkryta w 1820 roku przez francuskiego chemika Henri Braconnota , który zhydrolizował żelatynę przez gotowanie jej z kwasem siarkowym . Pierwotnie nazwał go „cukrem żelatyny”, ale francuski chemik Jean-Baptiste Boussingault wykazał, że zawiera azot. Amerykański naukowiec Eben Norton Horsford , wówczas uczeń niemieckiego chemika Justusa von Liebiga , zaproponował nazwę „glikokol”; jednak szwedzki chemik Berzelius zaproponował prostszą nazwę „glicyna”. Nazwa pochodzi od greckiego wyrazu γλυκύς „słodkim smaku” (co jest również związane z prefiksy gliko- i gliko- , jak w glikoproteiny i glukozy ). W 1858 roku, francuski chemik Augusta Cahours ustalono, że glicyna był aminy z kwasem octowym .
Produkcja
Chociaż glicynę można wyizolować z hydrolizowanego białka, nie jest ona wykorzystywana do produkcji przemysłowej, ponieważ można ją wygodniej wytwarzać na drodze syntezy chemicznej. Te dwa główne procesy aminowanie kwasem chlorooctowym z amoniakiem , dając glicynę i chlorek amonu oraz Strecker amino syntezy kwasu , który jest głównym sposobem syntezy w Stanach Zjednoczonych, Japonii. W ten sposób produkuje się rocznie około 15 tys. ton .
Glicyna jest również kogenerowana jako zanieczyszczenie w syntezie EDTA , powstające w reakcjach współproduktu amoniaku.
Reakcje chemiczne
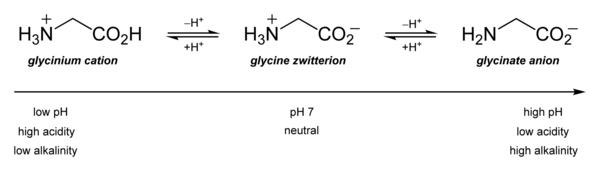
Najważniejsze są jego właściwości kwasowo-zasadowe. W roztworze wodnym, glicyna jest sam amfoteryczny : przy niskim pH cząsteczka może być sprotonowany z AP K około 2,4 i przy wysokim pH traci protonu z AP K a około 9,6 (Dokładne wartości p K zależy od temperatury i siła jonowa).
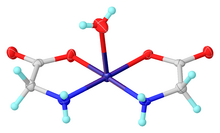
Glicyna działa jako ligand dwukleszczowy dla wielu jonów metali. Typowe jest kompleks Cu (glicynian), 2 , tj Cu (H 2 NCH 2 CO 2 ) 2 , który istnieje zarówno w izomery cis i trans.
Jako dwufunkcyjna cząsteczka glicyna reaguje z wieloma odczynnikami. Można je podzielić na reakcje z centrum N i centrum karboksylanu.
Amina ulega oczekiwanym reakcjom. Z chlorków kwasowych otrzymuje się kwas amidokarboksylowy, taki jak kwas hipurowy i acetyloglicyna . Z kwasem azotawym otrzymuje się kwas glikolowy ( oznaczenie van Slyke'a ). Z jodkiem metylu amina zostaje czwartorzędowana, dając trimetyloglicynę , produkt naturalny:
-
h
3n+
CH
2GRUCHAĆ−
+ 3 CH 3 I → (CH
3)
3n+
CH
2GRUCHAĆ−
+ 3 WYSOKI
Glicyna kondensuje się ze sobą dając peptydy, zaczynając od utworzenia glicyloglicyny :
- 2 godz
3n+
CH
2GRUCHAĆ−
→ H
3n+
CH
2CONHCH
2GRUCHAĆ−
+ H 2 O
Piroliza glicyny lub glicyloglicyny daje 2,5-diketopiperazynę , cykliczny diamid.
Metabolizm
Biosynteza
Glicyna nie jest niezbędna w diecie człowieka , ponieważ jest biosyntetyzowana w organizmie z aminokwasu seryny , który z kolei pochodzi z 3-fosfoglicerynianu , ale zdolność metaboliczna do biosyntezy glicyny nie zaspokaja potrzeby syntezy kolagenu. W większości organizmów enzym hydroksymetylotransferaza serynowa katalizuje tę przemianę poprzez kofaktor fosforan pirydoksalu :
- seryna + tetrahydrofolian → glicyna + N 5 , N 10- metylenotetrahydrofolian + H 2 O
W wątrobie kręgowców synteza glicyny jest katalizowana przez syntazę glicyny (zwaną również enzymem rozszczepiania glicyny). Ta konwersja jest łatwo odwracalna :
- CO 2 + NH+
4+ N 5 , N 10- metylenotetrahydrofolian + NADH + H + ⇌ Glicyna + tetrahydrofolian + NAD +
Oprócz tego, że jest syntetyzowana z seryny, glicyna może również pochodzić z treoniny , choliny lub hydroksyproliny poprzez metabolizm międzynarządowy wątroby i nerek.
Degradacja
Glicyna jest degradowana trzema drogami. Dominującym szlakiem u zwierząt i roślin jest odwrotność szlaku syntazy glicyny wspomnianej powyżej. W tym kontekście zaangażowany układ enzymatyczny jest zwykle nazywany układem rozszczepiania glicyny :
- Glicyna + tetrahydrofolian + NAD + ⇌ CO 2 + NH+
4+ N 5 , N 10 -metyleno tetrahydrofolian + NADH + H +
W drugim szlaku glicyna jest degradowana w dwóch etapach. Pierwszym krokiem jest odwrócenie biosyntezy glicyny z seryny za pomocą hydroksymetylotransferazy serynowej. Seryna jest następnie przekształcana w pirogronian przez dehydratazę serynową .
W trzecim szlaku jej rozkładu glicyna jest przekształcana do glioksylanu przez oksydazę D-aminokwasową . Glioksylan jest następnie utleniany przez dehydrogenazę mleczanową wątroby do szczawianu w reakcji zależnej od NAD + .
Okres półtrwania glicyny i jej eliminacja z organizmu różni się znacznie w zależności od dawki. W jednym badaniu okres półtrwania wahał się od 0,5 do 4,0 godzin.
Glicyna jest niezwykle wrażliwa na antybiotyki ukierunkowane na foliany, a poziom glicyny we krwi znacznie spada w ciągu minuty od wstrzyknięcia antybiotyku. Niektóre antybiotyki mogą zubożyć ponad 90% glicyny w ciągu kilku minut od podania.
Funkcja fizjologiczna
Główną funkcją glicyny jest działanie jako prekursor białek . Większość białek zawiera tylko niewielkie ilości glicyny, godnym uwagi wyjątkiem jest kolagen , który zawiera około 35% glicyny ze względu na swoją okresowo powtarzaną rolę w tworzeniu struktury helisy kolagenu w połączeniu z hydroksyproliną . W kodzie genetycznym glicyna jest kodowana przez wszystkie kodony zaczynające się od GG, czyli GGU, GGC, GGA i GGG.
Jako biosyntetyczny półprodukt
U wyższych eukariontów , kwas δ-aminolewulinowego , klucz prekursorem porfiryn jest biosyntetyzowana z glicyny i sukcynylo-CoA przez enzym ALA syntazy . Glicyna stanowi główne C 2 N podjednostki wszystkie puryny .
Jako neuroprzekaźnik
Glicyna jest neuroprzekaźnikiem hamującym w ośrodkowym układzie nerwowym , zwłaszcza w rdzeniu kręgowym , pniu mózgu i siatkówce . Gdy receptory glicyny są aktywowane, chlorek wchodzi do neuronu przez receptory jonotropowe, powodując hamujący potencjał postsynaptyczny (IPSP). Strychnina jest silnym antagonistą jonotropowych receptorów glicyny, natomiast bikukulina jest słabym antagonistą . Glicyna jest wymaganym współagonistą wraz z glutaminianem dla receptorów NMDA . W przeciwieństwie do hamującej roli glicyny w rdzeniu kręgowym, to zachowanie jest ułatwione przez receptory glutaminergiczne ( NMDA ) , które są pobudzające. LD 50 glicyny wynosi 7930 mg / kg u szczurów (doustnie), i zazwyczaj powoduje śmierć nadpobudliwość.
Zastosowania
W Stanach Zjednoczonych glicyna jest zwykle sprzedawana w dwóch klasach: Farmakopei Stanów Zjednoczonych („USP”) i technicznej. Sprzedaż gatunku USP stanowi około 80 do 85 procent amerykańskiego rynku glicyny. Jeśli wymagana jest czystość wyższa niż standard USP, na przykład do wstrzyknięć dożylnych , można zastosować droższą glicynę o jakości farmaceutycznej. Glicyna klasy technicznej, która może, ale nie musi spełniać normy klasy USP, jest sprzedawana po niższej cenie do użytku w zastosowaniach przemysłowych, np. jako środek kompleksowania i wykańczania metali.
Żywność dla zwierząt i ludzi
Glicyna nie jest powszechnie stosowana w żywności ze względu na jej wartość odżywczą, z wyjątkiem naparów. Zamiast tego rola glicyny w chemii żywności jest jako środek aromatyzujący. Jest łagodnie słodki i przeciwdziała posmakowi sacharyny . Ma również właściwości konserwujące, być może dzięki kompleksowaniu z jonami metali. Kompleksy glicynianu metali, np. glicynian miedzi(II) są stosowane jako dodatki do pasz dla zwierząt.
Surowiec chemiczny
Glicyna jest półproduktem w syntezie różnych produktów chemicznych. Wykorzystywany jest do produkcji herbicydów: glifosat , iprodion , glifosyna, imiprotryna oraz eglinazyna. Jest stosowany jako półprodukt leku, takiego jak tiamfenikol .
Badania laboratoryjne
Glicyna jest istotnym składnikiem niektórych roztworów stosowanych w metodzie analizy białek SDS-PAGE . Służy jako środek buforujący, utrzymujący pH i zapobiegający uszkodzeniom próbki podczas elektroforezy. Glicynę stosuje się również do usuwania przeciwciał znakujących białka z membran Western blot, aby umożliwić sondowanie wielu interesujących białek z żelu SDS-PAGE. Pozwala to na pobranie większej ilości danych z tej samej próbki, zwiększając wiarygodność danych, zmniejszając ilość przetwarzania próbki i liczbę wymaganych próbek. Ten proces jest znany jako stripping.
Obecność w kosmosie
Obecność glicyny poza Ziemią została potwierdzona w 2009 roku na podstawie analizy próbek pobranych w 2004 roku przez sondę NASA Stardust z komety Wild 2, a następnie zwróconych na Ziemię. Glicyna została wcześniej zidentyfikowana w meteorycie Murchison w 1970 roku. Odkrycie kometarnej glicyny potwierdziło hipotezę panspermii , która głosi, że „cegiełki” życia są szeroko rozpowszechnione w całym wszechświecie. W 2016 roku ogłoszono wykrycie glicyny w komecie 67P/Czuriumow-Gierasimienko przez sondę Rosetta .
Dyskutowano o wykrywaniu glicyny poza Układem Słonecznym w ośrodku międzygwiazdowym . W 2008 roku Instytut Radioastronomii im. Maxa Plancka odkrył linie widmowe podobnej do glicyny cząsteczki aminoacetonitrylu w Wielkim Molecule Heimat , gigantycznym obłoku gazu w pobliżu centrum galaktyki w gwiazdozbiorze Strzelca .
Ewolucja
Kilka niezależnych badań ewolucyjnych wykorzystujących różne rodzaje danych sugeruje, że glicyna należy do grupy aminokwasów, które stanowiły wczesny kod genetyczny. Na przykład regiony o niskiej złożoności (w białkach), które mogą przypominać protopeptydy wczesnego kodu genetycznego, są wysoce wzbogacone w glicynę.
Obecność w żywności
| Żywność | g/100g |
|---|---|
| Przekąski, skórki wieprzowe | 11.04 |
| Mąka sezamowa (niskotłuszczowa) | 3,43 |
| Napoje białkowe w proszku (na bazie soi ) | 2,37 |
| Nasiona, mączka z krokosza barwierskiego, częściowo odtłuszczona | 2,22 |
| Mięso, żubr, wołowina i inne (różne części) | 1,5-2,0 |
| Desery żelatynowe | 1,96 |
| Nasiona, pestki dyni i pestek dyni | 1,82 |
| Indyk, wszystkie klasy, grzbiet, mięso i skóra | 1,79 |
| Kurczak, brojlery lub frytownice, mięso i skóry | 1,74 |
| Wieprzowina, mielona, 96% chudego / 4% tłuszczu, gotowana, kruszonka | 1.71 |
| Paluszki z bekonem i wołowiną | 1.64 |
| Orzeszki ziemne | 1,63 |
| Skorupiaki , langusty | 1,59 |
| Przyprawy, gorczyca , mielone | 1,59 |
| Salami | 1,55 |
| Orzechy, orzechy piżmowe , suszone | 1,51 |
| Ryby, łosoś, różowe, konserwy, odsączone produkty stałe | 1,42 |
| migdały | 1,42 |
| Ryba, makrela | 0,93 |
| Zboża gotowe do spożycia, granola, domowe | 0,81 |
| Pory , (część bulwiasta i dolna część liścia), liofilizowane | 0,7 |
| Ser, parmezan (i inne), tarty | 0,56 |
| Soja , zielona, gotowana, gotowana, odsączana, bez soli | 0,51 |
| Chleb, białko (zawiera gluten) | 0,47 |
| Jajko, całe, gotowane, smażone | 0,47 |
| Fasola, biała, dojrzałe nasiona, gotowana, gotowana, z solą | 0,38 |
| Soczewica, dojrzałe nasiona, gotowane, gotowane, z solą | 0,37 |
Zobacz też
Bibliografia
Dalsza lektura
- Kuan YJ, Charnley SB, Huang HC i in. (2003). „Glicyna międzygwiazdowa” . Astrofia J . 593 (2): 848-867. Kod bib : 2003ApJ...593..848K . doi : 10.1086/375637 .
- Nowak, Rachel. "Aminokwas znaleziony w kosmosie - 18 lipca 2002 - New Scientist " . Pobrano 2007-07-01 .
Zewnętrzne linki
- Widmo MS glicyny
- Glicyna na PDRHealth.com
- System rozszczepiania glicyny
- Terapia glicyną – nowy kierunek leczenia schizofrenii?
- „Cząsteczka organiczna, podobna do aminokwasu, znaleziona w konstelacji Strzelca” . NaukaCodziennie . 27 marca 2008 r.
- Tsai, Guochuan E. (1 grudnia 2008). „Nowa klasa leków przeciwpsychotycznych: wzmocnienie neuroprzekaźnictwa za pośrednictwem receptorów NMDA” . Czasy psychiatryczne . 25 (14).
- ChemSub Online (Glicyna) .
- Naukowcy NASA odkryli glicynę, podstawowy budulec życia, w próbkach komety Wild 2 zwróconych przez statek kosmiczny NASA Stardust.