Glikopeptyd - Glycopeptide
Glikopeptydy są peptydy , które zawierają węglowodany ugrupowania ( glikanów ) , kowalencyjnie przyłączone do łańcuchów bocznych tych aminokwasowych reszt tworzących peptyd.
W ciągu ostatnich kilkudziesięciu lat uznano, że glikany na powierzchni komórki (przyłączone do białek błonowych lub lipidów ) oraz te związane z białkami ( glikoproteiny ) odgrywają kluczową rolę w biologii. Na przykład wykazano, że te konstrukty odgrywają ważną rolę w zapłodnieniu , układzie odpornościowym , rozwoju mózgu , układzie hormonalnym i zapaleniu .
Syntezy glikopeptydów dostarcza sond biologicznych naukowców do wyjaśnienia funkcji glikanu w przyrodzie i produktów, które mają użyteczne zastosowania terapeutyczne i biotechnologicznych.
Różnorodność wiązania glikopeptydowego
Glikany N- połączone
Glikany N- połączone wywodzą swoją nazwę od faktu, że glikan jest przyłączony do reszty asparaginy (Asn, N) i są jednymi z najczęstszych wiązań występujących w przyrodzie. Chociaż większość N-połączonych glikanów przyjmuje postać GlcNAc-β-Asn, zaobserwowano inne mniej powszechne wiązania strukturalne, takie jak GlcNac-α-Asn i Glc-Asn. Oprócz ich funkcji w fałdowaniu białka i przyłączaniu komórek, N-podobne glikany w białku mogą modulować funkcję białka, w niektórych przypadkach działając jako przełącznik on-off.
Glikany O- połączone
Glikany O- połączone są tworzone przez połączenie między hydroksylowym łańcuchem bocznym aminokwasu (zwykle z seryny lub treoniny ) z glikanem. Większość glikanów O- połączonych ma postać GlcNac-β-Ser/Thr lub GalNac-α-Ser/Thr.
Glikany połączone przez C
Spośród trzech wiązań najmniej powszechnym i najmniej zrozumiałym są glikany połączone z atomem węgla . Wiązanie C odnosi się do kowalencyjnego przyłączenia mannozy do reszty tryptofanu . Przykładem C-połączonego glikanu jest α-mannozylotryptofan.
Synteza glikopeptydów
W literaturze opisano kilka metod syntezy glikopeptydów. Spośród tych metod najczęstsze strategie są wymienione poniżej.
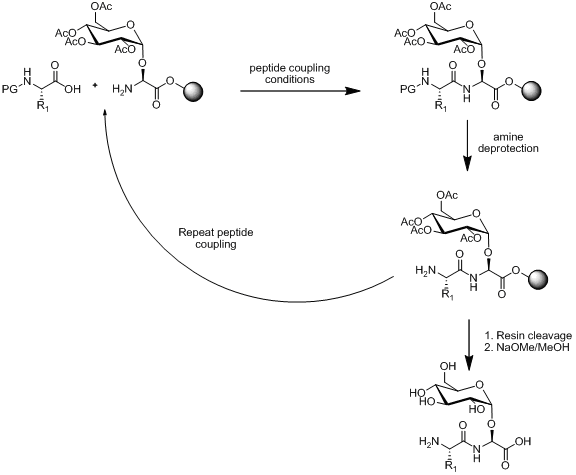
Synteza peptydów w fazie stałej
W ramach syntezy peptydów w fazie stałej (SPPS) istnieją dwie strategie syntezy glikopeptydów, łączenie liniowe i konwergentne. Montaż liniowy polega na syntezie cegiełek, a następnie wykorzystaniu SPPS do połączenia cegiełek ze sobą. Poniżej przedstawiono zarys tego podejścia.
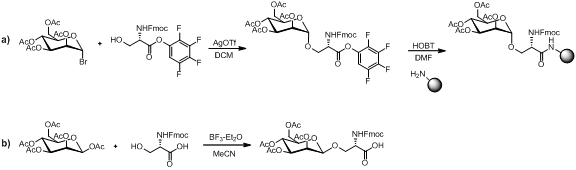
Istnieje kilka metod syntezy bloku budulcowego aminokwasów monosacharydowych , jak zilustrowano poniżej.
Pod warunkiem, że blok budulcowy aminokwasu monosacharydowego jest stabilny wobec warunków sprzęgania peptydów, warunków odbezpieczania amin i rozszczepiania żywicy. Składanie liniowe pozostaje popularną strategią syntezy glikopeptydów z wieloma przykładami w literaturze.
W strategii konwergentnego składania łańcuch peptydowy i reszta glikanu są najpierw oddzielnie syntezowane. Następnie glikan jest glikozylowany na określoną resztę łańcucha peptydowego. To podejście nie jest tak popularne jak strategia liniowa ze względu na słabą wydajność reakcji na etapie glikozylacji .
Inną strategią wytwarzania bibliotek glikopeptydów jest wykorzystanie techniki syntezy Glyco-SPOT. Technika rozszerza dotychczasową metodę syntezy SPOT. W metodzie tej biblioteki glikopeptydów wytwarzane są na powierzchni celulozy (np. bibuła filtracyjna), która pełni rolę fazy stałej. Glikopeptydy są wytwarzane przez nanoszenie aminokwasów chronionych FMOC, co pozwala na przeprowadzenie syntezy w skali mikrogramowej (nanomolowej) przy użyciu bardzo małych ilości glikoaminokwasów. Skala tej techniki może być zaletą przy tworzeniu bibliotek do przeszukiwania przy użyciu mniejszych ilości glikoaminokwasów na peptyd. Jednak do wytwarzania większych ilości glikopeptydów lepsze byłyby tradycyjne techniki fazy stałej oparte na żywicy.
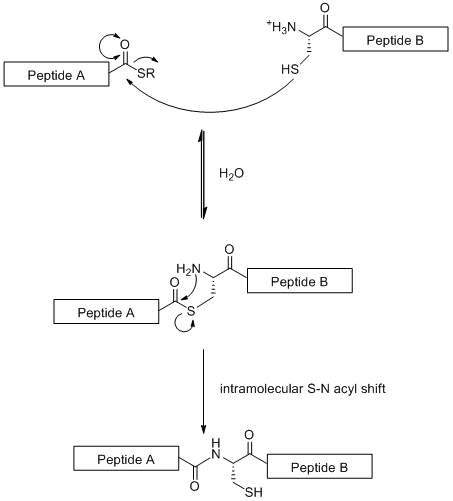
Natywna ligacja chemiczna
Natywna ligacja chemiczna (NCL) jest konwergentną strategią syntetyczną opartą na liniowym sprzężeniu fragmentów glikopeptydów. Technika ta wykorzystuje reakcję chemoselektywną pomiędzy N-końcową resztą cysteiny na jednym fragmencie peptydowym z tioestrem na C-końcu drugiego fragmentu peptydowego, jak zilustrowano poniżej.
W przeciwieństwie do standardowego SPPS (który jest ograniczony do 50 reszt aminokwasowych) NCL umożliwia budowę dużych glikopeptydów. Jednak strategia jest ograniczona przez fakt, że wymaga reszty cysteiny na N-końcu , reszty aminokwasowej, która jest rzadka w naturze. Jednakże problem ten został częściowo rozwiązany przez selektywne odsiarczanie reszty cysteiny do alaniny .
Zobacz też
Bibliografia
Dalsza lektura
- Emanualni Maveraki; i in. „Glikany w układzie odpornościowym i zmieniona teoria autoimmunizacji glikanów” (PDF) .
Zewnętrzne linki
-
 Multimedia związane z glikopeptydami w Wikimedia Commons
Multimedia związane z glikopeptydami w Wikimedia Commons