Wirusowe zapalenie wątroby typu D - Hepatitis D
| Wirusowe zapalenie wątroby typu D | |
|---|---|
| Inne nazwy | delta zapalenia wątroby |
| Specjalność | Gastroenterologia , choroba zakaźna |
| Objawy | Uczucie zmęczenia, nudności i wymioty |
| Komplikacje | Marskość |
| Powoduje | Wirus zapalenia wątroby typu D |
| Metoda diagnostyczna | Immunoglobulina G |
| Leczenie | Leki przeciwwirusowe, pegylowany interferon alfa |
| Lek | Bulewirtyd |
Wirusowe zapalenie wątroby typu D jest rodzajem wirusowego zapalenia wątroby wywołanego przez wirus zapalenia wątroby typu delta ( HDV ). HDV jest jednym z pięciu znanych zapalenia wątroby wirusów: A , B , C , D i E . HDV jest uważany za satelitę (rodzaj czynnika subwirusowego ), ponieważ może się rozprzestrzeniać tylko w obecności wirusa zapalenia wątroby typu B (HBV). Przeniesienie wirusa HDV może nastąpić albo poprzez równoczesne zakażenie wirusem HBV ( koinfekcja ) albo nałożone na przewlekłe zapalenie wątroby typu B lub nosicielstwo wirusa zapalenia wątroby typu B ( nadkażenie ).
Zarażające człowieka jednocześnie wirusem HDV i HBV uważa się za najpoważniejszy rodzaj wirusowego zapalenia wątroby ze względu na stopień powikłań. Powikłania te obejmują większe prawdopodobieństwo wystąpienia niewydolności wątroby w ostrych infekcjach i szybką progresję do marskości wątroby , ze zwiększonym ryzykiem rozwoju raka wątroby w przewlekłych infekcjach. W połączeniu z wirusem zapalenia wątroby typu B, zapalenie wątroby typu D ma najwyższy wskaźnik śmiertelności spośród wszystkich infekcji zapalenia wątroby, wynoszący 20%. Ostatnie szacunki z 2020 roku sugerują, że obecnie 48 milionów osób jest zarażonych tym wirusem.
Wirusologia
| Wirus delta zapalenia wątroby | |
|---|---|
|
|
| Schematyczne przedstawienie wirionu delta wirusa zapalenia wątroby | |
|
Klasyfikacja wirusów |
|
| (bez rankingu): | Wirus |
| Królestwo : | Rybozywiria |
| Rodzina: | Kolmioviridae |
| Rodzaj: | Deltawirus |
| Gatunek | |
|
|
Struktura i genom
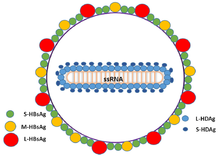
Wirusy delta zapalenia wątroby lub HDV to osiem gatunków jednoniciowych wirusów RNA o negatywnym sensie (lub cząstek wirusopodobnych) sklasyfikowanych razem jako rodzaj Deltavirus , w obrębie domeny Ribozyviria . Wirion HDV jest małą, kulistą otoczką o średnicy 36 nm; jego otoczka wirusowa zawiera fosfolipidy gospodarza, a także trzy białka pobrane z wirusa zapalenia wątroby typu B – duże, średnie i małe antygeny powierzchniowe wirusa zapalenia wątroby typu B. Ten zespół otacza wewnętrzną cząstkę rybonukleoproteiny (RNP), która zawiera genom otoczony około 200 cząsteczkami antygenu wirusa zapalenia wątroby typu D (HDAg) dla każdego genomu. Wykazano, że centralny region HDAg wiąże RNA. W kilku interakcjach pośredniczy również region typu coiled-coil na końcu N HDAg.
Genom HDV jest jednoniciowym, zamkniętym kolistym RNA o ujemnym sensu ; z genomem około 1700 nukleotydów, HDV jest najmniejszym „wirusem”, o którym wiadomo, że zaraża zwierzęta. Sugerowano, że HDV mógł pochodzić z klasy patogenów roślinnych zwanych wiroidami , które są znacznie mniejsze niż wirusy. Jego genom jest unikalny wśród wirusów zwierzęcych ze względu na wysoką zawartość nukleotydów GC. Jego sekwencja nukleotydowa jest w około 70% samokomplementarna, dzięki czemu genom może uformować częściowo dwuniciową, podobną do pręcika strukturę RNA. Szczepy HDV są bardzo rozbieżne; istnieją fuzje różnych szczepów, a sekwencje zdeponowano w publicznych bazach danych, wykorzystując różne miejsca startowe dla zaangażowanego kolistego wirusowego DNA. Spowodowało to pewien chaos w klasyfikacji molekularnej tego wirusa, sytuację, która została ostatnio rozwiązana dzięki przyjęciu proponowanego genomu referencyjnego i jednolitego systemu klasyfikacji.
Koło życia
Podobnie jak wirusowe zapalenie wątroby typu B, HDV dostaje się do komórek wątroby przez transporter żółci NTCP . HDV rozpoznaje swój receptor przez N-końcową domenę antygenu powierzchniowego dużego wirusa zapalenia wątroby typu B, HBsAg . Mapowanie przez mutagenezę tej domeny wykazało, że reszty aminokwasowe 9-15 tworzą miejsce wiązania receptora. Po wejściu do hepatocytu wirus jest niepowlekany, a nukleokapsyd translokowany do jądra z powodu sygnału w HDAg Ponieważ genom HDV nie koduje polimerazy RNA do replikacji genomu wirusa, wirus wykorzystuje polimerazy RNA komórki gospodarza . Początkowo sądzono, że wykorzystuje się tylko polimerazę RNA II, teraz wykazano również, że polimerazy RNA I i III są zaangażowane w replikację HDV. Zwykle polimeraza RNA II wykorzystuje DNA jako matrycę i wytwarza mRNA. W konsekwencji, jeśli HDV rzeczywiście wykorzystuje polimerazę RNA II podczas replikacji, byłby to jedyny znany patogen zwierzęcy zdolny do stosowania polimerazy zależnej od DNA jako polimerazy zależnej od RNA.
Polimerazy RNA traktują genom RNA jako dwuniciowy DNA z powodu złożonej struktury przypominającej pałkę, w której się znajduje. Wytwarzane są trzy formy RNA; kolisty genomowy RNA, kolisty komplementarny antygenomowy RNA i liniowy poliadenylowany antygenomowy RNA, który jest mRNA zawierającym otwartą ramkę odczytu dla HDAg. Synteza antygenomowego RNA zachodzi w jąderku za pośrednictwem polimerazy RNA I, podczas gdy synteza genomowego RNA odbywa się w nukleoplazmie za pośrednictwem polimerazy RNA II. RNA HDV jest najpierw syntetyzowany jako liniowy RNA, który zawiera wiele kopii genomu. Genomowy i antygenomowy RNA zawiera sekwencję 85 nukleotydów, rybozymu wirusa zapalenia wątroby delta , który działa jak rybozym , który samoczynnie rozszczepia liniowy RNA na monomery. Te monomery są następnie ligowane, aby utworzyć kolisty RNA.
Antygeny delta
| Antygen delta wirusa zapalenia wątroby typu delta | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 domena oligomeryzacji antygenu delta zapalenia wątroby
| |||||||||
| Identyfikatory | |||||||||
| Symbol | HDV_ag | ||||||||
| Pfam | PF01517 | ||||||||
| InterPro | IPR002506 | ||||||||
| SCOP2 | 1a92 / zakres / SUPFAM | ||||||||
| |||||||||
Istotna różnica między wiroidami a HDV polega na tym, że chociaż wiroidy nie wytwarzają białek, wiadomo, że HDV wytwarza jedno białko, a mianowicie HDAg. Występuje w dwóch formach; 27kDa duży-HDAg i mały-HDAg 24kDa. N-końce obu form są identyczne, różnią się o 19 aminokwasów na końcu C dużego HDAg. Obie izoformy są wytwarzane z tej samej ramki odczytu, która zawiera kodon stop UAG w kodonie 196, który normalnie wytwarza tylko mały-HDAg. Jednak edycja przez komórkowy enzym deaminazę adenozynową-1 zmienia kodon stop na UGG, umożliwiając wytwarzanie dużego HDAg. Pomimo 90% identycznych sekwencji, te dwa białka odgrywają odmienne role w przebiegu infekcji. HDAg-S jest wytwarzany we wczesnych stadiach infekcji i wchodzi do jądra komórkowego i wspomaga replikację wirusa. W przeciwieństwie do tego HDAg-L jest wytwarzany w późniejszych stadiach infekcji, działa jako inhibitor replikacji wirusa i jest wymagany do tworzenia cząstek wirusa. Tak więc edycja RNA przez enzymy komórkowe ma kluczowe znaczenie dla cyklu życiowego wirusa, ponieważ reguluje równowagę między replikacją wirusa a tworzeniem wirionów.
Zakaźność pętli antygenowej
Białko otoczki HDV ma zakotwiczone do niego trzy białka powierzchniowe HBV. Region S genomu jest najczęściej wyrażany, a jego główną funkcją jest składanie cząstek subwirusowych. Białka antygenowe HDV łączą się z genomem wirusa, tworząc rybonukleoproteinę (RNP), która po opłaszczeniu cząstkami subwirusowymi może tworzyć cząstki wirusopodobne, które są prawie identyczne z dojrzałym HDV, ale nie są zakaźne. Naukowcy doszli do wniosku, że wyznacznikiem zakaźności HDV jest N-końcowa domena pre-S1 dużego białka (L). Stwierdzono, że jest mediatorem w wiązaniu się z receptorem komórkowym. Badacze Georges Abou Jaoudé i Camille Sureau opublikowali w 2005 roku artykuł, w którym badali rolę pętli antygenowej znajdującej się w białkach otoczki HDV w zakaźności wirusa. Pętla antygenowa, podobnie jak N-końcowa domena pre-S1 dużego białka, jest odsłonięta na powierzchni wirionu. Badanie Jaoudé i Sureau dostarczyło dowodów na to, że pętla antygenowa może być ważnym czynnikiem we wnikaniu wirusa HDV do komórki gospodarza, a poprzez mutację części pętli antygenowej można zminimalizować zakaźność wirusa HDV.
Przenoszenie
Drogi przenoszenia wirusowego zapalenia wątroby typu D są podobne do tych, które występują w przypadku zapalenia wątroby typu B. Zakażenie jest w dużej mierze ograniczone do osób z wysokim ryzykiem zakażenia wirusem zapalenia wątroby typu B, zwłaszcza osób przyjmujących narkotyki drogą iniekcji oraz osób otrzymujących koncentraty czynnika krzepnięcia. Na całym świecie współzakażonych jest ponad 15 milionów ludzi. HDV występuje rzadko w większości krajów rozwiniętych i wiąże się głównie z dożylnym zażywaniem narkotyków . Jednak HDV jest znacznie bardziej powszechny w bezpośrednim regionie Morza Śródziemnego, Afryce Subsaharyjskiej, na Bliskim Wschodzie iw północnej części Ameryki Południowej. W sumie około 20 milionów ludzi może być zarażonych wirusem HDV.
Zapobieganie
Szczepionka przeciwko wirusowemu zapaleniu wątroby typu B chroni przed wirusem zapalenia wątroby typu D, ponieważ ten ostatni jest uzależniony od obecności wirusa zapalenia wątroby typu B w celu replikacji.
W przypadku braku specyficznej szczepionki przeciwko wirusowi delta, szczepionkę przeciwko HBV należy podać wkrótce po urodzeniu w grupach ryzyka .
Leczenie
Wirusowe zapalenie wątroby typu D jest ogólnie uważane za wirus dominujący nad wirusowym zapaleniem wątroby typu B, z wyjątkiem rzadkich przypadków. Obecnie ustalone metody leczenia przewlekłego zapalenia wątroby typu D obejmują konwencjonalną lub pegylowaną terapię interferonem alfa . Najnowsze dowody sugerują, że pegylowany interferon alfa jest skuteczny w zmniejszaniu miana wirusa i skutków choroby w czasie podawania leku, ale korzyści na ogół ustają po odstawieniu leku. Skuteczność tego leczenia zwykle nie przekracza ~20%, a donoszono o późnym nawrocie po terapii.
W maju 2020 Produktów Leczniczych do stosowania u ludzi w Europejskiej Agencji Leków zatwierdziła przeciwwirusowe Hepcludex ( bulevirtide ) do leczenia zapalenia wątroby typu D i B. Bulevirtide wiąże i inaktywuje sodu / kwas żółciowy , blokując oba wirusy wchodzących hepatocytów .
Epidemiologia

Osoby dotknięte chorobą to osoby, które zostały zakażone wirusem zapalenia wątroby typu B, ponieważ wirus zapalenia wątroby typu D (HDV) potrzebuje HBsAg (antygen powierzchniowy wirusa zapalenia wątroby typu B) do pakowania i przenoszenia. Choroba występuje na całym świecie. Zakażenie wirusem HDV jest główną plagą medyczną w regionach świata o niskich dochodach, w których HBV pozostaje endemiczny. Jest to zatem najbardziej rozpowszechnione w krajach, w których zakażenie HBV jest również powszechne, obecnie w dorzeczu Amazonki oraz w regionach Azji i Afryki o niskich dochodach. Udoskonalone środki kontroli HBV w krajach uprzemysłowionych (takie jak szczepienia) również zmniejszyły częstość występowania wirusa HDV, przy czym głównymi pozostałymi zagrożonymi populacjami w tych krajach są użytkownicy narkotyków iniekcyjnych i imigranci z obszarów endemicznych HDV.
Historia
Wirus zapalenia wątroby typu D został po raz pierwszy zgłoszony w 1977 r. jako antygen jądrowy u pacjentów zakażonych HBV z ciężką chorobą wątroby. Uważano, że ten antygen jądrowy jest antygenem wirusa zapalenia wątroby typu B i nazwano go antygenem delta. Kolejne eksperymenty na szympansach wykazały, że antygen delta zapalenia wątroby (HDAg) był strukturalną częścią patogenu, który do wytworzenia kompletnej cząsteczki wirusa wymagał zakażenia HBV. Cały genom został sklonowany i zsekwencjonowany w 1986 roku. Następnie został umieszczony we własnym rodzaju: Deltavirus .
gorączka Labrea
| gorączka Labrea | |
|---|---|
| Inne nazwy | Czarna gorączka Lábrea, zapalenie wątroby Lábrea, gorączka Santa Marta |
| Specjalność | Choroba zakaźna |
| Zwykły początek | nagły |
| Czas trwania | około. 1 tydzień |
| Zapobieganie | Szczepienie HBV |
| Rokowanie | śmierć |
Gorączka Lábrea to śmiertelna infekcja tropikalna odkryta w latach 50. XX wieku w mieście Lábrea , w dorzeczu brazylijskiej Amazonki , gdzie występuje głównie na obszarze na południe od Amazonki, w stanach Acre , Amazonas i Rondônia . Chorobę zdiagnozowano również w Kolumbii i Peru. Obecnie wiadomo, że jest to koinfekcja lub nadkażenie wirusowego zapalenia wątroby typu B (HBV) z wirusowym zapaleniem wątroby typu D.
Gorączka Lábrea ma nagły początek, z żółtaczką , anoreksją (brak apetytu), krwawymi wymiotami ( wymiotami krwi), bólem głowy , gorączką i ciężkim osłabieniem . Śmierć następuje z powodu ostrej niewydolności wątroby (ALF). W ostatniej fazie często pojawiają się objawy neurologiczne, takie jak pobudzenie, majaczenie , drgawki i śpiączka krwotoczna . Objawy te wynikają z piorunującego zapalenia wątroby, które może zabić w czasie krótszym niż tydzień i które charakterystycznie dotyka dzieci i młodych dorosłych oraz więcej mężczyzn niż kobiet. W wielu przypadkach towarzyszy mu również zapalenie mózgu . Choroba jest wysoce śmiertelna: w badaniu przeprowadzonym w 1986 roku w Boca do Acre , również w Amazonii, 39 z 44 pacjentów zmarło w ostrej fazie choroby. Osoby, które przeżyły, mogą rozwinąć chorobę przewlekłą .
Głównego odkrycia wirusa delta i związku HBV dokonała Gilberta Bensabath z Instituto Evandro Chagas w Belém w stanie Pará i jej współpracownicy.
Zakażeni pacjenci wykazują rozległe zniszczenie tkanki wątroby , ze stłuszczeniem określonego typu (mikrostłuszczenie, charakteryzujące się małymi kropelkami tłuszczu wewnątrz komórek) oraz naciekaniem dużej liczby komórek zapalnych zwanych komórkami morula , składających się głównie z makrofagów zawierających antygeny wirusa delta .
W badaniu Boca do Acre z 1987 r. naukowcy przeprowadzili badanie epidemiologiczne i stwierdzili zakażenie wirusem delta u 24% bezobjawowych nosicieli HBV, 29% przypadków ostrego niepiorunującego zapalenia wątroby typu B, 74% przypadków piorunującego zapalenia wątroby typu B i 100% przypadków przewlekłego wirusowego zapalenia wątroby typu B sprawy. Wirus delta wydaje się być endemiczny w regionie Amazonii.
Ewolucja
Pierwotnie opisano trzy genotypy (I–III). Genotyp I został wyizolowany w Europie, Ameryce Północnej, Afryce i niektórych Azji. Genotyp II został znaleziony w Japonii, Tajwanie i Jakucji (Rosja). Genotyp III został znaleziony wyłącznie w Ameryce Południowej (Peru, Kolumbia i Wenezuela). Niektóre genomy z Tajwanu i wysp Okinawy były trudne do typowania, ale zostały umieszczone w genotypie 2. Obecnie jednak wiadomo, że istnieje co najmniej 8 genotypów tego wirusa (od HDV-1 do HDV-8). Badania filogenetyczne sugerują afrykańskie pochodzenie tego patogenu.
Analiza 36 szczepów genotypu 3 oszacowała, że najnowszy wspólny przodek tych szczepów powstał około 1930 roku. Ten genotyp rozprzestrzenił się wykładniczo od wczesnych lat pięćdziesiątych do lat siedemdziesiątych w Ameryce Południowej. Szybkość podstawienie oszacowano jako 1,07 x 10 -3 podstawienia na miejscu rocznie. Inne badanie wykazało, ogólny współczynnik ewolucji 3,18 x 10 x 10 -3 podstawień na miejscu rocznie. Szybkość mutacja zmienia się położenie: region hiperzmienny rozwinęła szybciej (4,55 x 10 x 10 -3 podstawienia na miejscu rocznie) od regionu kodującego antygen wirusa zapalenia wątroby typu delta (2,60 x 10 x 10 -3 podstawienia na miejscu rocznie) i autokatalitycznego Region (1,11 x 10 x 10 -3 podstawienia na miejscu na rok). Trzecie badanie sugeruje tempo mutacji między 9.5x10 × 10 -3 do 1.2x10 × 10 -3 substytucji / miejsce / rok.
Genotypy, z wyjątkiem typu 1, wydają się być ograniczone do pewnych obszarów geograficznych: HDV-2 (wcześniej HDV-IIa) występuje w Japonii, Tajwanie i Jakucji; HDV-4 (wcześniej HDV-IIb) w Japonii i na Tajwanie; HDV-3 w regionie Amazonii; HDV-5, HDV-6, HDV-7 i HDV-8 w Afryce. Genotyp 8 został również wyizolowany z Ameryki Południowej. Ten genotyp występuje zwykle tylko w Afryce i mógł zostać zaimportowany do Ameryki Południowej podczas handlu niewolnikami.
Komórki T CD8+ specyficzne dla HDV mogą kontrolować wirusa, ale stwierdzono, że HDV mutuje, aby uniknąć wykrycia przez komórki T CD8+.
Gatunki pokrewne
Kilka innych wirusów podobnych do wirusa HDV opisano u gatunków innych niż ludzie. W przeciwieństwie do HDV, żaden z nich nie jest uzależniony od wirusa Hepadnaviridae (rodzina HBV) w replikacji. Środki te mają strukturę podobną do pręcika, antygen delta i rybozym. HDV i wszyscy tacy krewni są klasyfikowani we własnym królestwie , Ribozyviria , przez Międzynarodowy Komitet Taksonomii Wirusów .
Bibliografia
Bibliografia
- Widmo SC, wyd. (1999). Wirusowe zapalenie wątroby: diagnostyka, terapia i zapobieganie . Humana Prasa. Numer ISBN 0-89603-424-0.
- da Fonseca JC (2004). „[Piorunujące zapalenie wątroby w brazylijskiej Amazonii]” . Revista da Sociedade Brasileira de Medicina Tropical . 37. 37 Suplement 2: 93-5. doi : 10.1590/s0037-86822004000700015 . PMID 15586904 .
- Bensabath G, Soares M (2004). „[Ewolucja wiedzy o wirusowym zapaleniu wątroby w regionie Amazonii: od epidemiologii i etiologii do profilaktyki]” . Revista da Sociedade Brasileira de Medicina Tropical . 37 () Suplement 2): 14–26. doi : 10.1590/S0037-86822004000700003 . PMID 15586892 .
- Fonseca JC, Souza RA, Brazylia LM, Araújo JR, Ferreira LC (2004). „Piorunująca niewydolność wątroby u dzieci i młodzieży w północnej Brazylii” . Revista da Sociedade Brasileira de Medicina Tropical . 37 (1): 67-9. doi : 10.1590/S0037-86822004000100019 . PMID 15042190 .
Zewnętrzne linki
- Arkusz informacyjny Światowej Organizacji Zdrowia na temat wirusowego zapalenia wątroby typu D
- Raport ICTV: Deltawirus
- Strefa wirusowa : deltawirus
- „ Wirus delta zapalenia wątroby ” . Przeglądarka taksonomii NCBI . 12475.
| Klasyfikacja |
|---|
