Ludzki wirus T-limfotropowy - Human T-lymphotropic virus
| Ludzki wirus T-limfotropowy | |
|---|---|

|
|
| zdjęcie przedstawiające zarówno ludzki wirus T-limfotropowy 1, jak i HIV | |
|
Klasyfikacja naukowa |
|
| (bez rankingu): | Wirus |
| Królestwo : | Rybowiria |
| Królestwo: | Pararnavirae |
| Gromada: | Artverviricota |
| Klasa: | Revtraviricetes |
| Zamówienie: | Ortervirale |
| Rodzina: | Retroviridae |
| Podrodzina: | Orthoretrovirinae |
| Rodzaj: | Deltaretrowirus |
| Uwzględnione grupy | |
| Taksony objęte kladystycznie, ale tradycyjnie wykluczone | |
Rodzina wirusów ludzkiego wirusa T- limfotropowego , ludzkiego wirusa limfotropowego T- komórek lub ludzkiego wirusa białaczki i chłoniaka T- komórek ( HTLV ) to grupa ludzkich retrowirusów , o których wiadomo , że powodują rodzaj raka zwanego białaczką T-komórkową dorosłych /chłoniaka i choroby demielinizacyjnej zwanej mielopatią związaną z HTLV-1/tropikalnym niedowładem spastycznym ( HAM/TSP ). HTLV należą do większej grupy wirusów T- limfotropowych naczelnych ( PTLV ). Członkowie tej rodziny, którzy zarażają ludzi, nazywani są HTLV, a te, które zarażają małpy Starego Świata, nazywane są małpimi wirusami T-limfotropowymi (STLV). Do tej pory cztery typy HTLV ( HTLV-1 , HTLV-2 , HTLV-3 i HTLV-4) oraz cztery typy STLV (STLV-1, STLV-2, STLV-3 i STLV-5) zostały zidentyfikowane. Typy HTLV Wirusy HTLV-1 i HTLV-2 są pierwszymi odkrytymi retrowirusami. Obydwa należą do podrodziny retrowirusów onkowirusów i mogą przekształcać ludzkie limfocyty tak, że są samowystarczalne in vitro. Uważa się, że HTLV pochodzą z międzygatunkowej transmisji STLV. Genom HTLV-1 jest diploidalny i składa się z dwóch kopii wirusa z jednoniciowym RNA, którego genom jest kopiowany do postaci dwuniciowego DNA, które integruje się z genomem komórki gospodarza , w którym to momencie wirus jest określany jako prowirus . Blisko spokrewnionym wirusem jest wirus białaczki bydlęcej BLV . Oryginalna nazwa wirusa HIV , wywołującego AIDS , brzmiała HTLV-3.
HTLV-1
HTLV-1 jest skrótem dla ludzkiej komórki T limfotropowym typu 1 , zwany również ludzkie komórki T, białaczka typu A1, wirusów , która odgrywa rolę w różnych rodzajów chorób, łącznie z tropikalną spastycznego niedowładu kończyn dolnych , a w związku z rakiem wirusa dla białaczka (patrz białaczka/chłoniak z komórek T dorosłych ). HTLV-1 ma siedem zgłoszonych podtypów (podtypy od A do G). Ogromna większość zakażeń jest spowodowana przez kosmopolityczny podtyp A. HTLV został odkryty przez Roberta Gallo i współpracowników w 1980 roku. Uważa się, że w wyniku wirusa rozwija się nowotwór od 1 na 20 do 1 na 25 osób. Uważa się, że infekcja HTLV-1 rozprzestrzenia się tylko przez dzielące się komórki, ponieważ odwrotna transkryptaza wytwarza prowirusowy DNA z genomowego wirusowego RNA, a prowirus jest integrowany z genomem gospodarza przez wirusową integrazę po transmisji. Dlatego oznaczanie ilościowe prowirusa odzwierciedla liczbę komórek zakażonych HTLV-1. Tak więc wzrost liczby komórek zakażonych HTLV-1 przy użyciu podziału komórkowego, poprzez działanie dodatkowych genów wirusowych, zwłaszcza Tax, może zapewnić wzmocnienie zakaźności. Ekspresja podatku indukuje proliferację, hamuje apoptozę komórek zakażonych HTLV-1 i odwrotnie, wywołuje odpowiedź immunologiczną gospodarza, w tym cytotoksyczne komórki T, w celu zabicia komórek zakażonych wirusem.

HTLV-2
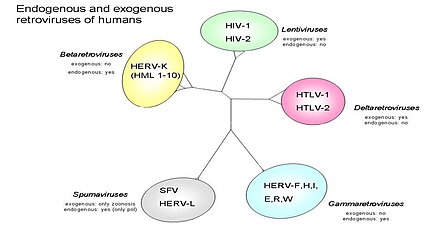
Wirus blisko spokrewniony z HTLV-1, również odkryty przez Roberta Gallo i współpracowników. Rodzinę ludzkiego wirusa T-limfotropowego (ryc. 2) można dalej podzielić na cztery podtypy. Rysunek dzieli również retrowirusy na egzogenne i endogenne. Retrowirusy mogą występować w dwóch różnych formach: endogennej, która składa się z normalnych komponentów genetycznych, oraz egzogennej, która jest przeniesionym horyzontalnie komponentem genetycznym, który jest zwykle czynnikami zakaźnymi wywołującymi chorobę, np . HIV . Na (Rysunek 3) pokazano otwarte ramki odczytu (ORF), które po translacji mogą przewidzieć, które geny będą obecne, co może pomóc w lepszym zrozumieniu ludzkich retrowirusów. Spośród czterech podtypów HTLV-2 może być powiązany z chłoniakiem skóry z komórek T (CTCL). W jednym badaniu z udziałem hodowanych limfocytów od pacjentów z mycosis fungoides (ryc. 1) amplifikacja PCR wykazała sekwencje genów HTLV-II. To odkrycie może sugerować możliwą korelację z HTLV-2 i CTCL. Aby wykazać pozytywny związek, należy przeprowadzić dalsze badania i studia.
HTLV-3 i HTLV-4
HTLV-3 i HTLV-4 zostały wykorzystane do opisania niedawno scharakteryzowanych wirusów. Wirusy te zostały odkryte w 2005 roku na terenach wiejskich Kamerunu i przypuszczalnie zostały przeniesione z małp na łowców małp poprzez ukąszenia i zadrapania.
- HTLV-3 jest podobny do STLV-3 ( małpi wirus T-limfotropowy 3 ). Zidentyfikowano wiele szczepów. Wyraża między innymi gag , pol i env .
- HTLV-4 jest najwyraźniej zasadniczo identyczny z STLV-4 u goryli.
Nie wiadomo jeszcze, na ile dalsza transmisja miała miejsce wśród ludzi ani czy wirusy mogą powodować choroby.
Użycie tych nazw może powodować pewne zamieszanie, ponieważ nazwa HTLV-3 była jedną z nazw HIV we wczesnej literaturze AIDS , ale od tego czasu wyszła z użycia. Nazwa HTLV-4 została również użyta do opisania HIV-2 . Duże kanadyjskie badanie udokumentowało to zamieszanie wśród pracowników służby zdrowia, gdzie >90% testów HTLV zleconych przez lekarzy w rzeczywistości miało być testami na HIV.

Przenoszenie
HTLV-1 i HTLV-2 mogą być przenoszone drogą płciową , przez kontakt krwi z krwią (np. przez transfuzję krwi lub używanie wspólnych igieł podczas zażywania narkotyków) oraz poprzez karmienie piersią .
Epidemiologia
Dwie wartości HTLV są dobrze ugruntowane. HTLV-1 i HTLV-2 biorą udział w aktywnym rozprzestrzenianiu epidemii, dotykając 15–20 milionów ludzi na całym świecie.
HTLV-1 ma większe znaczenie kliniczne z tych dwóch: co najmniej 500 000 osób zakażonych HTLV-1 w końcu rozwinie często szybko śmiertelną białaczkę , podczas gdy u innych rozwinie się wyniszczająca mielopatia , a jeszcze u innych wystąpi zapalenie błony naczyniowej oka , zakaźne zapalenie skóry lub inne zaburzenie zapalne. HTLV-2 wiąże się z łagodniejszymi zaburzeniami neurologicznymi i przewlekłymi infekcjami płuc . W Stanach Zjednoczonych wskaźniki seroprewalencji HTLV-1/2 wśród dawców krwi ochotników wynoszą średnio 0,016%.
Żadne konkretne choroby nie zostały dotychczas powiązane z HTLV-3 i HTLV-4 .
Szczepienia i zabiegi
Chociaż nie ma obecnie licencjonowanej szczepionki, istnieje wiele czynników, które umożliwiają wykonanie szczepionki przeciwko HTLV-1. Wirus wykazuje stosunkowo niską zmienność antygenową, naturalna odporność występuje u ludzi, a eksperymentalne szczepienie z użyciem antygenów otoczkowych okazało się skuteczne w modelach zwierzęcych. Szczepionki plazmidowego DNA wywołują silne i ochronne odpowiedzi immunologiczne w licznych modelach chorób zakaźnych na małych zwierzętach. Jednak ich immunogenność u naczelnych wydaje się słabsza. W ciągu ostatnich dwóch dekad podjęto dużą inicjatywę mającą na celu zrozumienie biologicznych i patogennych właściwości ludzkiego wirusa limfotropowego komórek T typu 1 (HTLV-1); ostatecznie doprowadziło to do opracowania różnych eksperymentalnych strategii szczepień i terapeutycznych w celu zwalczania infekcji HTLV-1. Strategie te obejmują rozwój epitopów komórek B pochodzących z glikoproteiny otoczki do indukcji przeciwciał neutralizujących, jak również strategię generowania odpowiedzi wielowartościowych cytotoksycznych limfocytów T (CTL) przeciwko antygenowi HTLV-1 Tax. Kandydat na szczepionkę, który może wywołać lub wzmocnić odpowiedź przeciwciał neutralizujących anty-gp46, może mieć potencjał zapobiegania i leczenia infekcji HTLV-1.
Potencjalne terapie obejmują prosultiaminę , pochodną witaminy B-1, która, jak wykazano, zmniejsza miano wirusa i objawy; azacytydyna , antymetabolit, któremu przypisuje się wyleczenie pacjenta w Grecji; dizoproksyl tenofowiru (TDF), inhibitor odwrotnej transkryptazy stosowany w przypadku HIV; cefarantyna , alkaloid ze stephania cepharantha hayata; i fosfonowane karbocykliczne 2'-oksa-3'azanukleozydy (PCOAN). Nowsza formuła TDF, zwana alafenamidem tenofowiru (TAF), również jest obiecująca jako leczenie o mniejszej toksyczności.
Bibliografia
Zewnętrzne linki
- ludzki wirus limfotroficzny komórek T w eMedicine
- Międzynarodowe Stowarzyszenie Retrowirusologiczne
- Ludzki + T-limfotropowy + wirus + 1 w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- Ludzki + T-limfotropowy + wirus + 2 w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- „ Ludzki wirus T-limfotropowy 1 ” . Przeglądarka taksonomii NCBI . 11908.
- „ Ludzki wirus T-limfotropowy 2 ” . Przeglądarka taksonomii NCBI . 11909.
- „ Ludzki wirus T-limfotropowy 3 ” . Przeglądarka taksonomii NCBI . 28332.
- „ Ludzki wirus T-limfotropowy 4 ” . Przeglądarka taksonomii NCBI . 318279.
- „ Nieopisany ludzki wirus T-limfotropowy ” . Przeglądarka taksonomii NCBI . 318275.