Zapłodnienie in vitro - In vitro fertilisation
| Zapłodnienie in vitro | |
|---|---|
 Ilustrowany schemat zapłodnienia in vitro z
wstrzyknięciem pojedynczego nasienia ( ICSI ) | |
| Inne nazwy | zapłodnienie in vitro |
| ICD-10-SZT | 8E0ZXY1 |
| Siatka | D005307 |
Zapłodnienie in vitro ( IVF ) to proces zapłodnienia, w którym komórka jajowa jest połączona z plemnikiem in vitro („w szkle”). Proces ten obejmuje monitorowanie i stymulację procesu owulacyjnego kobiety , usunięcie komórki jajowej lub jajeczka (jaja lub jajeczek) z jej jajników i umożliwienie zapłodnienia ich plemnikom w pożywce hodowlanej w laboratorium. Zapłodniona komórka jajowa ( zygota ) po hodowli zarodka przez 2–6 dni zostaje wszczepiona do macicy kobiety lub innej kobiety w celu pomyślnego zajścia w ciążę .
IVF to rodzaj technologii wspomaganego rozrodu stosowanej w leczeniu niepłodności i macierzyństwa zastępczego . Zapłodnione jajeczko może zostać wszczepione do macicy surogatki, a powstałe w ten sposób dziecko nie jest genetycznie spokrewnione z surogatką. Niektóre kraje zakazały lub w inny sposób regulują dostępność leczenia zapłodnienia in vitro, co prowadzi do turystyki płodności . Ograniczenia dotyczące dostępności IVF obejmują koszty i wiek, aby dana osoba mogła nosić zdrową ciążę do terminu.
W lipcu 1978 r. Louise Brown była pierwszym dzieckiem, które pomyślnie urodziło się po tym, jak jej matka otrzymała leczenie in vitro. Brown urodził się w wyniku naturalnego cyklu zapłodnienia in vitro, w którym nie wykonano żadnej stymulacji. Procedura miała miejsce w szpitalu Dr Kershaw's Cottage Hospital (obecnie Hospicjum Dr Kershaw's) w Royton , Oldham, Anglia. Robert G. Edwards otrzymał Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 2010 roku. Fizjolog opracował terapię wspólnie z Patrickiem Steptoe i embriologiem Jean Purdy, ale dwaj ostatni nie kwalifikowali się do rozpatrzenia, ponieważ zmarli, a nagroda Nobla nie została przyznana. przyznany pośmiertnie.
W przypadku dawstwa komórek jajowych i zapłodnienia in vitro kobiety, które przekroczyły wiek rozrodczy, mają niepłodnych partnerów, mają idiopatyczne problemy z płodnością kobiet lub osiągnęły menopauzę, mogą nadal zajść w ciążę. Po zabiegu IVF niektóre pary zachodzą w ciążę bez leczenia bezpłodności. W 2018 roku oszacowano, że na świecie przy użyciu zapłodnienia in vitro i innych technik wspomaganego rozrodu urodziło się osiem milionów dzieci. Jednak ostatnie badanie, które analizuje 10 dodatków do IVF (przesiewowa histeroskopia, DHEA, testosteron, GH, aspiryna, heparyna, przeciwutleniacze u mężczyzn i kobiet, osocze nasienia i PRP) sugeruje, że dopóki nie zostanie zebranych więcej dowodów na to, że te dodatki są bezpieczne i skuteczne, należy ich unikać.
Terminologia
Łaciński termin in vitro oznacza „w szkle”, ponieważ wczesne eksperymenty biologiczne z hodowlą tkanek poza żywym organizmem przeprowadzano w szklanych pojemnikach, takich jak zlewki, probówki lub szalki Petriego. Obecnie termin naukowy „in vitro” jest używany w odniesieniu do jakiejkolwiek procedury biologicznej, która jest wykonywana poza organizmem, w której normalnie by to nastąpiło, w celu odróżnienia jej od procedury in vivo (takiej jak zapłodnienie in vivo ), w której tkanka pozostaje wewnątrz żywego organizmu, w którym normalnie się znajduje.
Potoczne określenie niemowląt poczętych w wyniku zapłodnienia in vitro, „dzieci z probówki”, odnosi się do pojemników w kształcie rurek ze szkła lub plastikowej żywicy, zwanych probówkami , które są powszechnie używane w laboratoriach chemicznych i biologicznych. Jednak IVF jest zwykle wykonywany na szalkach Petriego , które są zarówno szersze, jak i płytsze i często używane do hodowli kultur.
W szerszym znaczeniu IVF jest formą technologii wspomaganego rozrodu (ART).
Zastosowania medyczne
Wskazania
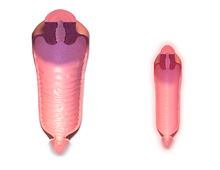
IVF może być stosowany w celu przezwyciężenia niepłodności kobiet, gdy jest ona spowodowana problemami z jajowodami , co utrudnia zapłodnienie in vivo. Może również pomóc w niepłodności męskiej , w przypadkach, gdy występuje defekt w jakości nasienia ; w takich sytuacjach można zastosować wstrzyknięcie do cytoplazmy plemnika (ICSI), w którym plemnik jest wstrzykiwany bezpośrednio do komórki jajowej. Jest to używane, gdy plemniki mają trudności z penetracją komórki jajowej. W takich przypadkach można użyć nasienia partnera lub dawcy. ICSI stosuje się również, gdy liczba plemników jest bardzo niska. Tam, gdzie jest to wskazane, stwierdzono, że zastosowanie ICSI zwiększa wskaźniki powodzenia IVF.
Zgodnie z wytycznymi NICE w Wielkiej Brytanii , leczenie IVF jest odpowiednie w przypadkach niewyjaśnionej niepłodności dla osób, które nie zaszły w ciążę po 2 latach regularnych stosunków seksualnych bez zabezpieczenia.
U osób z brakiem jajeczkowania może stanowić alternatywę po 7–12 próbach wywołania owulacji , ponieważ ta ostatnia jest droga i łatwiejsza do kontrolowania.
Wskaźniki sukcesu
Wskaźniki powodzenia IVF to odsetek wszystkich procedur IVF, które dają pozytywny wynik. W zależności od rodzaju zastosowanego obliczenia wynik ten może reprezentować liczbę potwierdzonych ciąż, zwaną wskaźnikiem ciąż , lub liczbę żywych urodzeń, zwaną wskaźnikiem żywych urodzeń . Wskaźnik sukcesu zależy od zmiennych czynników, takich jak wiek matki, przyczyna niepłodności, stan zarodka, historia rozrodu i czynniki związane ze stylem życia.
Wiek matki: Młodsze kandydatki do zapłodnienia in vitro są bardziej narażone na zajście w ciążę. Kobiety w wieku powyżej 41 lat częściej zachodzą w ciążę z komórką jajową dawcy.
Historia reprodukcyjna: osoby, które były wcześniej w ciąży, w wielu przypadkach odnoszą większe sukcesy w leczeniu IVF niż osoby, które nigdy nie były w ciąży.
Ze względu na postęp w technologii rozrodu, wskaźnik żywych urodzeń w cyklu piątym IVF wzrósł z 76% w 2005 r. do 80% w 2010 r., pomimo zmniejszenia liczby przenoszonych embrionów (co zmniejszyło wskaźnik urodzeń mnogich z 25% do 8% ).
Wskaźnik urodzeń na żywo
Wskaźnik żywych urodzeń to odsetek wszystkich cykli IVF, które prowadzą do żywych urodzeń. Ta stawka nie obejmuje poronienia lub urodzenia martwego dziecka ; porody wielorzędowe, takie jak bliźnięta i trojaczki, są liczone jako jedna ciąża. W podsumowaniu z 2017 r. opracowanym przez Society for Assisted Reproductive Technology (SART), które podaje średnie wskaźniki powodzenia zapłodnienia in vitro w Stanach Zjednoczonych na grupę wiekową przy użyciu komórek jajowych innych niż dawcy, zebrano następujące dane:
| < 35 | 35–37 | 38-40 | 41–42 | > 42 | |
|---|---|---|---|---|---|
| Wskaźnik ciąż (%) | 47,1 | 40,6 | 30,9 | 18,8 | 7,6 |
| Wskaźnik żywych urodzeń (%) | 40,5 | 30,2 | 18,7 | 9,1 | 2,9 |
W 2006 roku kanadyjskie kliniki odnotowały wskaźnik żywych urodzeń na poziomie 27%. Wskaźniki urodzeń u młodszych pacjentów były nieco wyższe, ze wskaźnikiem sukcesu wynoszącym 35,3% dla tych 21 lat i młodszych, najmłodszej ocenianej grupy. Wskaźniki powodzenia starszych pacjentów były również niższe i zmniejszały się wraz z wiekiem, przy czym 37-latki wynosiły 27,4%, a najstarsza oceniana grupa nie miała żywych urodzeń u osób w wieku powyżej 48 lat. Niektóre kliniki przekroczyły te wskaźniki, ale nie można określić, czy wynika to z lepszej techniki, czy z doboru pacjentów, ponieważ możliwe jest sztuczne zwiększenie wskaźników powodzenia, odmawiając przyjęcia najtrudniejszych pacjentów lub kierując ich w cykle dawstwa oocytów (co są opracowywane osobno). Co więcej, wskaźniki ciąż można zwiększyć, umieszczając kilka zarodków z ryzykiem zwiększenia szansy na wielokrotność.
Wskaźniki żywych urodzeń przy użyciu jaj dawczyni są również podawane przez SART i obejmują wszystkie grupy wiekowe przy użyciu jaj świeżych lub rozmrożonych:
| Świeże zarodki jaj dawczyni | Rozmrożone zarodki jaj dawcy | |
|---|---|---|
| Wskaźnik żywych urodzeń (%) | 40,3 | 36,3 |
Ponieważ nie każdy rozpoczęty cykl IVF prowadzi do pobrania oocytów lub transferu zarodków, raporty o wskaźnikach żywych urodzeń muszą określać mianownik, a mianowicie rozpoczęte cykle IVF, pobranie IVF lub transfer zarodków. SART podsumował wskaźniki powodzenia w latach 2008–2009 w amerykańskich klinikach dla cykli świeżych embrionów, które nie obejmowały komórek jajowych dawców i dawały żywe wskaźniki urodzeń według wieku przyszłej matki, ze szczytem wynoszącym 41,3% na rozpoczęty cykl i 47,3% na transfer zarodka dla pacjenci w wieku poniżej 35 lat.
Próby zapłodnienia in vitro w wielu cyklach skutkują zwiększonym skumulowanym wskaźnikiem żywych urodzeń. W zależności od grupy demograficznej, jedno badanie wykazało 45% do 53% dla trzech prób i 51% do 71% do 80% dla sześciu prób.
Od 15 lutego 2021 r. większość australijskich klinik IVF publikuje swój indywidualny wskaźnik sukcesu online za pośrednictwem YourIVFSuccess.com.au. Ta strona zawiera również narzędzie do przewidywania.
Wskaźnik ciąż
Wskaźnik ciąż można definiować na różne sposoby. W Stanach Zjednoczonych wskaźnik ciąż stosowany przez SART i Centers for Disease Control (i znajdujący się w tabeli w sekcji Wskaźniki sukcesu powyżej) opiera się na ruchu serca płodu obserwowanym w badaniach ultrasonograficznych.
Podsumowanie 2017 opracowane przez SART następujące dane dla Stanów Zjednoczonych:
| <35 | 35-37 | 38-40 | 41-42 | >42 | |
|---|---|---|---|---|---|
| Wskaźnik ciąż (%) | 47,1 | 40,6 | 30,9 | 18,8 | 7,6 |
W 2006 roku kanadyjskie kliniki odnotowały średni wskaźnik ciąż 35%. Francuskie badanie oszacowało, że 66% pacjentów rozpoczynających leczenie in vitro w końcu udaje się mieć dziecko (40% podczas leczenia in vitro w ośrodku i 26% po zaprzestaniu in vitro). Uzyskanie dziecka po zaprzestaniu zapłodnienia in vitro wynikało głównie z adopcji (46%) lub samoistnej ciąży (42%).
Wskaźnik poronień
Według badań przeprowadzonych przez Mayo Clinic wskaźniki poronień w przypadku zapłodnienia in vitro wynoszą od 15 do 25%.
Predyktory sukcesu
Sugeruje się, że głównymi potencjalnymi czynnikami wpływającymi na wskaźnik ciąż (i żywych urodzeń) w IVF są wiek matki , czas trwania niepłodności lub niepłodności, bFSH i liczba oocytów, wszystkie odzwierciedlające czynność jajników . Optymalny wiek kobiety to 23-39 lat w momencie leczenia.

Biomarkery, które wpływają na szanse ciąży IVF obejmują:
- Liczba pęcherzyków antralnych , przy czym wyższa liczba daje wyższe wskaźniki powodzenia.
- Poziomy hormonu anty-Müllerowskiego , z wyższymi poziomami wskazującymi na większe szanse na ciążę, a także na poród żywy po zapłodnieniu in vitro, nawet po dostosowaniu do wieku.
- Czynniki jakości nasienia dla dostawcy nasienia.
- Poziom fragmentacji DNA mierzony np. testem Comet , zaawansowany wiek matki i jakość nasienia .
- Osoby z genotypami FMR1 specyficznymi dla jajników, w tym het-norm/low , znacznie zmniejszyły szanse na zajście w ciążę w IVF.
- Podwyższenie progesteronu w dniu indukcji ostatecznego dojrzewania wiąże się z niższymi wskaźnikami ciąż w cyklach IVF u osób poddawanych stymulacji jajników analogami GnRH i gonadotropinami. W tym czasie, w porównaniu z poziomem progesteronu poniżej 0,8 ng/ml, poziom między 0,8 a 1,1 ng/ml nadaje iloraz szans na ciążę około 0,8, a poziom między 1,2 a 3,0 ng/ml nadaje iloraz szans na ciążę od 0,6 do 0,7. Z drugiej strony, podwyższenie poziomu progesteronu nie wydaje się zmniejszać szansy na zajście w ciążę w cyklach mrożonych i rozmrożonych oraz cyklach z dawstwem komórek jajowych.
- Charakterystyka komórek z wzgórka jajnikowego i błony ziarnistej , które są łatwo aspirowane podczas pobierania oocytów . Komórki te są ściśle związane z oocytem i dzielą to samo mikrośrodowisko, a tempo ekspresji niektórych genów w takich komórkach jest związane z wyższym lub niższym wskaźnikiem ciąż.
- Grubość endometrium (EMT) mniejsza niż 7 mm zmniejsza wskaźnik ciąż o iloraz szans około 0,4 w porównaniu z EMT powyżej 7 mm. Jednak tak mała grubość występuje rzadko, a rutynowe stosowanie tego parametru uważa się za nieuzasadnione.
Inne determinanty wyniku IVF obejmują:
- Wraz ze wzrostem wieku matki maleje prawdopodobieństwo poczęcia i wzrasta prawdopodobieństwo poronienia.
- Wraz ze wzrostem wieku ojca, zwłaszcza 50 lat i starszych, tempo tworzenia blastocyst spada.
- Palenie tytoniu zmniejsza szanse zapłodnienia in vitro na urodzenie żywego dziecka o 34% i zwiększa ryzyko poronienia ciąży w wyniku zapłodnienia in vitro o 30%.
- Wskaźnik masy ciała (BMI) powyżej 27 powoduje zmniejszenie o 33% prawdopodobieństwa mieć żywych urodzeń po pierwszym cyklu IVF, w porównaniu do tych z BMI pomiędzy 20 i 27. Ponadto, kobiety w ciąży, które są otyłe mają wyższe stawki poronienia , cukrzyca ciążowa , nadciśnienie , choroba zakrzepowo - zatorowa i problemy podczas porodu , a także prowadzące do zwiększonego ryzyka wad wrodzonych płodu . Idealny wskaźnik masy ciała to 19-30.
- Salpingektomia lub laparoskopowa niedrożność jajowodów przed zabiegiem IVF zwiększa szanse osób z hydrosalpingiem .
- Sukces z poprzednią ciążą i/lub żywym porodem zwiększa szanse
- Niskie spożycie alkoholu/kofeiny zwiększa wskaźnik sukcesu
- Liczba zarodków przeniesionych w cyklu leczenia
- Jakość zarodka
- Niektóre badania sugerują również, że choroba autoimmunologiczna może również odgrywać rolę w zmniejszaniu wskaźników powodzenia IVF poprzez zakłócanie prawidłowej implantacji zarodka po transferze.
Aspiryna jest czasami przepisywana ludziom w celu zwiększenia szans na zapłodnienie in vitro, ale od 2016 roku nie ma dowodów na to, że jest bezpieczna i skuteczna.
2013 ocena i meta analiza z randomizacją w akupunkturze jako adiuwant leczenia IVF nie znalazł ogólne korzyści, i stwierdzono, że wykryto widocznych korzyści w podgrupie opublikowanych badaniach, w których w grupie kontrolnej (te, które nie za pomocą akupunktura) stwierdzono niższą niż średni wskaźnik ciąż wymaga dalszych badań, ze względu na możliwość błędu publikacji i inne czynniki.
W przeglądzie Cochrane stwierdzono, że uszkodzenie endometrium wykonane w miesiącu poprzedzającym indukcję jajników wydaje się zwiększać zarówno wskaźnik żywych urodzeń, jak i odsetek ciąż klinicznych w IVF w porównaniu z brakiem uszkodzenia endometrium. Nie było dowodów na różnicę między grupami pod względem poronień, ciąż mnogich lub częstości krwawień. Dowody sugerują, że uszkodzenie endometrium w dniu pobrania oocytu było związane z niższym wskaźnikiem żywych urodzeń lub trwającej ciąży.
U ludzi przyjmowanie przeciwutleniaczy (takich jak N-acetylocysteina , melatonina , witamina A , witamina C , witamina E , kwas foliowy , mio-inozytol , cynk lub selen ) nie wiązało się ze znacznym wzrostem żywych urodzeń ani wskaźnik ciąż w IVF według przeglądów Cochrane . Przegląd wykazał, że doustne przeciwutleniacze podawane mężczyznom w parach z czynnikiem męskim lub niewyjaśnioną niepłodnością mogą poprawić wskaźniki żywych urodzeń, ale potrzeba więcej dowodów.
Przegląd Cochrane z 2015 r. doszedł do wniosku, że nie zidentyfikowano dowodów dotyczących wpływu porad dotyczących stylu życia sprzed poczęcia na prawdopodobieństwo urodzenia żywego dziecka.
Komplikacje
Poród mnogi
Głównym powikłaniem IVF jest ryzyko porodów mnogich . Jest to bezpośrednio związane z praktyką przenoszenia wielu zarodków podczas transferu zarodków. Porody mnogie wiążą się ze zwiększonym ryzykiem utraty ciąży, powikłań położniczych , wcześniactwa i zachorowalności noworodka z możliwością długotrwałego uszkodzenia. W niektórych krajach (np. w Wielkiej Brytanii, Belgii) wprowadzono ścisłe ograniczenia dotyczące liczby embrionów, które mogą zostać przeniesione, aby zmniejszyć ryzyko wystąpienia wielokrotności wysokiego rzędu (trojaczki lub więcej), ale nie są one powszechnie przestrzegane ani akceptowane. Po transferze może wystąpić spontaniczne rozszczepienie zarodków w macicy, ale jest to rzadkie i prowadziłoby do bliźniąt jednojajowych. Randomizowane badanie z podwójnie ślepą próbą obserwowało ciąże IVF, w których poczęły się 73 niemowlęta (33 chłopców i 40 dziewczynek) i wykazały, że 8,7% niemowląt pojedynczych i 54,2% bliźniąt miało masę urodzeniową poniżej 2500 gramów (5,5 funta). Istnieją pewne dowody na to, że wykonanie podwójnego transferu zarodków podczas jednego cyklu zapewnia wyższy wskaźnik żywych urodzeń niż transfer pojedynczego zarodka; ale wykonanie dwóch pojedynczych transferów zarodków w dwóch cyklach ma taki sam wskaźnik żywych urodzeń i pozwoli uniknąć ciąż mnogich.
Zniekształcenia proporcji płci
Wykazano, że niektóre rodzaje IVF, w szczególności ICSI (po raz pierwszy zastosowane w 1991 r.) i transfer blastocysty (po raz pierwszy zastosowane w 1984 r.), prowadzą do zniekształcenia proporcji płci przy urodzeniu. ICSI prowadzi do nieco większej liczby urodzeń kobiet (51,3% kobiet), podczas gdy transfer blastocysty prowadzi do narodzin znacznie większej liczby chłopców (56,1% mężczyzn). Standardowe zapłodnienie in vitro wykonane drugiego lub trzeciego dnia prowadzi do normalnego stosunku płci.
Modyfikacje epigenetyczne spowodowane przez przedłużoną hodowlę prowadzącą do śmierci większej liczby żeńskich zarodków są uważane za powód, dla którego transfer blastocysty prowadzi do wyższego stosunku płci męskiej, jednak dodanie kwasu retinowego do hodowli może przywrócić ten stosunek do normy.
Rozprzestrzenianie się choroby zakaźnej
Poprzez płukanie nasienia ryzyko, że przewlekła choroba u samca, w przypadku którego nasienie zakaże samicę lub potomstwo, może być znikome.
W przypadku mężczyzn z wirusowym zapaleniem wątroby typu B Komitet Praktyki Amerykańskiego Towarzystwa Medycyny Rozrodu zaleca, aby płukanie nasienia nie było konieczne w przypadku zapłodnienia in vitro, aby zapobiec transmisji, chyba że partnerka nie została skutecznie zaszczepiona. U kobiet z wirusowym zapaleniem wątroby typu B ryzyko transmisji wertykalnej podczas zapłodnienia in vitro nie różni się od ryzyka przy samoistnym zapłodnieniu. Jednak nie ma wystarczających dowodów na to, że procedury ICSI są bezpieczne u samic z wirusowym zapaleniem wątroby typu B w odniesieniu do wertykalnego przeniesienia na potomstwo.
W związku z potencjalnym rozprzestrzenianiem się HIV/AIDS , rząd Japonii zabronił stosowania procedur zapłodnienia in vitro w przypadku par, w których oboje partnerzy są zakażeni wirusem HIV. Pomimo faktu, że komisje etyki wcześniej zezwoliły szpitalowi Ogikubo, tokijskiemu w Tokio, na stosowanie zapłodnienia in vitro dla par z HIV, japońskie Ministerstwo Zdrowia, Pracy i Opieki Społecznej zdecydowało o zablokowaniu tej praktyki. Hideji Hanabusa, wiceprezes Szpitala Ogikubo, twierdzi, że wraz z kolegami udało mu się opracować metodę, dzięki której naukowcy są w stanie usunąć HIV z plemników.
Inne zagrożenia dla dostawcy/dostawcy jaj
Ryzyko stymulacji jajników to rozwój zespołu hiperstymulacji jajników , szczególnie jeśli hCG jest stosowane do indukowania ostatecznego dojrzewania oocytów . Powoduje to obrzęk, bolesność jajników. Występuje u 30% pacjentów. Łagodne przypadki można leczyć lekami dostępnymi bez recepty, a przypadki można rozwiązać w przypadku braku ciąży. W umiarkowanych przypadkach jajniki puchną, a płyn gromadzi się w jamach brzusznych i może mieć objawy zgagi, gazów, nudności lub utraty apetytu. W ciężkich przypadkach pacjenci odczuwają nagły, nadmierny ból brzucha, nudności, wymioty i będą skutkować hospitalizacją.
Podczas pobierania komórek jajowych istnieje niewielkie ryzyko krwawienia, infekcji i uszkodzenia otaczających struktur, takich jak jelita i pęcherz (przezpochwowa aspiracja USG), a także trudności w oddychaniu, infekcja klatki piersiowej, reakcje alergiczne na leki lub uszkodzenie nerwów (laparoskopia). .
Ciąża pozamaciczna może również wystąpić, jeśli zapłodniona komórka jajowa rozwija się poza macicą, zwykle w jajowodach i wymaga natychmiastowego zniszczenia płodu.
IVF nie wydają się być związane ze zwiększonym ryzykiem raka szyjki macicy , ani na raka jajnika lub raka macicy , gdy zobojętnienie confounder z samego niepłodności. Nie wydaje się też dawać żadnego zwiększonego ryzyka raka piersi .
Niezależnie od wyniku ciąży, leczenie IVF jest zwykle stresujące dla pacjentek. Neurotyczność i stosowanie eskapistycznych strategii radzenia sobie wiąże się z wyższym stopniem dystresu, a obecność wsparcia społecznego działa łagodząco. Negatywny wynik testu ciążowego po zapłodnieniu in vitro wiąże się ze zwiększonym ryzykiem wystąpienia depresji u kobiet, ale nie ze zwiększonym ryzykiem rozwoju zaburzeń lękowych . Wyniki testów ciążowych nie wydają się być czynnikiem ryzyka depresji lub lęku u mężczyzn.
Badania pokazują, że istnieje zwiększone ryzyko zakrzepicy żylnej lub zatorowości płucnej w pierwszym trymestrze IVF. Patrząc na długoterminowe badania porównujące osoby, które otrzymały lub nie otrzymały IVF, wydaje się, że nie ma korelacji ze zwiększonym ryzykiem zdarzeń sercowych. Trwają dalsze badania, aby to utrwalić.
Ciąża samoistna wystąpiła po udanych i nieudanych zabiegach zapłodnienia in vitro. W ciągu 2 lat po urodzeniu dziecka poczętego za pomocą zapłodnienia in vitro, pary z niepłodnością miały wskaźnik poczęć 18%.
Wady wrodzone
W przeglądzie z 2013 r. stwierdzono, że u niemowląt po zapłodnieniu in vitro (z lub bez ICSI) względne ryzyko wad wrodzonych wynosi 1,32 (95% przedział ufności 1,24–1,42) w porównaniu z niemowlętami poczętymi w sposób naturalny. W 2008 r. analiza danych National Birth Defects Study w USA wykazała, że niektóre wady wrodzone były znacznie częstsze u niemowląt poczętych metodą IVF, w szczególności wady przegrody serca , rozszczep wargi z lub bez rozszczepu podniebienia , atrezja przełyku i odbytu. atrezja ; mechanizm przyczynowości jest niejasny. Jednak w ogólnopopulacyjnym badaniu kohortowym obejmującym 308 974 urodzeń (6163 przy użyciu technologii wspomaganego rozrodu i śledzących dzieci od urodzenia do piątego roku życia) naukowcy stwierdzili: „Zwiększone ryzyko wad wrodzonych związanych z IVF nie było już znaczące po uwzględnieniu czynników rodzicielskich ”. Czynniki rodzicielskie obejmowały znane niezależne ryzyko wad wrodzonych, takie jak wiek matki, palenie tytoniu itp. Korekta wieloczynnikowa nie usunęła znaczenia związku wad wrodzonych i ICSI (skorygowany iloraz szans 1,57), chociaż autorzy spekulują, że leżące u podstaw męskie czynniki niepłodności (co byłoby związane z wykorzystaniem ICSI) może przyczynić się do tej obserwacji i nie byli w stanie skorygować tych czynników zakłócających. Autorzy stwierdzili również, że sama historia niepłodności zwiększała ryzyko przy braku jakiegokolwiek leczenia (iloraz szans 1,29), co jest zgodne z badaniem duńskiego krajowego rejestru i „włącza czynniki pacjenta w to zwiększone ryzyko”. Autorzy duńskiego badania krajowego rejestru spekulują: „Nasze wyniki sugerują, że zgłoszona zwiększona częstość występowania wad wrodzonych u samotnych urodzonych po zastosowaniu technologii wspomaganego rozrodu jest częściowo spowodowana niepłodnością lub jej czynnikami determinującymi”.
| Stan: schorzenie | Ryzyko względne |
95% przedział ufności |
|---|---|---|
| Zespół Beckwitha-Wiedemanna | 3-4 | |
| wady wrodzone | 1,67 | 1,33–2,09 |
| krwotok przedporodowy | 2,49 | 2,30–2,69 |
| nadciśnieniowe zaburzenia ciąży | 1,49 | 1,39–1,59 |
| przedwczesne pęknięcie błon | 1,16 | 1,07–1,26 |
| cesarskie cięcie | 1,56 | 1,51–1,60 |
| cukrzyca ciężarnych | 1,48 | 1,33–1,66 |
| indukcja porodu | 1,18 | 1,10–1,28 |
| mały jak na wiek ciążowy | 1,39 | 1,27–1,53 |
| przedwczesny poród | 1,54 | 1,47–1,62 |
| niska waga po urodzeniu | 1,65 | 1,56–1,75 |
| śmiertelność okołoporodowa | 1,87 | 1,48–2,37 |
Inne zagrożenia dla potomstwa
Jeśli podstawowa niepłodność jest związana z nieprawidłowościami w spermatogenezie , jest to prawdopodobne, ale zbyt wcześnie, aby zbadać, czy potomstwo płci męskiej jest bardziej narażone na nieprawidłowości nasienia.
Wydaje się, że zapłodnienie in vitro nie wiąże się z żadnym ryzykiem dotyczącym rozwoju poznawczego, wyników w szkole, funkcjonowania społecznego i zachowania. Wiadomo również, że niemowlęta z zapłodnieniami in vitro są tak samo bezpiecznie przywiązane do rodziców, jak te, które zostały poczęte w sposób naturalny, a nastolatki z zapłodnienia in vitro są tak samo dobrze przystosowane, jak te, które zostały poczęte w sposób naturalny.
Ograniczone dane z długoterminowej obserwacji sugerują , że zapłodnienie in vitro może wiązać się ze zwiększoną częstością występowania nadciśnienia tętniczego , upośledzeniem glikemii na czczo , zwiększeniem całkowitego składu tkanki tłuszczowej , postępem wieku kostnego , subklinicznymi zaburzeniami czynności tarczycy , depresją kliniczną we wczesnej dorosłości i upijaniem się potomstwo. Nie wiadomo jednak, czy te potencjalne powiązania są spowodowane samą procedurą IVF, niekorzystnymi wynikami położniczymi związanymi z IVF, genetycznym pochodzeniem dzieci lub jeszcze nieznanymi przyczynami związanymi z IVF. Wzrost manipulacji zarodkami podczas zapłodnienia in vitro powoduje bardziej odchylone krzywe wzrostu płodu, ale masa urodzeniowa nie wydaje się być wiarygodnym wskaźnikiem stresu płodu.
IVF, w tym ICSI , wiąże się ze zwiększonym ryzykiem zaburzeń imprintingu (w tym zespołu Pradera-Williego i zespołu Angelmana ), przy ilorazie szans wynoszącym 3,7 (95% przedział ufności 1,4 do 9,7).
Uważa się, że częstość występowania porażenia mózgowego i opóźnienia neurorozwojowego związanego z zapłodnieniem in vitro jest związana z czynnikami zakłócającymi wcześniactwo i niską masę urodzeniową. Podobnie uważa się, że częstość występowania autyzmu i zespołu deficytu uwagi w związku z zapłodnieniem in vitro jest związana z czynnikami zakłócającymi matczyne i położnicze.
Ogólnie rzecz biorąc, IVF nie powoduje zwiększonego ryzyka raka u dzieci . Badania wykazały zmniejszenie ryzyka niektórych nowotworów i zwiększone ryzyko niektórych innych, w tym siatkówczaka zarodkowego , wątrobiaka zarodkowego i mięśniakomięsaka prążkowanokomórkowego .
metoda
Teoretycznie IVF można wykonać, pobierając zawartość jajowodów lub macicy kobiety po naturalnej owulacji, mieszając ją z plemnikiem i ponownie wprowadzając zapłodnione komórki jajowe do macicy. Jednak bez dodatkowych technik szanse na zajście w ciążę byłyby niezwykle małe. Dodatkowe techniki rutynowo stosowane w IVF obejmują hiperstymulację jajników w celu wygenerowania wielu komórek jajowych, przezpochwowe pobieranie oocytów pod kontrolą USG bezpośrednio z jajników, koinkubację komórek jajowych i nasienia, a także hodowlę i selekcję powstałych zarodków przed transferem zarodka do macica.
Hiperstymulacja jajników
Hiperstymulacja jajników to stymulacja do indukowania rozwoju wielu pęcherzyków jajnikowych. Należy zacząć od przewidywania odpowiedzi na podstawie np. wieku, liczby pęcherzyków antralnych i poziomu hormonu antymüllerowskiego . Wynikające z tego przewidywanie np. słabej lub nadmiernej odpowiedzi na hiperstymulację jajników określa protokół i dawkowanie hiperstymulacji jajników.
Hiperstymulacja jajników obejmuje również tłumienie spontanicznej owulacji, dla której dostępne są dwie główne metody: przy użyciu (zwykle dłuższego) protokołu z agonistą GnRH lub (zwykle krótszego) protokołu z antagonistą GnRH . W standardowym protokole z długim agonistą GnRH dzień, w którym rozpoczyna się leczenie hiperstymulacją i oczekiwany dzień późniejszego pobrania oocytów, można wybrać zgodnie z osobistym wyborem, podczas gdy w protokole z antagonistą GnRH należy go dostosować do spontanicznego początku poprzedniej miesiączki. Z drugiej strony, protokół antagonisty GnRH ma mniejsze ryzyko wystąpienia zespołu hiperstymulacji jajników (OHSS), który jest powikłaniem zagrażającym życiu.
W przypadku samej hiperstymulacji jajników gonadotropiny do wstrzykiwania (zwykle analogi FSH ) są zwykle stosowane pod ścisłą kontrolą. Takie monitorowanie często sprawdza poziom estradiolu i za pomocą ultrasonografii ginekologicznej wzrost pęcherzyków. Zazwyczaj konieczne będzie około 10 dni wstrzyknięć.
Naturalne zapłodnienie in vitro
Istnieje kilka metod określanych jako naturalny cykl IVF :
- IVF nie wymaga stosowania leków do hiperstymulacji jajników , podczas gdy leki hamujące owulację mogą być nadal stosowane.
- IVF z wykorzystaniem hiperstymulacji jajników, w tym gonadotropin, ale z protokołem antagonistycznym GnRH , tak aby cykl rozpoczynał się od naturalnych mechanizmów.
- Transfer zamrożonych zarodków ; IVF z zastosowaniem hiperstymulacji jajników , a następnie kriokonserwacji zarodków , a następnie transferu zarodków w późniejszym, naturalnym cyklu.
IVF bez leków do hiperstymulacji jajników było metodą poczęcia Louise Brown . Ta metoda może być z powodzeniem stosowana, gdy ludzie chcą uniknąć przyjmowania leków stymulujących jajniki i związanych z tym skutków ubocznych. HFEA oszacowała wskaźnik żywych urodzeń na około 1,3% na cykl IVF bez stosowania leków hiperstymulacyjnych dla osób w wieku od 40 do 42 lat.
Łagodne IVF to metoda, w której niewielka dawka leków stymulujących jajniki jest stosowana przez krótki czas podczas naturalnego cyklu kobiety, mająca na celu wytworzenie 2–7 jajeczek i stworzenie zdrowych zarodków. Ta metoda wydaje się być postępem w dziedzinie zmniejszania powikłań i skutków ubocznych u ludzi i jest ukierunkowana na jakość, a nie ilość jaj i zarodków. Jedno badanie porównujące łagodne leczenie (łagodna stymulacja jajników antagonistą GnRH w połączeniu z transferem pojedynczego zarodka ) do standardowego leczenia (stymulacja długim protokołem agonisty GnRH i transfer dwóch zarodków) wykazało, że proporcje kumulacji ciąże, które zakończyły się terminowym porodem żywym po 1 roku, wynosiły 43,4% przy łagodnym leczeniu i 44,7% przy standardowym leczeniu. Łagodne zapłodnienie in vitro może być tańsze niż konwencjonalne zapłodnienie in vitro i ze znacznie zmniejszonym ryzykiem ciąży mnogiej i OHSS .
Indukcja dojrzewania końcowego
Gdy pęcherzyki jajnikowe osiągną pewien stopień rozwoju, następuje indukcja ostatecznego dojrzewania oocytów , zazwyczaj przez wstrzyknięcie ludzkiej gonadotropiny kosmówkowej (hCG). Powszechnie jest to znane jako „strzał spustowy”. hCG działa jak analog hormonu luteinizującego , a owulacja może wystąpić między 38 a 40 godziną po pojedynczym wstrzyknięciu HCG, ale pobranie jaja odbywa się zwykle między 34 a 36 godziną po wstrzyknięciu hCG, czyli tuż przed mieszki włosowe pękną. Pozwala to zaplanować procedurę pobierania jaj w czasie, gdy jaja są w pełni dojrzałe. Wstrzyknięcie HCG wiąże się z ryzykiem wystąpienia zespołu hiperstymulacji jajników . Zastosowanie agonisty GnRH zamiast hCG eliminuje większość ryzyka zespołu hiperstymulacji jajników, ale ze zmniejszoną szybkością porodu, jeśli zarodki są przenoszone świeże. Z tego powodu wiele ośrodków zamraża wszystkie oocyty lub zarodki po aktywacji agonisty.
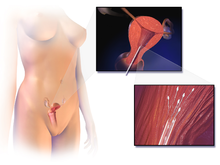
Odzyskiwanie jaj
Jaja są pobierane od pacjentki za pomocą techniki przezpochwowej zwanej przezpochwowym pobieraniem oocytów , polegającej na przekłuwaniu ściany pochwy igłą pod kontrolą USG, aby dotrzeć do jajników. Przez tę igłę można zaaspirować pęcherzyki, a płyn pęcherzykowy przekazać embriologowi w celu identyfikacji komórek jajowych. Często usuwa się od dziesięciu do trzydziestu jaj. Procedura pobierania trwa zwykle od 20 do 40 minut, w zależności od liczby dojrzałych pęcherzyków i zwykle odbywa się w świadomej sedacji lub znieczuleniu ogólnym .
Przygotowanie jaj i nasienia
W laboratorium, w przypadku zabiegów ICSI, zidentyfikowane jaja są usuwane z otaczających komórek (znanych również jako komórki wzgórka ) i przygotowywane do zapłodnienia . Selekcja oocytów może być przeprowadzone przed zapłodnienia, aby zaznaczyć, że jaja mogą być zapłodnione, jak jest to wymagane są w metafazy II. Zdarzają się przypadki, w których jeśli oocyty znajdują się w stadium I metafazy, można je hodować w taki sposób, aby przejść tylną iniekcję plemników. W międzyczasie nasienie jest przygotowywane do zapłodnienia poprzez usunięcie nieaktywnych komórek i płynu nasiennego w procesie zwanym płukaniem nasienia . Jeśli nasienie jest dostarczane przez dawcę nasienia , zazwyczaj jest ono przygotowane do leczenia przed zamrożeniem i poddaniem kwarantannie, a następnie rozmrożone i gotowe do użycia.
Koinkubacja
Plemnik i komórka jajowa inkubuje się razem w stosunku około 75 000:1 w pożywce hodowlanej , aby nastąpiło faktyczne zapłodnienie . Przegląd z 2013 r. doszedł do wniosku, że czas trwania tej koinkubacji około 1 do 4 godzin powoduje znacznie wyższy wskaźnik ciąż niż 16 do 24 godzin. W większości przypadków jajeczko zostanie zapłodnione podczas koinkubacji i będzie miało dwa przedjądra . W pewnych sytuacjach, takich jak niska liczba plemników lub ruchliwość plemników, pojedynczy plemnik może zostać wstrzyknięty bezpośrednio do komórki jajowej za pomocą docytoplazmatycznego wstrzyknięcia plemnika (ICSI). Zapłodnione jajo jest przenoszone na specjalną pożywkę wzrostową i pozostawiane na około 48 godzin, aż jajeczko składa się z sześciu do ośmiu komórek.
W transferze gamet do jajowodu komórki jajowe są usuwane z kobiety i umieszczane w jednym z jajowodów wraz z nasieniem mężczyzny. Pozwala to na zapłodnienie w ciele kobiety. Dlatego ta odmiana jest w rzeczywistości zapłodnieniem in vivo, a nie in vitro.
Kultura zarodków
Główne czasy trwania hodowli zarodków to etap rozszczepienia (dzień drugi do czwartego po wspólnej inkubacji ) lub stadium blastocysty (dzień piąty lub szósty po wspólnej inkubacji ). Hodowla zarodków do stadium blastocysty powoduje znaczny wzrost odsetka żywych urodzeń na transfer zarodków , ale także zapewnia zmniejszoną liczbę zarodków dostępnych do transferu i krioprezerwacji zarodków , więc skumulowany wskaźnik ciąż klinicznych wzrasta wraz z transferem w stadium bruzdkowania. W drugim dniu transferu zamiast w trzecim dniu po zapłodnieniu nie ma różnic w liczbie żywych urodzeń . W przypadku urodzeń z embrionów wyhodowanych do stadium blastocysty występują istotnie wyższe szanse na poród przedwczesny ( iloraz szans 1,3) i wady wrodzone ( iloraz szans 1,3) w porównaniu z fazą bruzdkowania.
Wybór zarodków
Laboratoria opracowały metody klasyfikacji do oceny jakości komórek jajowych i zarodków . W celu optymalizacji wskaźników ciąż istnieją istotne dowody na to, że morfologiczny system punktacji jest najlepszą strategią selekcji zarodków. Od 2009 roku, kiedy pierwszy system mikroskopii poklatkowej do zapłodnienia in vitro został zatwierdzony do użytku klinicznego, morfokinetyczne systemy punktacji wykazały dalszą poprawę wskaźników ciąż . Jednakże, gdy wszystkie różne typy urządzeń do obrazowania zarodków poklatkowych , z lub bez systemów oceny morfokinetycznej, porówna się z konwencjonalną oceną zarodków pod kątem IVF, nie ma wystarczających dowodów na różnicę w żywych urodzeniu, ciąży, martwym porodzie lub poronieniu, aby wybrać między im. Trwają aktywne wysiłki na rzecz opracowania dokładniejszej analizy selekcji zarodków w oparciu o sztuczną inteligencję i głębokie uczenie. Inteligentny asystent klasyfikacji zarodków (ERICA) jest tego wyraźnym przykładem. To oprogramowanie do głębokiego uczenia zastępuje klasyfikację ręczną systemem rankingowym opartym na przewidywanym statusie genetycznym danego zarodka w nieinwazyjny sposób. Badania w tym obszarze są nadal w toku, a obecne studia wykonalności potwierdzają jego potencjał.
Transfer embrionów
Przekazywany numer zależy od dostępnego numeru, wieku kobiety oraz innych czynników zdrowotnych i diagnostycznych. W krajach takich jak Kanada, Wielka Brytania, Australia i Nowa Zelandia transferowane są maksymalnie dwa zarodki, z wyjątkiem nietypowych okoliczności. W Wielkiej Brytanii i zgodnie z przepisami HFEA kobieta po 40 roku życia może mieć do trzech transferowanych embrionów, podczas gdy w USA nie ma prawnego ograniczenia liczby embrionów, które można przenieść, chociaż stowarzyszenia medyczne przedstawiły wytyczne dotyczące praktyki. Większość klinik i krajowych organów regulacyjnych stara się zminimalizować ryzyko ciąży mnogiej, ponieważ nierzadko wszczepia się wiele zarodków w przypadku przeniesienia wielu zarodków. Zarodki przenoszone są do macicy pacjentki przez cienki plastikowy cewnik , który przechodzi przez pochwę i szyjkę macicy. Kilka embrionów może zostać wprowadzonych do macicy, aby zwiększyć szanse na implantację i ciążę.
Wsparcie lutealne
Wspomaganie lutealne polega na podawaniu leków, głównie progesteronu , progestyn , hCG lub agonistów GnRH , często w towarzystwie estradiolu, w celu zwiększenia wskaźnika powodzenia implantacji i wczesnej embriogenezy , tym samym uzupełniając i/lub wspierając funkcję ciałka żółtego . Przegląd Cochrane wykazał, że hCG lub progesteron podawane w fazie lutealnej mogą być związane z wyższym odsetkiem żywych urodzeń lub trwającej ciąży, ale dowody nie są rozstrzygające. Jednoczesne leczenie agonistami GnRH wydaje się poprawiać wyniki dzięki wskaźnikowi RD żywych urodzeń o +16% (95% przedział ufności +10 do +22%). Z drugiej strony, hormon wzrostu lub aspiryna jako leki wspomagające w IVF nie dają dowodów na ogólne korzyści.
Rozszerzenia
Istnieją różne rozszerzenia lub dodatkowe techniki, które można zastosować w IVF, które zwykle nie są konieczne dla samego zabiegu IVF, ale byłyby praktycznie niemożliwe lub technicznie trudne do wykonania bez jednoczesnego wykonywania metod IVF.
Preimplantacyjne badanie przesiewowe lub diagnostyka genetyczna
Sugerowano, że preimplantacyjne badania genetyczne (PGS) lub preimplantacyjna diagnostyka genetyczna (PGD) mogą być stosowane w IVF w celu wyselekcjonowania zarodka, który wydaje się mieć największe szanse na pomyślną ciążę. Jednak systematyczny przegląd i metaanaliza istniejących randomizowanych badań kontrolowanych wykazały, że nie ma dowodów na korzystny wpływ PGS z biopsją stadium rozszczepienia, mierzony wskaźnikiem żywych urodzeń . Wręcz przeciwnie, u osób w zaawansowanym wieku matek PGS z biopsją w stadium rozszczepienia znacznie obniża wskaźnik żywych urodzeń. Wady techniczne, takie jak inwazyjność biopsji i niereprezentatywne próbki z powodu mozaikowatości, są głównymi czynnikami leżącymi u podstaw nieskuteczności PGS.
Mimo to, jako rozszerzenie IVF, pacjenci, którzy mogą odnieść korzyści z PGS/PGD, obejmują:
- Pary, które mają w rodzinie historię chorób dziedzicznych
- Pary, które chcą prenatalnego rozeznania płci . Może to być wykorzystane do diagnozowania zaburzeń monogenowych ze sprzężeniem płciowym . Potencjalnie może być stosowany do selekcji płci , w której płód jest abortowany, jeśli ma niepożądany seks.
- Pary, które mają już dziecko z nieuleczalną chorobą i potrzebują zgodnych komórek od drugiego zdrowego dziecka, aby wyleczyć pierwsze, co skutkuje „ zbawicielem rodzeństwa ”, które pasuje do chorego dziecka z typem HLA .
PGS przesiewa pod kątem liczebnych nieprawidłowości chromosomalnych, podczas gdy PGD diagnozuje specyficzny defekt molekularny dziedzicznej choroby. Zarówno w PGS, jak i PGD, podczas procesu IVF analizuje się pojedyncze komórki ze stanu przedzarodkowego lub korzystnie komórki trofektodermy z biopsji z blastocysty . Przed przeniesieniem stanu przedzarodkowego z powrotem do macicy kobiety, jedna lub dwie komórki są usuwane ze stanu przedzarodkowego (stadium 8-komórkowe) lub najlepiej z blastocysty . Komórki te są następnie oceniane pod kątem normalności. Zazwyczaj w ciągu jednego do dwóch dni po zakończeniu oceny tylko normalne zarodki są przenoszone z powrotem do macicy kobiety. Alternatywnie, blastocysta może być kriokonserwowana poprzez witryfikacja i przeniesiona w późniejszym terminie do macicy. Ponadto PGS może znacznie zmniejszyć ryzyko ciąż mnogich, ponieważ do implantacji potrzeba mniej zarodków, najlepiej tylko jednego.
Kriokonserwacja
Kriokonserwację można wykonać jako kriokonserwację oocytów przed zapłodnieniem lub jako kriokonserwację zarodków po zapłodnieniu.
Rand Consulting Group oszacowała, że w 2006 roku w Stanach Zjednoczonych było 400 000 zamrożonych embrionów. Zaletą jest to, że pacjentki, które nie zajdą w ciążę, mogą zajść w ciążę przy użyciu takich embrionów bez konieczności przechodzenia przez pełny cykl IVF. Lub, jeśli zajdzie w ciążę, mogą wrócić później na kolejną ciążę. Zapasowe oocyty lub zarodki powstałe w wyniku leczenia niepłodności można wykorzystać do dawstwa oocytów lub embrionów innej kobiecie lub parze, a embriony mogą być tworzone, zamrażane i przechowywane specjalnie do transferu i dawstwa przy użyciu komórek jajowych i nasienia dawcy. Krioprezerwację oocytów można również zastosować u osób, które mogą utracić rezerwę jajnikową z powodu poddania się chemioterapii .
Do 2017 roku wiele ośrodków przyjęło krioprezerwację zarodków jako podstawową terapię IVF i wykonuje niewiele świeżych embrionów lub nie wykonuje ich wcale. Dwa główne powody to lepsza receptywność endometrium, gdy zarodki są przenoszone w cyklach bez ekspozycji na stymulację jajników, a także możliwość przechowywania zarodków w oczekiwaniu na wyniki badań genetycznych przed implantacją.
Wynik zastosowania kriokonserwowanych embrionów był jednolicie pozytywny, bez wzrostu wad wrodzonych lub nieprawidłowości rozwojowych.
Inne dodatki
- Intracytoplasmic sperm injection (ICSI) polega na wstrzyknięciu pojedynczego plemnika bezpośrednio do komórki jajowej . Jego głównym zastosowaniem jako rozszerzenie zapłodnienia in vitro jest przezwyciężenie problemów z niepłodnością u mężczyzn, chociaż może być również stosowany tam, gdzie plemniki nie mogą łatwo przeniknąć jajeczek, a czasami w połączeniu z dawstwem nasienia . Może być stosowany w Teratozoospermia , ponieważ gdy zapłodnione jajo jest nienormalna morfologia plemników nie wydaje się wpływać blastocysty rozwój lub blastocysty morfologię.
- Dodatkowe metody profilowania zarodków . Pojawiają się na przykład metody wykonywania kompleksowych analiz nawet całych genomów , transkryptomów , proteomów i metabolomów, które można wykorzystać do oceny embrionów poprzez porównywanie wzorców z tymi, które wcześniej stwierdzono wśród embrionów w ciążach udanych i nieudanych.
- Assisted zona hatching (AZH) można przeprowadzić na krótko przed przeniesieniem zarodka do macicy. W zewnętrznej warstwie otaczającej jajo robi się mały otwór, aby pomóc zarodkowi wykluć się i wspomóc proces implantacji rozwijającego się zarodka.
- W przypadku dawstwa komórek jajowych i dawstwa zarodków powstały zarodek po zapłodnieniu jest wprowadzany do innej kobiety niż ta, która dostarcza jaja. Są to zasoby dla osób bez jaj z powodu operacji, chemioterapii lub przyczyn genetycznych; lub ze słabą jakością jaj, wcześniej nieudanymi cyklami zapłodnienia in vitro lub zaawansowanym wiekiem matki . W procesie dawczyni komórki jajowe są pobierane z jajników dawczyni, zapładniane w laboratorium nasieniem partnera biorcy, a powstałe w ten sposób zdrowe zarodki wracają do macicy biorcy.
- W selekcji oocytów można wybrać oocyty o optymalnych szansach na żywe urodzenie . Może być również stosowany jako środek do preimplantacyjnych badań przesiewowych genetycznych .
- Podział zarodków można wykorzystać do bliźniaczej współpracy w celu zwiększenia liczby dostępnych zarodków.
- Transfer cytoplazmatyczny polega na tym, że cytoplazma z komórki jajowej dawcy jest wstrzykiwana do komórki jajowej z uszkodzonymi mitochondriami . Powstały jajo zostaje zapłodnione ze spermy i implantowane w macicy , zwykle, że kobiety, która przekazała jajko odbiorcy i DNA jądrowego . Transfer cytoplazmatyczny powstał z myślą o osobach, które doświadczają niepłodności z powodu niedoboru lub uszkodzenia mitochondriów , zawartych w cytoplazmie komórki jajowej .
Resztki zarodków lub jajeczek
Mogą istnieć resztki embrionów lub komórek jajowych z procedur IVF, jeśli kobieta, dla której zostały pierwotnie stworzone, pomyślnie przeszła jedną lub więcej ciąż do porodu i nie chce ich już używać. Za zgodą kobiety lub pary mogą one zostać przekazane na pomoc innym osobom lub parom jako sposób reprodukcji przez osoby trzecie .
W przypadku dawstwa zarodków te dodatkowe zarodki są przekazywane innym parom lub osobom do transferu w celu uzyskania udanej ciąży. Biorcy zarodków zazwyczaj mają problemy genetyczne lub ich własne zarodki lub jaja o niskiej jakości. Powstałe dziecko uważa się za dziecko kobiety, która je nosi i rodzi, a nie za dziecko dawcy, tak samo jak w przypadku dawstwa komórek jajowych lub nasienia .
Zazwyczaj rodzice genetyczni oddają komórki jajowe lub zarodki do kliniki niepłodności, gdzie są one konserwowane przez krioprezerwację oocytów lub krioprezerwację zarodków do momentu znalezienia dla nich nosiciela. Zazwyczaj proces dopasowywania donacji do przyszłych rodziców jest prowadzony przez samą agencję, kiedy to klinika przenosi własność embrionów na przyszłych rodziców.
W Stanach Zjednoczonych osoby pragnące zostać biorcami zarodków przechodzą badania przesiewowe w kierunku chorób zakaźnych wymagane przez Agencję ds. Żywności i Leków (FDA) oraz testy reprodukcyjne w celu określenia najlepszego miejsca umieszczenia i czasu cyklu przed faktycznym przeniesieniem zarodka. Ilość badań przesiewowych embrionu, które zostały już poddane, w dużej mierze zależy od własnej kliniki i procesu zapłodnienia in vitro rodziców genetycznych. Odbiorca zarodka może zdecydować się na powierzenie dalszego badania własnemu embriologowi .
Alternatywą dla oddawania niewykorzystanych embrionów jest ich niszczenie (lub wszczepienie w czasie, gdy ciąża jest bardzo mało prawdopodobna), zamrożenie ich na czas nieokreślony lub oddanie ich do badań (co powoduje ich niezdolność do życia). Indywidualne poglądy moralne na pozbywanie się resztek embrionów mogą zależeć od osobistych poglądów na początek ludzkiej osobowości oraz od definicji i/lub wartości potencjalnych przyszłych osób , a także od wartości, jaką przypisuje się podstawowym kwestiom badawczym. Niektórzy uważają, że oddanie resztek embrionów do badań jest dobrą alternatywą dla odrzucania embrionów, gdy pacjenci otrzymują właściwe, uczciwe i jasne informacje o projekcie badawczym, procedurach i wartościach naukowych.
Historia
Pierwsze udane narodziny dziecka po leczeniu in vitro, Louise Brown , miały miejsce w 1978 roku. Louise Brown urodziła się w wyniku naturalnego cyklu in vitro, w którym nie wykonywano żadnej stymulacji. Procedura miała miejsce w szpitalu Dr Kershaw's Cottage Hospital (obecnie Hospicjum Dr Kershaw's) w Royton , Oldham, Anglia. Robert G. Edwards otrzymał Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 2010 roku, fizjolog, który opracował leczenie wspólnie z Patrickiem Steptoe i embriologiem Jean Purdy ; Steptoe i Purdy nie kwalifikowali się do rozpatrzenia, ponieważ Nagroda Nobla nie jest przyznawana pośmiertnie.
Drugie udane narodziny dziecka z probówki miały miejsce w Indiach zaledwie 67 dni po narodzinach Louise Brown. Dziewczyna o imieniu Durga została poczęta in vitro przy użyciu metody opracowanej niezależnie przez dr Subhasha Mukhopadhyaya , lekarza i badacza z Kalkuty w Indiach.
W przypadku dawstwa komórek jajowych i zapłodnienia in vitro osoby, które przekroczyły wiek rozrodczy, mają niepłodnych partnerów płci męskiej, mają idiopatyczne problemy z płodnością kobiet lub osiągnęły menopauzę, mogą nadal zajść w ciążę. Adriana Iliescu posiadała rekord jako najstarsza kobieta, która urodziła przy użyciu IVF i komórki jajowej dawcy, kiedy urodziła w 2004 roku w wieku 66 lat, rekord padł w 2006 roku. Po leczeniu IVF niektóre pary są w stanie zajść w ciążę bez żadnego leczenie płodności. W 2018 roku oszacowano, że na świecie przy użyciu zapłodnienia in vitro i innych technik wspomaganego rozrodu urodziło się osiem milionów dzieci.
Etyka
Pomyłki
W niektórych przypadkach dochodziło do pomyłek laboratoryjnych (błędnie zidentyfikowane gamety, przenoszenie niewłaściwych embrionów), co prowadziło do wszczęcia postępowania sądowego przeciwko dostawcy IVF i skomplikowanych spraw dotyczących ojcostwa. Przykładem jest przypadek kobiety z Kalifornii, która otrzymała embrion innej pary i została powiadomiona o tym błędzie po urodzeniu syna. Doprowadziło to do tego, że wiele organów i poszczególnych klinik wdraża procedury minimalizujące ryzyko takich pomyłek. Na przykład HFEA wymaga, aby kliniki stosowały system podwójnego obserwowania, tożsamość okazów jest sprawdzana przez dwie osoby w każdym punkcie, w którym próbki są przesyłane. Alternatywnie, rozwiązania technologiczne zyskują na popularności, aby zmniejszyć koszty siły roboczej ręcznego podwójnego obserwowania i jeszcze bardziej zmniejszyć ryzyko dzięki unikatowo ponumerowanym znacznikom RFID , które mogą być identyfikowane przez czytniki podłączone do komputera. Komputer śledzi próbki przez cały proces i ostrzega embriologa, jeśli zostaną zidentyfikowane niepasujące próbki. Chociaż wykorzystanie śledzenia RFID rozszerzyło się w Stanach Zjednoczonych, nadal nie jest ono powszechnie stosowane.
Preimplantacyjna diagnostyka genetyczna lub badania przesiewowe
Chociaż PGD został pierwotnie zaprojektowany do badań przesiewowych pod kątem embrionów będących nosicielami dziedzicznych chorób genetycznych, metoda ta została zastosowana do wybrania cech niezwiązanych z chorobami, co rodzi pytania etyczne. Przykładami takich przypadków są selekcja embrionów na podstawie zgodności tkankowej (HLA) do oddania tkanek choremu członkowi rodziny, diagnoza genetycznej podatności na chorobę oraz selekcja płci .
Te przykłady budzą problemy etyczne ze względu na moralność eugeniki . Staje się niezadowolony ze względu na tę zaletę, że jest w stanie wyeliminować niepożądane cechy i wybrać pożądane cechy. Stosując PGD, jednostki mają możliwość nieetycznego tworzenia ludzkiego życia i polegania na nauce, a nie na doborze naturalnym .
Na przykład głucha para Brytyjczyków, Tom i Paula Lichy, złożyli petycję o stworzenie głuchego dziecka przy użyciu zapłodnienia in vitro. Niektórzy etycy medyczni byli bardzo krytyczni wobec tego podejścia. Jacob M. Appel napisał, że „celowo uboju z embrionów niewidomych lub głuchych może uniemożliwić znaczne przyszłe cierpienia, podczas gdy polityka który pozwolił głuchy czy ślepy rodzice, aby wybrać dla takich cech celowo byłoby znacznie bardziej kłopotliwe.”
Chęć zysku w branży
W 2008 roku kalifornijski lekarz przeniósł 12 embrionów kobiecie, która urodziła ośmiornice ( oktuplety Sulemana ). Doprowadziło to do oskarżeń, że lekarz jest skłonny narażać zdrowie, a nawet życie ludzi w celu zdobycia pieniędzy. Robert Winston, profesor studiów nad płodnością w Imperial College London, nazwał branżę „skorumpowaną” i „chciwą”, stwierdzając, że „jednym z głównych problemów, z jakimi borykamy się w opiece zdrowotnej, jest to, że zapłodnienie in vitro stało się ogromnym przemysłem komercyjnym” i że „co zdarzyło się, oczywiście, że pieniądze psują całą tę technologię”, a władze oskarżyły władze o brak ochrony par przed wyzyskiem: „Organ regulacyjny wykonał niezmiennie złą robotę. bardzo dobra informacja dla par, nie jest ograniczona liczba nienaukowych zabiegów, do których ludzie mają dostęp”. Branża IVF została opisana jako rynkowa konstrukcja zdrowia, medycyny i ludzkiego ciała.
W USA klauzula praw autorskich zapewnia innowatorom tymczasowy monopol na ich pracę. W rezultacie zapłodnienie in vitro jest zbyt drogie dla pacjentów, ponieważ dostawcy muszą również pokrywać koszty patentów. Na przykład 23andMe opatentowało proces służący do obliczania prawdopodobieństwa dziedziczenia genów.
Branża została oskarżona o wygłaszanie nienaukowych twierdzeń i przekręcanie faktów dotyczących niepłodności, w szczególności poprzez mocno przesadzone twierdzenia o tym, jak powszechna jest niepłodność w społeczeństwie, w celu uzyskania jak największej liczby par i jak najszybszego wypróbowania terapii ( zamiast próbować zajść w ciążę naturalnie przez dłuższy czas). Grozi to usunięciem niepłodności z kontekstu społecznego i sprowadzeniem doświadczenia do prostej biologicznej awarii, którą nie tylko można leczyć za pomocą procedur biomedycznych, ale należy je leczyć. Rzeczywiście, istnieją poważne obawy dotyczące nadużywania terapii, na przykład dr Sami David, specjalista ds. płodności, wyraził rozczarowanie obecnym stanem branży i powiedział, że wiele procedur jest niepotrzebnych; powiedział: „To bycie pierwszym wyborem leczenia, a nie ostatnim wyborem. Kiedy po raz pierwszy został otwarty pod koniec lat 70., na początku lat 80., miał być ostatnią deską ratunku. Teraz jest to pierwsza deska ratunku. Myślę, że może na dłuższą metę krzywdzić kobiety”. W ten sposób zapłodnienie in vitro podnosi kwestie etyczne dotyczące nadużywania faktów biomedycznych do „sprzedawania” procedur korekcyjnych i leczenia stanów, które odbiegają od skonstruowanego ideału „zdrowego” lub „normalnego” ciała, tj. płodnych kobiet i mężczyzn z układem rozrodczym zdolnym do współprodukujące potomstwo.
IVF w wieku powyżej 40 lat
Wszystkie ciąże mogą być ryzykowne, ale istnieje większe ryzyko dla osób starszych i powyżej 40 roku życia. Im starsi ludzie, tym bardziej ryzykowna jest ciąża. Wraz z wiekiem ludzie częściej cierpią na takie schorzenia, jak cukrzyca ciążowa i stan przedrzucawkowy. Jeśli starsi ludzie zajdą w ciążę w wieku powyżej 40 lat, ich potomstwo może mieć niższą masę urodzeniową i może wymagać intensywnej opieki. Z tego powodu zwiększone ryzyko jest wystarczającym powodem do niepokoju. Powszechnie uważa się, że za ryzyko uważa się wysoką częstość cesarskiego cięcia u starszych matek.
Chociaż istnieje pewne ryzyko związane ze starszymi ciążami, istnieją pewne korzyści związane z cesarskim cięciem. Badanie wykazało, że porody powyżej 40 roku życia mają niższy wskaźnik urazów porodowych z powodu zwiększonego porodu przez cesarskie cięcie. Chociaż uważa się, że cesarskie cięcie przynosi korzyści matkom powyżej 40 roku życia, nadal należy wziąć pod uwagę wiele czynników ryzyka. Cięcie cesarskie może stanowić takie samo ryzyko jak cukrzyca ciążowa.
Osoby poczęte w wieku 40 lat mają większe ryzyko nadciśnienia ciążowego i przedwczesnego porodu. Potomstwo jest zagrożone, gdy rodzi się ze starszych matek, a także ryzyko związane z poczęciem przez zapłodnienie in vitro.
Adriana Iliescu przez jakiś czas utrzymywała rekord jako najstarsza kobieta, która urodziła przy użyciu zapłodnienia in vitro i komórki jajowej dawcy, kiedy urodziła w 2004 roku w wieku 66 lat. We wrześniu 2019 roku 74-letnia kobieta stała się najstarszą w historii rodzić po urodzeniu bliźniąt w szpitalu w Guntur , Andhra Pradesh .
Ciąża po menopauzie
Chociaż menopauza jest naturalną barierą dla dalszego poczęcia, zapłodnienie in vitro pozwoliło zajść w ciążę osobom po pięćdziesiątce i sześćdziesiątce. Osoby, których macica została odpowiednio przygotowana, otrzymują zarodki pochodzące z komórki jajowej dawcy komórki jajowej. Dlatego też, chociaż ci ludzie nie mają genetycznego związku z dzieckiem, mają fizyczne połączenie poprzez ciążę i poród. W wielu przypadkach partnerem kobiety jest genetyczny ojciec dziecka. Nawet po menopauzie macica jest w pełni zdolna do zajścia w ciążę.
Pary osób tej samej płci, samotni i niezamężni rodzice
W oświadczeniu ASRM z 2009 r. nie znaleziono przekonujących dowodów na to, że dzieci są krzywdzone lub pokrzywdzone wyłącznie przez wychowywanie przez samotnych rodziców, nieżonatych rodziców lub rodziców homoseksualnych. Nie popierał ograniczania dostępu do technologii wspomaganego rozrodu na podstawie stanu cywilnego lub orientacji seksualnej przyszłego rodzica.
Kwestie etyczne obejmują prawa reprodukcyjne, dobro potomstwa, niedyskryminację osób niezamężnych, homoseksualizm i autonomię zawodową.
Ostatnie kontrowersje w Kalifornii koncentrowały się na pytaniu, czy lekarze sprzeciwiający się związkom osób tej samej płci powinni być zobowiązani do wykonywania zapłodnienia in vitro dla pary lesbijek. Guadalupe T. Benitez, lesbijska asystentka medyczna z San Diego, pozwała lekarzy Christine Brody i Douglasa Fentona z North Coast Woman's Care Medical Group po tym, jak Brody powiedział jej, że ma „obiekcje religijne do leczenia jej i ogólnie homoseksualistów, aby im pomóc począć dzieci poprzez sztuczne zapłodnienie” i Fenton odmówiła autoryzacji uzupełnienia swojej recepty na lek na płodność Clomid z tych samych powodów. Kalifornijskie Stowarzyszenie Medyczne początkowo opowiedziało się po stronie Brody'ego i Fentona, ale sprawa North Coast Women's Care Medical Group przeciwko Sądowi Najwyższemu została jednogłośnie rozstrzygnięta przez Sąd Najwyższy stanu Kalifornia na korzyść Beniteza w dniu 19 sierpnia 2008 roku.
IVF jest coraz częściej używany, aby umożliwić lesbijkom i innym parom LGBT udział w procesie rozrodczym za pomocą techniki zwanej wzajemnym IVF . Jaja jednego partnera są wykorzystywane do tworzenia embrionów, które druga partnerka przenosi przez ciążę.
Nadya Suleman zwróciła uwagę międzynarodowej społeczności po wszczepieniu dwunastu embrionów, z których osiem przeżyło, co spowodowało dodanie ośmiu noworodków do jej sześciodzietnej rodziny. Kalifornijska Rada Medyczna starała się o odebranie licencji lekarzowi od niepłodności Michaelowi Kamrava, który leczył Sulemana. Urzędnicy państwowi twierdzą, że wykonanie procedury Sulemana jest dowodem nierozsądnego osądu, niedostatecznej opieki i braku troski o ośmioro dzieci, które poczęła i sześcioro, które już miała problemy z wychowaniem. W dniu 1 czerwca 2011 r. komisja lekarska wydała orzeczenie o cofnięciu licencji lekarskiej Kamravy z dniem 1 lipca 2011 r.
Anonimowi darczyńcy
Niektóre dzieci poczęte metodą zapłodnienia in vitro przy użyciu anonimowych dawców zgłaszają zaniepokojenie tym, że nie wiedzą o swoim rodzicu-dawcy, jak również o genetycznych krewnych, których mogą mieć i historii ich rodziny.
Alana Stewart, która została poczęta przy użyciu nasienia dawcy, założyła internetowe forum dla dzieci dawców o nazwie AnonymousUS w 2010 roku. Forum z zadowoleniem przyjmuje punkt widzenia każdego zaangażowanego w proces zapłodnienia in vitro. Olivia Pratten, poczęta od dawcy Kanadyjka, pozwała w 2008 r. prowincję Kolumbia Brytyjska o dostęp do danych dotyczących tożsamości jej ojca dawcy. „Nie jestem leczeniem, jestem osobą, a te dane należą do mnie” powiedział. W maju 2012 r. sąd orzekł na korzyść Prattena, uznając, że obowiązujące wówczas przepisy dyskryminowały dzieci dawców i delegalizowały anonimowe dawstwo nasienia i komórek jajowych w Kolumbii Brytyjskiej.
W Wielkiej Brytanii, Szwecji, Norwegii, Niemczech, Włoszech, Nowej Zelandii i niektórych stanach australijskich darczyńcy nie otrzymują wynagrodzenia i nie mogą być anonimowi.
W 2000 r. utworzono stronę internetową o nazwie Rejestr rodzeństwa dawcy, aby pomóc biologicznym dzieciom ze wspólnym dawcą połączyć się ze sobą.
W 2012 roku ukazał się film dokumentalny zatytułowany Anonimowy Dzień Ojca, który skupia się na dzieciach poczętych przez dawców.
Niechciane embriony
Podczas fazy selekcji i transferu wiele zarodków może zostać odrzuconych na rzecz innych. Wybór ten może opierać się na kryteriach, takich jak zaburzenia genetyczne lub płeć. Jednym z najwcześniejszych przypadków specjalnej selekcji genów za pomocą zapłodnienia in vitro był przypadek rodziny Collins w latach 90., która wybrała płeć swojego dziecka. Kwestie etyczne pozostają nierozwiązane, ponieważ w nauce, religii i filozofii nie ma konsensusu co do tego, kiedy ludzki embrion powinien być uznany za osobę. Dla tych, którzy wierzą, że dzieje się to w momencie poczęcia, zapłodnienie in vitro staje się kwestią moralną, gdy zapłodnionych zostaje wiele komórek jajowych, rozpoczyna się rozwój i tylko kilka zostaje wybranych do implantacji.
Gdyby zapłodnienie in vitro polegało na zapłodnieniu tylko jednej komórki jajowej, a przynajmniej tylko tej liczby, która zostanie wszczepiona, nie stanowiłoby to problemu. Jednak ma to szansę dramatycznie zwiększyć koszty, ponieważ można próbować tylko kilku jaj na raz. W rezultacie para musi zdecydować, co zrobić z tymi dodatkowymi embrionami. W zależności od ich opinii na temat człowieczeństwa embrionu lub szansy, że para będzie chciała spróbować mieć kolejne dziecko, para ma wiele możliwości radzenia sobie z dodatkowymi embrionami. Pary mogą zamrozić je, przekazać innym niepłodnym parom, rozmrozić lub przekazać je na badania medyczne. Trzymanie ich w stanie zamrożonym kosztuje, darowanie ich nie daje gwarancji przeżycia, rozmrażanie sprawia, że stają się natychmiast nieopłacalne, a badania medyczne skutkują ich usunięciem. W sferze badań medycznych parze niekoniecznie mówi się, do czego będą wykorzystywane embriony, w wyniku czego niektóre z nich można wykorzystać w badaniach nad komórkami macierzystymi , w dziedzinie postrzeganej jako stwarzająca problemy etyczne.
Odpowiedź religijna
Kościół katolicki sprzeciwia się wszelkiego rodzaju wspomaganego rozrodu i sztucznej antykoncepcji , uzasadniając, że oddzielenie prokreacji cel seksu małżeńskiego z celem zjednoczenia małżonków. Kościół katolicki zezwala na stosowanie niewielkiej liczby technologii reprodukcyjnych i metod antykoncepcyjnych, takich jak naturalne planowanie rodziny , które obejmuje rejestrowanie czasów owulacji, oraz zezwala na inne formy technologii reprodukcyjnych, które umożliwiają poczęcie z normatywnego stosunku płciowego, takie jak płodność smar. Papież Benedykt XVI publicznie ponownie podkreślił sprzeciw Kościoła katolickiego wobec zapłodnienia in vitro, mówiąc, że zastępuje ono miłość między mężem a żoną.
Katechizm Kościoła Katolickiego, zgodnie z katolickim rozumieniem prawa naturalnego , naucza, że reprodukcja ma „nierozerwalny związek” ze związkiem seksualnym par małżeńskich. Ponadto Kościół sprzeciwia się zapłodnieniu in vitro, ponieważ może to skutkować pozbyciem się embrionów; w katolicyzmie embrion jest postrzegany jako jednostka z duszą, którą należy traktować jak osobę. Kościół katolicki utrzymuje, że bezpłodność nie jest obiektywnie zła i zaleca adopcję jako opcję dla takich par, które nadal chcą mieć dzieci.
Hindusi witają zapłodnienie in vitro jako prezent dla tych, którzy nie są w stanie urodzić dzieci i ogłosili, że lekarze spokrewnieni z zapłodnieniem in vitro prowadzą punya, ponieważ istnieje kilka postaci, które rzekomo urodziły się bez stosunku, głównie Kaurav i pięciu Pandavów .
Jeśli chodzi o reakcję islamu na in vitro , ogólny konsensus współczesnych uczonych sunnickich stwierdza, że metody in vitro są niemoralne i zabronione. Jednak fatwa ART Gad El-Hak Ali Gad El-Hak's ART zawiera, że:
- IVF komórki jajowej żony z nasieniem męża i przeniesienie zapłodnionego jaja z powrotem do macicy żony jest dozwolone pod warunkiem, że zabieg jest wskazany ze względów medycznych i jest wykonywany przez biegłego lekarza.
- Ponieważ małżeństwo jest umową między żoną a mężem w okresie ich małżeństwa, żadna osoba trzecia nie powinna ingerować w małżeńskie funkcje seksu i prokreacji. Oznacza to, że dawca będący osobą trzecią jest niedopuszczalny, niezależnie od tego, czy dostarcza nasienie, komórki jajowe, zarodki czy macicę. Wykorzystywanie osób trzecich jest równoznaczne z zina , czyli cudzołóstwem .
W ortodoksyjnej społeczności żydowskiej koncepcja ta jest przedmiotem dyskusji, ponieważ nie ma precedensu w tradycyjnych żydowskich prawnych źródłach tekstowych. Jeśli chodzi o prawa seksualności , wyzwania religijne obejmują masturbację (którą można uznać za „marnowanie nasion”), prawa związane z aktywnością seksualną i menstruacją ( niddah ) oraz szczególne przepisy dotyczące współżycia. Dodatkową ważną kwestią jest ustalenie ojcostwa i rodowodu. Dla dziecka poczętego w sposób naturalny o tożsamości ojca decyduje prawne domniemanie ( chazakah ) prawowitości: rov bi'ot achar ha'baal – zakłada się, że stosunki seksualne kobiety są z jej mężem. W przypadku dziecka in vitro takie założenie nie istnieje i jako takie rabin Eliezer Waldenberg (m.in.) wymaga od zewnętrznego opiekuna pozytywnej identyfikacji ojca. Judaizm reformowany ogólnie zaaprobował in vitro.
Społeczeństwo i kultura
Wiele osób z Afryki Subsaharyjskiej decyduje się na wychowywanie swoich dzieci przez osoby bezpłodne. IVF umożliwia tym bezpłodnym kobietom posiadanie własnych dzieci, co narzuca nowe ideały kulturze, w której wychowywanie dzieci jest postrzegane jako ważne zarówno z natury, jak i kulturowo. Wiele niepłodnych kobiet jest w stanie zyskać większy szacunek w swoim społeczeństwie, opiekując się dziećmi innych matek, a to może zostać utracone, jeśli zdecydują się zamiast tego zastosować zapłodnienie in vitro. Ponieważ zapłodnienie in vitro jest postrzegane jako nienaturalne, może nawet utrudniać ich pozycję społeczną, w przeciwieństwie do zrównywania ich z płodnymi kobietami. Wychowywanie dzieci zastępczych jest również korzystne ekonomicznie dla osób niepłodnych, ponieważ daje im to większą możliwość dostępu do zasobów, które są ważne dla ich rozwoju, a także wspomaga rozwój ich społeczeństwa. Jeśli zapłodnienie in vitro stanie się bardziej popularne bez spadku wskaźnika urodzeń, może powstać więcej dużych domów rodzinnych z mniejszą liczbą opcji wysyłania noworodków. Może to spowodować wzrost liczby dzieci osieroconych i/lub zmniejszenie środków na dzieci z rodzin wielodzietnych. To ostatecznie zdławiłoby rozwój dzieci i społeczności.
W Stanach Zjednoczonych ananas stał się symbolem użytkowników IVF, prawdopodobnie dlatego, że niektórzy ludzie sądzili, bez dowodów naukowych, że jedzenie ananasa może nieznacznie zwiększyć wskaźnik powodzenia zabiegu.
Emocjonalne zaangażowanie z dziećmi
Badania wykazały, że matki in vitro wykazują większe zaangażowanie emocjonalne w swoje dziecko i bardziej cieszą się macierzyństwem niż matki z naturalnego poczęcia. Podobnie badania wykazały, że ojcowie in vitro wyrażają więcej ciepła i emocjonalnego zaangażowania niż ojcowie poprzez adopcję i naturalne poczęcie oraz bardziej cieszą się ojcostwem. Niektórzy rodzice in vitro nadmiernie angażują się w sprawy swoich dzieci.
Mężczyźni i zapłodnienie in vitro
Badania wykazały, że mężczyźni w dużej mierze postrzegają siebie jako „biernych współpracowników”, ponieważ mają „mniej fizyczne zaangażowanie” w leczenie in vitro. Mimo to wielu mężczyzn czuje się przygnębionych, widząc żniwo zastrzyków hormonalnych i trwającą fizyczną interwencję u swojej partnerki.
Stwierdzono, że płodność jest istotnym czynnikiem w postrzeganiu przez mężczyzn swojej męskości, co skłania wielu do utrzymywania leczenia w tajemnicy. W przypadkach, w których mężczyźni podzielili się tym, że on i jego partnerka przechodzili in vitro, zgłaszali, że dokuczali im głównie inni mężczyźni, chociaż niektórzy postrzegali to jako potwierdzenie wsparcia i przyjaźni. Dla innych prowadziło to do poczucia izolacji społecznej. W porównaniu z kobietami, mężczyźni wykazywali mniejsze pogorszenie zdrowia psychicznego w latach po nieudanym leczeniu. Jednak wielu mężczyzn odczuwało poczucie winy, rozczarowanie i nieadekwatność, twierdząc, że po prostu starali się zapewnić swoim partnerom „emocjonalny kamień”.
Koszt zapłodnienia in vitro
Koszty IVF można podzielić na koszty bezpośrednie i pośrednie. Koszty bezpośrednie obejmują same zabiegi medyczne, w tym konsultacje lekarskie, leki, USG, badania laboratoryjne, samą procedurę zapłodnienia in vitro oraz wszelkie związane z tym opłaty szpitalne i koszty administracyjne. Koszty pośrednie obejmują koszty leczenia wszelkich komplikacji związanych z leczeniem, koszty podróży pacjentów i stracone godziny produktywności. Koszty te mogą być wyolbrzymione przez rosnący wiek kobiet poddawanych zabiegowi IVF (szczególnie kobiet powyżej 40 roku życia) oraz wzrost kosztów związanych z porodami mnogimi. Na przykład ciąża z bliźniętami może kosztować nawet trzy razy więcej niż ciąża pojedyncza.
Dostępność i wykorzystanie
Wysokie koszty sprawiają, że zapłodnienie in vitro jest poza zasięgiem wielu krajów rozwijających się, ale badania przeprowadzone przez Instytut Technologii Płodności w Genk w Belgii twierdzą, że znaleziono znacznie niższą metodologię (redukcja o około 90%) o podobnej skuteczności, która może być odpowiednia dla niektórych leczenie bezpłodności. Co więcej, prawo wielu krajów zezwala na zapłodnienie in vitro tylko samotnym kobietom, parom lesbijek i osobom uczestniczącym w umowach o macierzyństwo zastępcze. Stosowanie PGD daje członkom tych wybranych grup demograficznych nieproporcjonalny dostęp do sposobów tworzenia dziecka posiadającego cechy, które uważają za „idealne”, podnosząc kwestię równych szans zarówno dla pokolenia rodziców/rodziców, jak i dla pokolenia dziecka. Wiele płodnych par domaga się teraz równego dostępu do badań przesiewowych embrionów, aby ich dziecko mogło być tak samo zdrowe, jak dziecko powstałe w wyniku zapłodnienia in vitro. Masowe stosowanie PGD, zwłaszcza jako środka kontroli populacji lub w obecności środków prawnych związanych z kontrolą populacji lub demograficzną, może prowadzić do zamierzonych lub niezamierzonych skutków demograficznych, takich jak wypaczone proporcje żywych urodzeń obserwowane w komunistycznych Chinach po wprowadzeniu jego polityka jednego dziecka .
Australia
W Australii średni wiek osób poddawanych leczeniu ART wynosi 35,5 lat wśród osób używających własnych komórek jajowych (co czwarta osoba ma 40 lat lub więcej) i 40,5 lat wśród osób używających jaj od dawców . Chociaż zapłodnienie in vitro jest dostępne w Australii, Australijczycy stosujący zapłodnienie in vitro nie są w stanie wybrać płci swojego dziecka.
Kamerun
Ernestine Gwet Bell nadzorowała pierwsze kameruńskie dziecko urodzone przez in vitro w 1998 roku.
Kanada
W Kanadzie jeden cykl leczenia IVF może kosztować od 7750 do 12250 CAD, a same leki mogą kosztować od 2500 do ponad 7000 CAD. Mechanizmy finansowania wpływające na dostępność w Kanadzie różnią się w zależności od prowincji i terytorium, przy czym niektóre prowincje zapewniają pełne, częściowe pokrycie lub brak pokrycia.
New Brunswick zapewnia częściowe finansowanie za pośrednictwem specjalnego funduszu pomocy w przypadku niepłodności – jednorazowej dotacji w wysokości do 5000 USD. Pacjenci mogą ubiegać się tylko o 50% kosztów leczenia lub 5000 USD (w zależności od tego, która kwota jest niższa) po kwietniu 2014 r. Kwalifikujący się pacjenci muszą być pełnoetatowymi mieszkańcami New Brunswick z ważną kartą Medicare i mieć oficjalną diagnozę medyczną niepłodności przez lekarza.
W grudniu 2015 r. rząd prowincji Ontario uchwalił Ontario Fertility Program dla pacjentów z niepłodnością medyczną i niemedyczną, niezależnie od orientacji seksualnej, płci czy składu rodziny. Pacjenci kwalifikujący się do leczenia in vitro muszą być mieszkańcami Ontario w wieku poniżej 43 lat i posiadać ważną kartę Ontario Health Insurance Plan oraz nie przeszli jeszcze żadnego cyklu in vitro. Zasięg jest obszerny, ale nie uniwersalny. Zakres obejmuje niektóre badania krwi i moczu, porady i konsultacje lekarskie/pielęgniarskie, niektóre USG, maksymalnie dwa monitorowanie cykli, rozmrażanie, zamrażanie i hodowlę zarodków, zapłodnienie i usługi embriologiczne, pojedyncze transfery wszystkich zarodków oraz jedno chirurgiczne pobranie nasienia przy użyciu określonych techniki tylko w razie potrzeby. Program nie obejmuje leków i leków, a także porad psychologa lub pracownika socjalnego, przechowywania i wysyłki komórek jajowych, nasienia lub zarodków oraz zakupu nasienia lub komórek jajowych dawców.
Indie
Penetracja rynku IVF w Indiach jest obecnie dość niska, z zaledwie 2800 cyklami na milion niepłodnych osób w wieku reprodukcyjnym (20-44 lata) w porównaniu z Chinami, które mają 6500 cykli. Kluczowe wyzwania to brak świadomości, przystępność cenowa i dostępność. Indie w 2018 roku stają się celem turystyki bezpłodności ze względu na najbardziej przystępne koszty leczenia in vitro. Koszt leczenia zapłodnienia in vitro w Indiach waha się od 2000 do 4000 USD (w przybliżeniu od 150000/- INR do 250000/- INR, w tym wszystkie aspekty leczenia IVF za pomocą leków, które są prawie 5 razy niższe niż koszt IVF w zachodniej części świata.
Izrael
Izrael ma najwyższy wskaźnik zapłodnienia in vitro na świecie, z 1657 procedurami wykonywanymi na milion osób rocznie. Pary bez dzieci mogą otrzymać dofinansowanie na IVF dla maksymalnie dwojga dzieci. Takie same fundusze są dostępne dla osób bezdzietnych, które wychowują do 2 dzieci w domu samotnym . IVF jest dostępny dla osób w wieku od 18 do 45 lat. Izraelskie Ministerstwo Zdrowia twierdzi, że wydaje około 3450 USD na zabieg.
Szwecja
Jeden, dwa lub trzy zabiegi zapłodnienia in vitro są dotowane przez rząd dla osób w wieku poniżej 40 lat i niemających dzieci. Zasady dotyczące liczby dotowanych terapii oraz górna granica wieku dla ludności różnią się w poszczególnych radach hrabstw . Leczone są osoby samotne, a adopcja zarodków jest dozwolona. Istnieją również prywatne kliniki, które oferują leczenie za opłatą.
Zjednoczone Królestwo
Dostępność IVF w Anglii określają grupy zlecające badania kliniczne . Narodowy Instytut Zdrowia i Opieki doskonałości zaleca maksymalnie 3 cykli leczenia dla osób poniżej 40 lat z minimalnym sukcesu poczęciu po 2 latach seks bez zabezpieczenia. Cykle nie będą kontynuowane dla osób powyżej 40 roku życia. CCG w Essex , Bedfordshire i Somerset ograniczyły finansowanie do jednego cyklu lub do żadnego, i oczekuje się, że redukcje staną się bardziej powszechne. Finansowanie może być dostępne w „wyjątkowych okolicznościach” – na przykład, jeśli partner płci męskiej ma zakaźną infekcję lub jeden z partnerów jest dotknięty leczeniem raka. Według grupy kampanijnej Fertility Fairness „pod koniec 2014 roku każda CCG w Anglii finansowała przynajmniej jeden cykl zapłodnienia in vitro”. Ceny płacone przez NHS w Anglii wahały się od poniżej 3000 GBP do ponad 6 000 GBP w roku 2014/5. W lutym 2013 r. koszt wdrożenia wytycznych NICE dotyczących zapłodnienia in vitro wraz z innymi metodami leczenia niepłodności oszacowano na 236 000 funtów rocznie na 100 000 członków populacji.
IVF coraz częściej pojawia się na czarnych listach leczenia NHS . W sierpniu 2017 r. pięć z 208 CCG całkowicie zaprzestało finansowania in vitro, a inni rozważali to. Do października 2017 r. tylko 25 CCG dostarczało trzy zalecane przez NHS cykle in vitro kwalifikującym się osobom poniżej 40 roku życia. Polityki mogą być niezgodne z przepisami dotyczącymi dyskryminacji, jeśli będą traktować pary tej samej płci inaczej niż pary heteroseksualne. W lipcu 2019 r. Jackie Doyle-Price powiedział, że kobiety rejestrowały się na operacje w większej odległości od swojego domu, aby obejść politykę racjonowania CCG.
Nawożenia i Embriologii Człowieka Urząd powiedział we wrześniu 2018 roku, że rodzice, którzy są ograniczone do jednego cyklu IVF, albo trzeba go zasilić siebie, są bardziej skłonni wybrać implantów wielu zarodków w nadziei, to zwiększa szanse na ciążę. To znacznie zwiększa prawdopodobieństwo porodów mnogich i związanych z tym złych wyników, co zwiększy koszty NHS. Prezes Royal College of Obstetricians and Gynecologists powiedział, że finansowanie 3 cykli było „najważniejszym czynnikiem w utrzymaniu niskich wskaźników ciąż mnogich i zmniejszeniu związanych z nimi powikłań”.
Stany Zjednoczone
W Stanach Zjednoczonych ogólna dostępność IVF w 2005 roku wynosiła 2,5 lekarza IVF na 100 000 populacji, a wykorzystanie 236 cykli IVF na 100 000. Na milion osób rocznie wykonuje się 126 zabiegów. Wykorzystanie silnie wzrasta wraz z dostępnością i ochroną ubezpieczeniową IVF, a w znacznym stopniu także z odsetkiem osób samotnych i medianą dochodów. W USA przeciętny cykl, od pobrania jaja do implantacji zarodka, kosztuje 12 400 USD, a firmy ubezpieczeniowe, które pokrywają koszty leczenia, nawet częściowo, zwykle ograniczają liczbę cykli, za które płacą. Do 2015 roku ponad milion dzieci urodziło się przy użyciu technologii IVF.
Koszt zapłodnienia in vitro odzwierciedla raczej koszt podstawowego systemu opieki zdrowotnej niż środowisko regulacyjne lub finansowe i waha się średnio dla standardowego cyklu IVF iw dolarach amerykańskich z 2006 r., od 12 500 USD w Stanach Zjednoczonych do 4000 USD w Japonii. W Irlandii zapłodnienie in vitro kosztuje około 4000 euro, a leki na płodność, w razie potrzeby, kosztują nawet 3000 euro. Koszt żywego urodzenia jest najwyższy w Stanach Zjednoczonych (41 000 USD) i Wielkiej Brytanii (40 000 USD), a najniższy w Skandynawii i Japonii (oba około 24 500 USD).
Wiele klinik leczenia niepłodności w Stanach Zjednoczonych ogranicza górny wiek, w którym ludzie kwalifikują się do zapłodnienia in vitro do 50 lub 55 lat. Te wartości graniczne utrudniają osobom w wieku powyżej pięćdziesięciu pięciu lat skorzystanie z procedury.
Alternatywy
Alternatywy dla IVF to głównie:
- Inseminacja sztuczna , w tym inseminacja doszyjkowa i inseminacja domaciczna nasienia. Wymaga owulacji kobiety, ale jest to stosunkowo prosta procedura i może być stosowana w domu do samodzielnego zapłodnienia bez pomocy lekarza. Beneficjentami sztucznego zapłodnienia są osoby, które pragną urodzić własne dziecko, które może być samotne, kobiety będące wzwiązku lesbijskim lub kobiety będące wzwiązku heteroseksualnym, ale z niepłodnym lub upośledzonym fizyczniepartnerem.co zapobiega pełnemu stosunkowi.
- Indukcja owulacji (w sensie leczenia zmierzające do rozwoju jednego lub dwóch owulacją pęcherzyków) jest alternatywą dla osób z brakiem jajeczkowania lub oligoovulation , ponieważ jest to tańsze i łatwiejsze do kontroli. Zwykle obejmuje antyestrogeny, takie jak cytrynian klomifenu lub letrozol , po czym następuje naturalne lub sztuczne zapłodnienie.
- Macierzyństwo zastępcze, w którym matka zastępcza zgadza się urodzić dziecko za inną osobę lub osoby, które po urodzeniu staną się rodzicami dziecka. Ludzie mogą starać się o macierzyństwo zastępcze, gdy ciąża jest medycznie niemożliwa, gdy ryzyko ciąży jest zbyt niebezpieczne dla planowanej matki lub gdy samotny mężczyzna lub para mężczyzn pragnie mieć dziecko.
- Przysposobienie polegające na tym, że osoba przejmuje opiekę nad innym, zwykle dzieckiem, od biologicznego lub prawnego rodzica lub rodziców tej osoby.
Status prawny
Agencje rządowe w Chinach wydały w 2003 roku zakazy stosowania in vitro przez osoby niezamężne lub pary z niektórymi chorobami zakaźnymi.
W Indiach stosowanie IVF jako środka do selekcji płci ( diagnostyka genetyczna przed implantacją ) jest zakazane na mocy Ustawy o technikach diagnostyki przed poczęciem i przedporodem z 1994 roku .
Sunnickie narody muzułmańskie generalnie zezwalają na zapłodnienie in vitro między parami małżeńskimi, gdy jest ono przeprowadzane z ich własnym nasieniem i komórkami jajowymi, ale nie z komórkami jajowymi dawców od innych par. Ale Iran, który jest szyickim muzułmaninem, ma bardziej złożony plan. Iran zakazuje dawstwa nasienia, ale zezwala na dawstwo zarówno zapłodnionych, jak i niezapłodnionych komórek jajowych. Zapłodnione jaja są oddawane od par małżeńskich innym parom małżeńskim, podczas gdy niezapłodnione jaja są oddawane w kontekście mut'ah lub tymczasowego małżeństwa z ojcem.
Do 2012 roku Kostaryka była jedynym krajem na świecie, w którym całkowicie zakazano technologii in vitro, ponieważ Sąd Najwyższy uznał ją za niekonstytucyjną, ponieważ „gwałciła życie”. Kostaryka była jedynym krajem na półkuli zachodniej, który zabronił in vitro. Projekt ustawy nadesłany niechętnie przez rząd prezydenta Laury Chinchilla został odrzucony przez parlament. Prezydent Szynszyla nie przedstawiła publicznie swojego stanowiska w sprawie in vitro. Jednak biorąc pod uwagę ogromny wpływ Kościoła katolickiego w jej rządzie, jakakolwiek zmiana status quo wydaje się bardzo mało prawdopodobna. Pomimo rządów Kostaryki i silnej opozycji religijnej zakaz in vitro został unieważniony przez Międzyamerykański Trybunał Praw Człowieka decyzją z 20 grudnia 2012 roku. ludzki embrion naruszał wolność reprodukcyjną niepłodnych par, ponieważ zakazywał im stosowania zapłodnienia in vitro, które często wiąże się z pozbyciem się embrionów niewszczepionych do macicy pacjentki. 10 września 2015 r. prezydent Luis Guillermo Solís podpisał dekret legalizujący zapłodnienie in vitro. Dekret został wpisany do dziennika urzędowego państwa 11 września. Przeciwnicy tej praktyki złożyli od tego czasu pozew do Trybunału Konstytucyjnego.
Wszystkie główne ograniczenia dotyczące osób samotnych, ale niepłodnych stosujących zapłodnienie in vitro zostały zniesione w Australii w 2002 r. po tym, jak ostateczna apelacja do Australijskiego Sądu Najwyższego została odrzucona z przyczyn proceduralnych w sprawie Leesa Meldrum. Victorian sąd federalny orzekł w 2000 roku, że istniejący zakaz wszelkich pojedynczych ludzi i lesbijek korzystających z IVF stanowiło dyskryminacji płciowej. Rząd Wiktorii ogłosił zmiany w swojej ustawie o zapłodnieniu in vitro w 2007 roku, eliminując pozostałe ograniczenia dotyczące płodnych samotnych osób i lesbijek, pozostawiając Australię Południową jako jedyny stan, który je utrzymuje.
Przepisy federalne w Stanach Zjednoczonych obejmują wymagania dotyczące badań przesiewowych i ograniczenia dotyczące darowizn, ale generalnie nie dotyczą partnerów intymnych seksualnie. Jednak lekarze mogą być zobowiązani do zapewnienia leczenia ze względu na przepisy dotyczące niedyskryminacji, jak na przykład w Kalifornii. Stan Tennessee w USA zaproponował w 2009 r. projekt ustawy, która określałaby in vitro dawcę jako adopcję. Podczas tej samej sesji inny projekt ustawy proponował zakaz adopcji dla par niebędących w związku małżeńskim i żyjących w konkubinacie, a grupy aktywistów stwierdziły, że uchwalenie pierwszego projektu ustawy skutecznie powstrzymałoby osoby niezamężne od stosowania in vitro. Żaden z tych rachunków nie przeszedł.
Niewiele amerykańskich sądów zajęło się kwestią statusu „własności” zamrożonego embrionu. Ta kwestia może pojawić się w kontekście sprawy rozwodowej, w której sąd musiałby ustalić, który z małżonków byłby w stanie podjąć decyzję o rozdysponowaniu zarodków. Mogłoby to również powstać w kontekście sporu między dawcą nasienia a dawcą komórki jajowej, nawet jeśli byli stanu wolnego. W 2015 roku sąd stanu Illinois orzekł, że takie spory mogą być rozstrzygane na podstawie jakiejkolwiek umowy między przyszłymi rodzicami. W przypadku braku umowy sąd waży względne interesy stron.
Zobacz też
- Kriokonserwacja nasienia
- Evans przeciwko Wielkiej Brytanii , kluczowa sprawa przed Europejskim Trybunałem Praw Człowieka
- Wybór płci
- Kontrowersje dotyczące komórek macierzystych
- Wzajemne zapłodnienie in vitro
- Dzieci z probówki (film)
Bibliografia
Dalsza lektura
- Henig RM (2004). Dziecko Pandory: jak pierwsze dzieci z probówki wywołały rewolucję reprodukcyjną . Nowy Jork: Houghton Mifflin . Numer ISBN 978-0-618-22415-9.
- Hope T, Lockwood G, Lockwood M, Bewley S, Jackson J, Craft I (czerwiec 1995). „Czy starszym kobietom należy zaproponować zapłodnienie in vitro?” . BMJ . 310 (6992): 1455-8. doi : 10.1136/bmj.310.6992.1455 . PMC 2549820 . PMID 7613283 .
- Seng SW, Yeong CT, Loh SF, Sadhana N, Loh SK (marzec 2005). „Zapłodnienie in vitro u kobiet w wieku 40 lat i starszych” (PDF) . Singapur Medical Journal . 46 (3): 132–6. PMID 15735878 .
Zewnętrzne linki
- Kliniki i statystyki IVF w Wielkiej Brytanii , Urząd ds. Zapłodnienia Człowieka i Embriologii
- Informacje, statystyki i listy z USA dotyczące technologii wspomaganego rozrodu , Centers for Disease Control and Prevention
| Klasyfikacja |
|---|