Izoforma białka - Protein isoform

Izoformy białka , lub „ wariant białka ” jest element zestawu bardzo podobnych białek pochodzących z pojedynczego genu rodziny lub genu i są wynikiem różnic genetycznych. Chociaż wiele z nich pełni te same lub podobne role biologiczne, niektóre izoformy mają unikalne funkcje. Zestaw izoform białek można utworzyć z alternatywnych splicingów , zastosowania zmiennego promotora lub innych potranskrypcyjnych modyfikacji pojedynczego genu; generalnie nie uwzględnia się modyfikacji potranslacyjnych. Dzięki mechanizmom splicingu RNA mRNA ma zdolność wybierania różnych segmentów kodujących białko ( egzonów ) genu, a nawet różnych części eksonów z RNA w celu utworzenia różnych sekwencji mRNA. Każda unikalna sekwencja wytwarza określoną postać białka.
Odkrycie izoform mogłoby wyjaśnić rozbieżność między małą liczbą genów regionów kodujących białka ujawnioną w projekcie ludzkiego genomu a dużą różnorodnością białek obserwowaną w organizmie: różne białka kodowane przez ten sam gen mogą zwiększyć różnorodność proteomu . Izoformy na poziomie RNA można łatwo scharakteryzować za pomocą badań transkryptu cDNA . Wiele ludzkich genów posiada potwierdzone alternatywne izoformy splicingu . Oszacowano, że u ludzi można zidentyfikować ~ 100 000 znaczników sekwencji ulegających ekspresji ( EST ). Izoformy na poziomie białka mogą objawiać się delecją całych domen lub krótszych pętli, zwykle zlokalizowanych na powierzchni białka.
Definicja
Jeden gen ma zdolność wytwarzania wielu białek, które różnią się zarówno strukturą, jak i składem; proces ten jest regulowany przez alternatywne składanie mRNA, chociaż nie jest jasne, w jakim stopniu taki proces wpływa na różnorodność ludzkiego proteomu, ponieważ obfitość izoform transkryptu mRNA niekoniecznie koreluje z obfitością izoform białek. Specyfika translacji izoform wynika ze struktury / funkcji białka, a także z rodzaju komórki i etapu rozwoju, na którym są produkowane. Określenie specyficzności staje się bardziej skomplikowane, gdy białko ma wiele podjednostek, a każda podjednostka ma wiele izoform.
Na przykład kinaza białkowa aktywowana przez AMP 5 ' (AMPK), enzym, który pełni różne role w ludzkich komórkach, ma 3 podjednostki:
- α, domena katalityczna, ma dwie izoformy: α1 i α2, które są kodowane z PRKAA1 i PRKAA2
- β, domena regulatorowa, ma dwie izoformy: β1 i β2, które są kodowane z PRKAB1 i PRKAB2
- γ, domena regulatorowa, ma trzy izoformy: γ1, γ2 i γ3, które są kodowane z PRKAG1 , PRKAG2 i PRKAG3
W przypadku ludzkich mięśni szkieletowych preferowaną formą jest α2β2γ1. Ale w ludzkiej wątrobie najbardziej rozpowszechnioną formą jest α1β2γ1.
Mechanizm
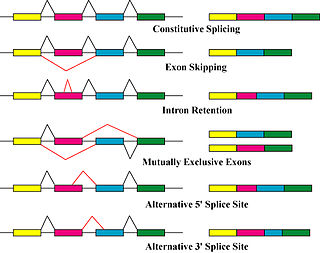
Podstawowymi mechanizmami wytwarzającymi izoformy białek są alternatywne splicing i zmienne użycie promotora, chociaż modyfikacje spowodowane zmianami genetycznymi, takie jak mutacje i polimorfizmy, są czasami również uważane za odrębne izoformy.
Alternatywny splicing jest głównym procesem modyfikacji potranskrypcyjnych, w wyniku którego powstają izoformy transkryptu mRNA, i jest głównym mechanizmem molekularnym, który może przyczyniać się do różnorodności białek. Spliceosomu duża rybonukleoproteina jest urządzenie cząsteczkowej w jądrze odpowiedzialnych za rozszczepianie RNA i ligacji , usuwanie niebiałkowych kodowania segmentów ( intronów ).
Ponieważ splicing jest procesem zachodzącym między transkrypcją a translacją , jego główne efekty badano głównie za pomocą technik genomicznych - na przykład analizy mikromacierzy i sekwencjonowanie RNA zostały wykorzystane do identyfikacji alternatywnie składanych transkryptów i pomiaru ich obfitości. Obfitość transkryptów jest często używana jako wskaźnik zastępczy dla obfitości izoform białek, chociaż eksperymenty proteomiczne z użyciem elektroforezy żelowej i spektrometrii mas wykazały, że korelacja między transkryptem a liczbą białek jest często niska, a jedna izoforma białka jest zwykle dominująca. W jednym z badań z 2015 roku stwierdzono, że przyczyna tej rozbieżności prawdopodobnie występuje po przetłumaczeniu, chociaż mechanizm jest zasadniczo nieznany. W konsekwencji, chociaż alternatywny splicing został uznany za ważny związek między zmiennością a chorobą, nie ma rozstrzygających dowodów na to, że działa on głównie poprzez wytwarzanie nowych izoform białek.
Alternatywne splicing ogólnie opisuje ściśle regulowany proces, w którym alternatywne transkrypty są celowo generowane przez maszynerię do składania. Jednak takie transkrypty są również wytwarzane przez błędy splicingu w procesie zwanym „hałaśliwym splicingiem” i są również potencjalnie przekształcane w izoformy białek. Chociaż uważa się, że ~ 95% genów wieloeksonowych jest składanych alternatywnie, w jednym badaniu dotyczącym hałaśliwego splicingu zaobserwowano, że większość różnych transkryptów występujących w małej ilości to szumy i przewiduje się, że większość alternatywnych izoform transkryptów i białek obecnych w komórce nie jest funkcjonalnie istotnych.
Inne etapy regulacyjne transkrypcji i potranskrypcji mogą również wytwarzać różne izoformy białek. Użycie zmiennego promotora występuje, gdy maszyneria transkrypcyjna komórki ( polimeraza RNA , czynniki transkrypcyjne i inne enzymy ) rozpoczyna transkrypcję na różnych promotorach - regionie DNA w pobliżu genu, który służy jako początkowe miejsce wiązania - w wyniku czego powstają nieznacznie zmodyfikowane transkrypty i białko izoformy.
Charakterystyka
Ogólnie rzecz biorąc, jedna izoforma białka jest oznaczana jako sekwencja kanoniczna w oparciu o kryteria, takie jak częstość występowania i podobieństwo do ortologicznych - lub funkcjonalnie analogicznych - sekwencji u innych gatunków. Zakłada się, że izoformy mają podobne właściwości funkcjonalne, ponieważ większość z nich ma podobne sekwencje i dzieli niektóre z większości eksonów z sekwencją kanoniczną. Jednak niektóre izoformy wykazują znacznie większą rozbieżność (na przykład przez trans-splicing ) i mogą mieć kilka lub nie mieć eksonów z sekwencją kanoniczną. Ponadto mogą mieć różne skutki biologiczne - na przykład w skrajnym przypadku funkcja jednej izoformy może sprzyjać przeżyciu komórki, podczas gdy inna sprzyja śmierci komórki - lub mogą mieć podobne podstawowe funkcje, ale różnią się lokalizacją subkomórkową. Jednak w badaniu z 2016 r. Funkcjonalnie scharakteryzowano wszystkie izoformy 1492 genów i ustalono, że większość izoform zachowuje się jak „funkcjonalne alloformy”. Autorzy doszli do wniosku, że izoformy zachowują się jak odrębne białka po zaobserwowaniu, że funkcje większości izoform nie pokrywają się. Ponieważ badanie przeprowadzono na komórkach in vitro , nie wiadomo, czy izoformy w eksprymowanym ludzkim proteomie mają te same cechy. Ponadto, ponieważ funkcję każdej izoformy należy generalnie określić oddzielnie, większość zidentyfikowanych i przewidywanych izoform nadal ma nieznane funkcje.
Powiązana koncepcja
Glikoform
Glikopostać to izoformy białka, które różnią się jedynie pod względem liczby i rodzaju przyłączonych glikanu . Glikoproteiny często składają się z wielu różnych glikoform, ze zmianami w przyłączonym sacharydzie lub oligosacharydzie . Modyfikacje te mogą wynikać z różnic w biosyntezie podczas procesu glikozylacji lub z działania glikozydaz lub glikozylotransferaz . Glikoformy można wykryć poprzez szczegółową analizę chemiczną oddzielonych glikoform, ale wygodniej jest wykryć je poprzez różnicową reakcję z lektynami , jak w przypadku chromatografii powinowactwa do lektyny i elektroforezy powinowactwa do lektyny . Typowymi przykładami glikoprotein składających się z glikoform są białka krwi, takie jak orosomukoid , antytrypsyna i haptoglobina . Niezwykłą zmienność glikoform obserwuje się w cząsteczce adhezji komórek neuronalnych, NCAM z udziałem kwasów polisialowych, PSA .
Przykłady
- G-aktyna : pomimo swojej konserwatywnej natury ma zmienną liczbę izoform (co najmniej sześć u ssaków).
- Kinaza kreatynowa , której obecność we krwi może być pomocna w diagnostyce zawału mięśnia sercowego , występuje w 3 izoformach.
- Syntaza hialuronianu , enzym odpowiedzialny za produkcję hialuronianu, ma trzy izoformy w komórkach ssaków.
- UDP-glukuronozylotransferaza , nadrodzina enzymów odpowiedzialna za szlak detoksykacji wielu leków, zanieczyszczeń środowiska i toksycznych związków endogennych, ma 16 znanych izoform zakodowanych w ludzkim genomie.
- G6PDA: normalny stosunek aktywnych izoform w komórkach dowolnej tkanki wynosi 1: 1, podobnie jak G6PDG. To jest dokładnie normalny stosunek izoform w hiperplazji. Tylko jedna z tych izoform jest wykrywana podczas nowotworu.
Oksydaza monoaminowa , rodzina enzymów katalizujących utlenianie monoamin, występuje w dwóch izoformach, MAO-A i MAO-B.
