Zespół Kallmanna - Kallmann syndrome
| Zespół Kallmanna | |
|---|---|
| Inne nazwy | dziedziczna anosmia Kallmanna |
| Specjalność | Endokrynologia |
| Objawy | Brak lub opóźnione dojrzewanie płciowe , niepłodność , niemożność węchu |
| Komplikacje | Osteoporoza |
| Zwykły początek | Obecny przy urodzeniu |
| Czas trwania | Trwający całe życie |
| Leczenie |
Hormonalna terapia zastępcza gonadotropina terapia |
| Częstotliwość | 1:30 000 (mężczyźni), 1:125 000 (kobiety) |
Zespół Kallmanna ( KS ) jest zaburzeniem genetycznym , które uniemożliwia osobie rozpoczęcie lub całkowite zakończenie dojrzewania . Zespół Kallmanna jest formą grupy schorzeń określanych jako hipogonadyzm hipogonadotropowy . Aby odróżnić go od innych postaci hipogonadyzmu hipogonadotropowego, zespół Kallmanna ma dodatkowy objaw całkowitego braku węchu (anosmia) lub zmniejszonego węchu . Nieleczone osoby będą miały słabo określone drugorzędowe cechy płciowe , będą wykazywać oznaki hipogonadyzmu , prawie zawsze będą bezpłodne i będą narażeni na zwiększone ryzyko rozwoju osteoporozy . Może również wystąpić szereg innych fizycznych objawów wpływających na twarz, dłonie i układ kostny.
Podstawową przyczyną jest nieprawidłowa produkcja lub aktywność hormonu uwalniającego gonadotropiny przez podwzgórze . Powoduje to niski poziom hormonów płciowych testosteronu u mężczyzn lub estrogenu i progesteronu u kobiet. Diagnoza zwykle pojawia się w wieku młodzieńczym, kiedy dojrzewanie nie zaczyna się.
Zwykle wymagane jest leczenie przez całe życie dla obu płci. Hormonalna terapia zastępcza (HTZ) jest główną formą leczenia mającą na celu uzupełnienie brakującego testosteronu lub estrogenu i progesteronu. Dostępne są również specjalistyczne zabiegi niepłodności.
Choroba jest częściej diagnozowana u mężczyzn niż u kobiet. Badanie populacji fińskiej z 2011 roku dało szacunkową częstość występowania 1 na 48 000 osób ogółem, z 1 na 30 000 dla mężczyzn i 1 na 125 000 dla kobiet. Zespół Kallmanna został po raz pierwszy opisany imiennie w artykule opublikowanym w 1944 roku przez Franza Josefa Kallmanna , niemiecko - amerykańskiego genetyka . Związek między anosmią a hipogonadyzmem został już zauważony przez hiszpańskiego lekarza Aureliano Maestre de San Juan w 1856 roku.
Symptomy i objawy

Zwykle trudno jest odróżnić przypadek zespołu Kallmanna (KS)/hipogonadyzmu hipogonadotropowego (HH) od prostego konstytucyjnego opóźnienia dojrzewania . Jeśli jednak dojrzewanie nie rozpoczęło się w wieku 14 (dziewczynki) lub 15 (chłopcy) i występuje co najmniej jedna z niżej wymienionych cech niezwiązanych z reprodukcją, wskazane może być skierowanie do endokrynologa reprodukcyjnego .
Cechy KS i innych form HH można podzielić na dwie różne kategorie; „reprodukcyjny” i „niereprodukcyjny”.
Cechy rozrodcze
- Brak rozpoczęcia lub pełnego dojrzewania.
- Brak rozwoju jąder u mężczyzn (rozmiar < 4 ml, przy normalnym zakresie od 12 do 25 ml).
- Pierwotny brak miesiączki (brak rozpoczęcia miesiączki ).
- Słabo zdefiniowane drugorzędowe cechy płciowe.
- Micropenis w 5-10% przypadków mężczyzn.
- Wnętrostwo (niezstąpione jądra) po urodzeniu.
- Niski poziom gonadotropin LH i FSH .
- Hipogonadyzm spowodowany niskim poziomem testosteronu u mężczyzn lub estrogenu / progesteronu u kobiet.
- Niepłodność .
Cechy nierozrodcze
- Całkowity brak węchu ( anosmia ) lub wyraźnie osłabiony zmysł węchu (hiposmia). Jest to cecha charakterystyczna zespołu Kallmanna; nie występuje w innych przypadkach HH. Około 50% przypadków HH występuje z anosmią i można je określić jako zespół Kallmanna.
- Rozszczep podniebienia , rozszczep wargi lub inne wady twarzoczaszki w linii środkowej.
- Uszkodzenie słuchu nerwowego
- Brak jednej z nerek (jednostronna agenezja nerek)
- Wady szkieletu, w tym rozdwojenie dłoni/stopy ( ektrodaktylia ), skrócony palec środkowy (śródręcza) lub skolioza
- Synkineza manualna (lustrzane ruchy rąk)
- Brakujące zęby (hipodoncja)
- Słaba równowaga lub koordynacja z powodu ataksji mózgowej .
- Wady oka, takie jak coloboma lub opadanie powiek .
- Zwiększona częstość występowania daltonizmu
Dokładny charakter genetyczny każdego konkretnego przypadku KS/HH określi, które z cech nierozrodczych wystąpią. Nasilenie objawów będzie się również różnić w zależności od przypadku. Nawet członkowie rodziny nie będą wykazywać tego samego zakresu lub nasilenia objawów.
KS/HH jest najczęściej obecny od urodzenia, ale wersje w wieku dorosłym występują zarówno u mężczyzn, jak iu kobiet. Podwzgórze-przysadka-gonady oś (oś HPG) funkcjonuje normalnie przy urodzeniu i dobrze w dorosłym życiu, dając normalne dojrzewanie i normalną funkcję reprodukcyjną. Oś HPG albo całkowicie zawodzi, albo zostaje zredukowana do bardzo niskiego poziomu uwalniania GnRH w dorosłym życiu bez oczywistej przyczyny (np. guz przysadki). Doprowadzi to do spadku poziomu testosteronu lub estrogenu i niepłodności.
Funkcjonalny brak miesiączki podwzgórza obserwuje się u kobiet, u których oś HPG jest tłumiona w odpowiedzi na stres fizyczny lub psychiczny lub niedożywienie, ale ustępuje po usunięciu stresora.
Niektóre przypadki KS/HH wydają się odwracać w dorosłym życiu, kiedy oś HPG powraca do normalnej funkcji, a poziomy GnRH, LH i FSH wracają do normalnego poziomu. Dzieje się tak u około 10 do 22% osób, głównie w przypadku normosmicznych przypadków CHH, a nie przypadków KS i występuje tylko u osób, które przeszły jakąś formę terapii zastępczej testosteronem. Zwykle stwierdza się to tylko wtedy, gdy zwiększa się objętość jąder podczas leczenia samym testosteronem, a poziom testosteronu wraca do normy po zatrzymaniu leczenia. Ten typ KS/HH rzadko występuje w przypadkach, w których mężczyźni mieli historię niezstąpionych jąder.
Osoby dotknięte KS i innymi postaciami HH prawie zawsze rodzą się z prawidłowym zróżnicowaniem płciowym; tj. fizycznie są mężczyznami lub kobietami. Wynika to z ludzkiej gonadotropiny kosmówkowej (hCG) wytwarzanej przez łożysko w około 12 do 20 tygodniu ciąży (ciąża), na którą zwykle nie ma wpływu KS lub CHH.
Osoby z KS/HH nie mają przypływu GnRH, LH i FSH, który normalnie występuje między narodzinami a szóstym miesiącem życia. Ten wzrost jest szczególnie ważny u niemowląt, ponieważ pomaga w zejściem jąder do moszny. Wzrost GnRH/LH/FSH u dzieci bez KS/HH daje wykrywalny poziom testosteronu u chłopców oraz estrogenu i progesteronu u dziewcząt. Brak tej fali może być czasem wykorzystany jako narzędzie diagnostyczne w przypadku podejrzenia KS/HH u nowonarodzonego chłopca, ale zwykle nie jest on wystarczająco wyraźny do rozpoznania u dziewczynek.
Osteoporoza
Jednym z możliwych skutków ubocznych KS/CHH jest zwiększone ryzyko rozwoju wtórnej osteoporozy lub osteopenii . Estrogen (kobiety) lub testosteron (mężczyźni) są niezbędne do utrzymania gęstości kości . Niedobór testosteronu lub estrogenu może zwiększyć tempo resorpcji kości, jednocześnie spowalniając tempo tworzenia kości . Ogólnie może to prowadzić do osłabienia, kruchości kości, które mają większą skłonność do złamań.
Nawet krótki czas z niskim estrogenem lub testosteronem, jak w przypadku opóźnionej diagnozy KS/CHH, może prowadzić do zwiększonego ryzyka rozwoju osteoporozy, ale inne czynniki ryzyka, takie jak palenie, są zaangażowane, więc ryzyko rozwoju będzie się różnić w zależności od osoby. osoba. Skany gęstości kości są zalecane w celu monitorowania gęstości mineralnej kości.
Skan gęstości kości jest znany jako skan absorpcjometrii rentgenowskiej o podwójnej energii (skan DEXA lub DXA). Jest to prosty test, którego wykonanie zajmuje mniej niż 15 minut. Polega na wykonaniu specjalistycznego zdjęcia rentgenowskiego kręgosłupa i bioder oraz pomiarze gęstości mineralnej kości i porównaniu wyniku ze średnią wartością dla młodej zdrowej osoby dorosłej w populacji ogólnej.
Odpowiednie poziomy wapnia i prawdopodobnie, co ważniejsze, poziom witaminy D są niezbędne dla zdrowej gęstości kości. Niektóre osoby z KS/CHH będą miały sprawdzany poziom i mogą otrzymać dodatkowe tabletki lub zastrzyki witaminy D, aby zapobiec pogorszeniu się stanu. Rola witaminy D dla ogólnego stanu zdrowia jest obecnie pod ścisłą kontrolą, a niektórzy badacze twierdzą, że niedobór witaminy D jest powszechny w wielu populacjach i może być powiązany z innymi chorobami.
Niektórym osobom z ciężką osteoporozą , oprócz hormonalnej terapii zastępczej, można przepisać bisfosfoniany w celu zachowania masy kostnej.
Genetyka
Do tej pory co najmniej 25 różnych genów było zaangażowanych w wywoływanie zespołu Kallmanna lub innych form hipogonadyzmu hipogonadotropowego poprzez zakłócenie produkcji lub aktywności GnRH (37). Zaangażowane geny obejmują wszystkie formy dziedziczenia i nie wykazano, aby żaden defekt genu był wspólny dla wszystkich przypadków, co utrudnia testowanie genetyczne i przewidywanie dziedziczenia.
Liczba genów, o których wiadomo, że powodują przypadki KS/CHH, wciąż rośnie. Ponadto uważa się, że niektóre przypadki KS/CHH są spowodowane przez dwa oddzielne defekty genów występujące w tym samym czasie.
Poszczególne defekty genów mogą być związane z określonymi objawami, które mogą pomóc w określeniu, które geny należy przetestować. 35-45% przypadków KS/CHH ma nieznaną przyczynę genetyczną.
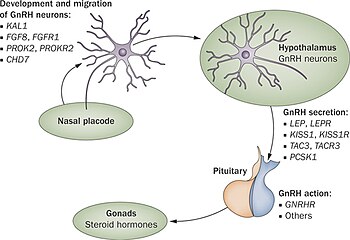
ANOS1 gen defektami (poprzednio znany jako KAL-1) jako pierwszy odkryta i jeden najczęściej pod kątem. To powoduje, że x-linked postać zespołu Kallmann i wiąże się z dodatkowymi objawami węchu , dwuręcznego synkinesis i agenezji nerek . Uważa się, że ta wada jest odpowiedzialna za od 5 do 10% wszystkich przypadków zespołu Kallmanna/CHH.
Patofizjologia

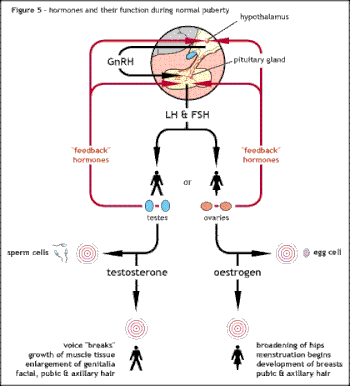
Podstawową przyczyną zespołu Kallmanna lub innych postaci hipogonadyzmu hipogonadotropowego jest nieprawidłowe działanie hormonu podwzgórza GnRH . Termin izolowany niedobór GnRH (IGD) jest coraz częściej używany do opisu tej grupy schorzeń, ponieważ podkreśla pierwotną przyczynę tych schorzeń i odróżnia je od innych schorzeń, takich jak zespół Klinefeltera lub zespół Turnera, które mają podobne objawy, ale mają inną etiologię . Termin hipogonadyzm opisuje niski poziom krążących hormonów płciowych ; testosteron u mężczyzn oraz estrogen i progesteron u kobiet. Hipogonadyzm może wystąpić poprzez szereg różnych mechanizmów. Użycie terminu hipogonadotropowy odnosi się do faktu, że hipogonadyzm występujący w HH jest spowodowany zakłóceniem produkcji hormonów gonadotropowych normalnie uwalnianych przez przedni gruczoł przysadki, znanych jako hormon luteinizujący (LH) i hormon folikulotropowy (FSH). Niepowodzenie w aktywności GnRH może być w inny sposób spowodowane brakiem neuronów uwalniających GnRH wewnątrz podwzgórza. HH może występować jako stan izolowany, w którym ma wpływ tylko na produkcję LH i FSH lub może wystąpić w stanach połączonego niedoboru przysadki.
W pierwszych 10 tygodniach prawidłowego rozwoju embrionalnego neurony uwalniające GnRH migrują z pierwotnego źródła w okolicy nosa i trafiają do podwzgórza. Te neurony powstają w obszarze rozwijającej się głowy, plakodzie węchowym , który daje początek nabłonkowi węchowemu ; następnie przechodzą przez płytkę sitowatą wraz z włóknami nerwów węchowych do przodomózgowia rostralnego . Stamtąd migrują do tego, co stanie się podwzgórzem. Wszelkie problemy z rozwojem włókien nerwu węchowego uniemożliwią progresję neuronów uwalniających GnRH w kierunku mózgu.
Diagnoza
Rozpoznanie KS i innych postaci CHH komplikuje trudność w rozróżnieniu między normalnym konstytucyjnym opóźnieniem dojrzewania a przypadkiem KS/CHH. Diagnoza jest często jednym z wykluczeń stwierdzonych podczas badania opóźnionego dojrzewania .
U mężczyzn stosowanie odpowiedniego dla wieku poziomu testosteronu może pomóc odróżnić przypadek KS/CHH od przypadku opóźnionego dojrzewania. Jeśli nie widać pokwitania, zwłaszcza rozwoju jąder, wówczas wskazane może być zbadanie przez endokrynologa reprodukcyjnego. Jeżeli po osiągnięciu wieku 16 lat dojrzewanie nie jest widoczne, należy skierować osobę na badanie endokrynologiczne. Poporodowe rozpoznanie KS/CHH przed ukończeniem 6. miesiąca życia jest czasami możliwe, ponieważ u dzieci z KS/CHH nie występuje normalny pourodzeniowy wzrost hormonów gonadotropin wraz z testosteronem lub estrogenem. Ten brak wykrywalnych hormonów we krwi może być wykorzystany jako wskaźnik diagnostyczny, zwłaszcza u niemowląt płci męskiej.
U kobiet diagnoza jest czasami jeszcze bardziej opóźniona, ponieważ inne przyczyny braku miesiączki zwykle muszą być najpierw zbadane przed rozważeniem przypadku KS/CHH.
Rozpoznanie normy KS/CHH obejmuje szereg testów klinicznych, biochemicznych i radiologicznych w celu wykluczenia innych stanów, które mogą powodować podobne objawy.
Testy kliniczne
- Porównanie wzrostu do standardowych siatek wzrostu.
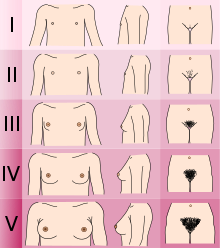
- Określenie etapu Tanner rozwoju seksualnego. (Mężczyźni z KS/CHH są zwykle w stadium I lub II z genitaliami, kobiety w stadium I z rozwojem piersi, a mężczyźni i kobiety w stadium III z rozwojem włosów łonowych).
- Sprawdzanie mikropenisa i niezstąpionych jąder ( wnętrostwo ) u mężczyzn.
- Pomiar objętości jąder.
- Sprawdzanie rozwoju piersi i wieku w momencie pierwszej miesiączki u kobiet.
- Sprawdzanie węchu za pomocą panelu zapachowego lub testu identyfikacji zapachu Uniwersytetu Pensylwanii (UPSIT)
- Sprawdzenie uszkodzenia słuchu.
- Sprawdzanie braków zębowych lub obecności rozszczepu wargi i/lub podniebienia .
- Sprawdzanie pigmentacji skóry i włosów.
- Sprawdzanie ruchów lustrzanych rąk lub oznak opóźnienia neurorozwojowego .
Testy laboratoryjne
- Testy hormonalne we wczesnych godzinach porannych, w tym FSH , LH , testosteron , estrogen i prolaktyna .
- Test stymulacji GnRH i/lub hCG w celu określenia aktywności podwzgórza i przysadki .
- Test nasienia
- Czynność wątroby , czynność nerek i badanie markerów stanu zapalnego .
- Kariotyp w celu sprawdzenia nieprawidłowości chromosomalnych.
Obrazowanie medyczne
- Wykonywanie prześwietlenia nadgarstka w celu określenia wieku kostnego.
- MRI mózgu w celu wykluczenia wszelkich nieprawidłowości strukturalnych w podwzgórzu lub przysadce oraz w celu sprawdzenia obecności opuszek węchowych .
- USG nerek w celu wykluczenia jednostronnej agenezji nerek .
- Skan gęstości kości ( DXA ) w celu sprawdzenia osteoporozy lub osteopenii .
Leczenie
Zarówno w przypadku mężczyzn, jak i kobiet, początkowym celem leczenia jest rozwój drugorzędowych cech płciowych zwykle obserwowanych w okresie dojrzewania. Gdy to zostanie osiągnięte, konieczna jest ciągła hormonalna terapia zastępcza zarówno dla mężczyzn, jak i kobiet w celu utrzymania funkcji seksualnych, zdrowia kości, libido i ogólnego dobrego samopoczucia. U mężczyzn terapia zastępcza testosteronem jest wymagana do utrzymania prawidłowej masy mięśniowej.
Czasami konieczne jest wczesne leczenie u niemowląt płci męskiej z podejrzeniem KS/CHH w celu skorygowania niezstąpionych jąder i mikropenisa, jeśli są obecne, przy użyciu lub zabiegu chirurgicznym lub gonadotropiną lub leczeniem DHT . Kobiety z KS/CHH zwykle nie wymagają żadnego leczenia przed okresem dojrzewania. Obecnie nie istnieją żadne zabiegi na brak węchu, lustrzane ruchy rąk czy brak jednej nerki.
Leczenie zarówno mężczyzn, jak i kobiet z KS/CHH zwykle składa się z jednej z trzech opcji, które można zastosować zarówno w hormonalnej terapii zastępczej, jak i/lub leczeniu niepłodności.
- Zastąpienie hormonów płciowych (testosteron lub estrogen i progesteron).
- Terapia gonadotropinami (leki naśladujące aktywność FSH i LH).
- Terapia pulsacyjna GnRH.
Hormonalna terapia zastępcza
Metoda i dawka leczenia będą się różnić w zależności od leczonej osoby. U młodszych pacjentów leczenie początkowe zwykle przeprowadza się mniejszymi dawkami w celu rozwinięcia drugorzędowych cech płciowych przed osiągnięciem dawek dorosłych.
W przypadku mężczyzn z KS/CHH rodzaje dostarczania testosteronu obejmują codzienne plastry, codzienne stosowanie żelu, codzienne kapsułki, zastrzyki podskórne lub domięśniowe lub implanty co sześć miesięcy. Stosowane są różne preparaty testosteronu, aby zapewnić zarówno anaboliczne, jak i androgenne działanie testosteronu. Opracowano donosowe metody dostarczania testosteronu, ale ich zastosowanie w leczeniu KS/CHH nie zostało formalnie ocenione.
Terapia gonadotropinami w postaci wstrzyknięć ludzkiej gonadotropiny kosmówkowej (hCG), z zastosowaniem FSH lub bez, może być również stosowana u pacjentów płci męskiej w celu wywołania rozwoju drugorzędowych cech płciowych wraz z możliwą indukcją płodności.
W przypadku kobiet zastępowanie hormonów obejmuje stosowanie estrogenu i progesteronu. Najpierw stosuje się estrogen w formie tabletek lub żelu w celu maksymalizacji rozwoju piersi, następnie stosuje się kombinację estrogenu i progesteronu. Cykliczny progesteron jest zwykle wymagany do utrzymania zdrowego endometrium (wyściółki macicy ).
U mężczyzn monitorowanie leczenia zwykle wymaga pomiaru testosteronu w surowicy, inhibiny B , hematokrytu i antygenu specyficznego dla prostaty (PSA). Jeśli stosuje się zastrzyki, przyjmuje się poziomy minimalne, aby zapewnić odpowiedni poziom testosteronu w całym cyklu iniekcji.
U kobiet monitorowanie zwykle polega na pomiarze estrogenów, FSH, LH, inhibiny B i hormonu antymüllerowskiego (AMH).
Standardowa hormonalna terapia zastępcza normalnie nie wywołuje płodności ani u mężczyzn, ani u kobiet, bez wzrostu jąder u mężczyzn. Wczesne leczenie w wieku młodzieńczym może pomóc w utrzymaniu dobrego samopoczucia psychicznego osób z KS/CHH.
Zabiegi na płodność
Terapia gonadotropinami może być stosowana zarówno u pacjentów płci męskiej, jak i żeńskiej w celu uzyskania płodności u niektórych osób.
Terapia pulsacyjna GnRH może być również stosowana w celu wywołania płodności, zwłaszcza u kobiet, ale jej zastosowanie ogranicza się do kilku specjalistycznych ośrodków leczniczych.
U mężczyzn z KS/CHH niepłodność wynika przede wszystkim z braku produkcji plemników w jądrach . Wytwarzanie plemników można osiągnąć zarówno poprzez zastosowanie GnRH podawanego za pomocą pompy mikroinfuzyjnej, jak i poprzez iniekcje gonadotropin ( hCG , FSH, hMG ). Czas potrzebny do osiągnięcia odpowiedniej produkcji nasienia do naturalnego poczęcia będzie różny w zależności od osoby. Jeśli jądra przed leczeniem są bardzo małe i w przeszłości występowały niezstąpione jądra, produkcja nasienia może zająć więcej czasu. W takich przypadkach może być wymagana technologia wspomaganego rozrodu , taka jak pobieranie nasienia za pomocą ekstrakcji nasienia jądra (TESE) i/lub docytoplazmatycznego wstrzyknięcia nasienia (ICSI).
U samic z KS/CHH niepłodność wynika przede wszystkim z braku dojrzewania komórek jajowych znajdujących się w jajnikach . Indukcję owulacji można osiągnąć za pomocą pulsacyjnej terapii GnRH lub alternatywnie za pomocą wstrzyknięć gonadotropiny (hCG, FSH, hMG) podawanych w określonych odstępach czasu w celu wywołania dojrzewania i uwolnienia komórki jajowej w celu naturalnego poczęcia.
Rokowanie
Odwrócenie objawów odnotowano w 10-22% przypadków.
Przypadki odwrócenia zaobserwowano zarówno w KS, jak i normosmicznym CHH, ale wydają się być mniej powszechne w przypadkach KS (gdzie wpływa również na węch). Odwrócenie nie zawsze jest trwałe, a dokładne przyczyny genetyczne nie są jeszcze w pełni poznane.
Epidemiologia
Epidemiologia zespołu Kallmanna nie jest dobrze poznana. Poszczególne badania obejmują raport z 1986 roku analizujący dokumentację medyczną armii Sardynii, w którym stwierdzono występowanie 1 na 86 000 mężczyzn oraz raport z Finlandii z 2011 roku, w którym stwierdzono występowanie 1: 30 000 dla mężczyzn i 1: 125 000 dla kobiet.
Zespół Kallmanna występuje około 4 razy częściej u mężczyzn niż u kobiet, ale tylko 2,5 razy częściej u mężczyzn w przypadkach rodzinnych.
Historia

Zespół Kallmanna został po raz pierwszy opisany z imienia i nazwiska w artykule opublikowanym w 1944 roku przez Franza Josefa Kallmanna , niemiecko - amerykańskiego genetyka . Związek między anosmią a hipogonadyzmem został już zauważony przez hiszpańskiego lekarza Aureliano Maestre de San Juan w 1856 roku. W latach pięćdziesiątych De Morsier i Gauthier donieśli o częściowym lub całkowitym braku opuszki węchowej w mózgach mężczyzn z hipogonadyzmem.
Terminologia
Terminologia używana przy opisywaniu przypadków HH jest różna i może obejmować:{
- Niedobór GnRH
- wrodzony hipogonadyzm hipogonadotropowy (CHH)
- idiopatyczny/ izolowany hipogonadyzm hipogonadotropowy (IHH)
- hipogonadyzm hipogonadotropowy normosmiczny (nHH)
- hipogonadyzm podwzgórza
- zespół olfakto-genitalny
Badania
Kisspeptyna jest białkiem regulującym uwalnianie GnRH z podwzgórza, co z kolei reguluje uwalnianie LH i w mniejszym stopniu FSH z przedniego płata przysadki mózgowej. Wiadomo, że Kisspeptyna i związany z nią receptor KISS1R biorą udział w regulacji dojrzewania. Badania wykazały, że kisspeptyna może być stosowana w diagnostyce i leczeniu niektórych przypadków zespołu Kallmanna i CHH.
Bibliografia
Zewnętrzne linki
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |