kanał wapniowy typu L - L-type calcium channel
| Kanał wapniowy, zależny od napięcia | |
|---|---|
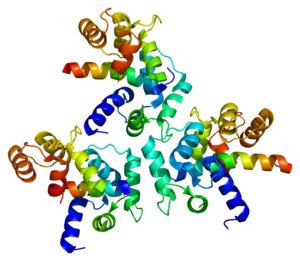 Struktura krystalograficzna
| |
| Identyfikatory | |
| Symbol | Kanał wapniowy, zależny od napięcia |

Kanały wapniowe typu L (znany również jako kanał dihydropirydyny lub kanału DHP ) jest częścią wysokiego napięcia aktywnego rodu napięciowo-zależny kanał wapniowy . „L” oznacza „długotrwałość” w odniesieniu do długości aktywacji. Ten kanał ma cztery podjednostki ( Cav1.1 , Cav1.2 , Cav1.3 , Cav1.4 ).
Kanały wapniowe typu L są odpowiedzialne za excitation- skurczu sprzęgania szkieletowych , gładkich , mięśnia sercowego , i aldosteronu wydzielanie w komórkach endokrynnych z kory nadnerczy . Znajdują się również w neuronach, a za pomocą kanałów wapniowych typu L w komórkach endokrynnych regulują neurohormony i neuroprzekaźniki . Zaobserwowano również, że odgrywają one rolę w ekspresji genów, stabilności mRNA, przeżyciu neuronów, uszkodzeniu aksonów wywołanym niedokrwieniem, skuteczności synaptycznej oraz aktywacji i dezaktywacji innych kanałów jonowych.
W miocytach sercowych kanał wapniowy typu L przechodzi do wewnątrz prądu Ca2 + i wyzwala uwalnianie wapnia z retikulum sarkoplazmatycznego poprzez aktywację receptora rianodyny 2 (RyR2) (uwalnianie wapnia indukowane wapniem). Fosforylacja tych kanałów zwiększa ich przepuszczalność dla wapnia i zwiększa kurczliwość odpowiednich miocytów sercowych.
Blokery kanału wapniowego typu L są stosowane jako antyarytmiczne lub przeciwnadciśnieniowe leki na serce , w zależności od tego, czy leki mają większe powinowactwo do serca ( fenyloalkiloaminy , jak werapamil ) czy naczyń krwionośnych ( dihydropirydyny , jak nifedypina ).
W mięśniach szkieletowych, jest bardzo wysokie stężenie kanałów wapniowych typu L, znajduje się w T-kanalików . Depolaryzacja mięśni skutkuje dużymi prądami bramkowania, ale anomalnie niskim strumieniem wapnia, co teraz tłumaczy się bardzo powolną aktywacją prądów jonowych. Z tego powodu niewiele lub wcale Ca 2+ przechodzi przez błonę rurki T podczas pojedynczego potencjału czynnościowego.
Historia
W 1953 Paul Fatt i Bernard Katz odkryli w mięśniu skorupiaka kanały wapniowe bramkowane napięciem. Kanały wykazywały różne napięcia aktywacji i właściwości przewodzenia wapnia, a zatem zostały rozdzielone na kanały aktywacji wysokiego napięcia (HVA) i kanały aktywacji niskiego napięcia (LVA). Po dalszych eksperymentach stwierdzono, że kanały HVA otwierają się na 1,4-dihydropirydynę ( DHP ). Korzystanie DHP, okazało się, że kanały HVA były specyficzne dla pewnych tkankach i poddaje reakcji w różny sposób, co prowadzi do dalszej klasyfikacji kanałów HVA w L-typu, typu P i N typu . Kanały wapniowe typu L zostały zsekwencjonowane peptydowo i stwierdzono, że istnieją 4 rodzaje kanałów wapniowych typu L: α 1 S (mięśnie szkieletowe), α 1 C (sercowe), α 1 D (znajdujące się w mózgu) i α 1 F (znajduje się w siatkówce). W 2000 roku, po przeprowadzeniu dalszych badań nad podjednostkami α 1 w kanałach wapniowych bramkowanych napięciem, zastosowano nową nomenklaturę, która nazwała kanały wapniowe typu L CaV1, a jej podjednostki nazwano CaV1.1 , Cav1.2 , CaV1.3 i CaV1.4 . Badania nad podjednostkami CaV1 dostarczają coraz więcej informacji na temat ich budowy, funkcji i zastosowań farmaceutycznych.
Struktura
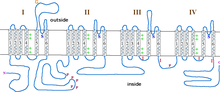
Kanały wapniowe typu L zawierają 5 różnych podjednostek, podjednostki α1 (170-240 kDa), α2 (150 kDa), δ (17-25 kDa), β (50-78 kDa) i γ (32 kDa). Podjednostki α2, δ i β są niekowalencyjnie związane z podjednostką α1 i modulują ruch jonów oraz właściwości biofizyczne podjednostki α1. Podjednostki α2 i δ znajdują się w przestrzeni zewnątrzkomórkowej, a podjednostki β i γ w przestrzeni cytozolowej.
Podjednostka α1 jest heterotetramerem, który ma cztery regiony przezbłonowe , znane jako Domeny I-IV, które przechodzą przez osocze sześć razy jako α-helisy , nazywane S0-S6 (S0 i S1 razem przechodzą przez błonę raz). Podjednostka α1 jako całość zawiera domenę wykrywania napięcia, por przewodzący i aparat bramkujący. Jak większość kanałów jonowych bramkowanych napięciem , podjednostka α składa się z 4 podjednostek. Każda podjednostka składa się z 6 alfa-helikalnych, transbłonowych domen, które przecinają błonę (ponumerowane S1-S6). Podjednostki S1-S4 tworzą czujnik napięcia, a podjednostki S5-S6 tworzą filtr selektywności. Aby wyczuć napięcie komórki, helisy S1-S3 zawierają wiele ujemnie naładowanych aminokwasów aminokwasów, podczas gdy helisy S4 zawierają głównie aminokwasy naładowane dodatnio z pętlą P łączącą helisy S4 z S5. Po domenach S1-6 występuje sześć domen C, które składają się z dwóch motywów ręki EF (C1-2 i C3-4) oraz domeny Pre-IQ (C5) i domeny IQ (C6). Na N-końcu znajdują się również dwa motywy ręki EF. Zarówno koniec N, jak i C znajdują się w przestrzeni cytozolowej, przy czym koniec C jest znacznie dłuższy niż koniec N.
Wiadomo, że podjednostka β ma cztery izoformy (β1-β4) regulujące funkcje kanału i jest połączona z α1 przez łącznik α1 I i II w cytozolu w kieszeni wiążącej β α1 (ABP). Każda izoforma zawiera domenę homologii src 3 (SH3) i domenę kinazy guanylanowej (GK), które są oddzielone domeną HOOK i trzema regionami nieustrukturyzowanymi.
Podjednostki α2 i δ są połączone ze sobą wiązaniami dwusiarczkowymi (czasami znanymi jako podjednostka α2δ) i oddziałują z α1. mają cztery znane izoformy zwane α2δ-1 do α2δ-2 i zawierają domenę A von Willebranda (VWA) i domenę Cache . Region α2 znajduje się w przestrzeni pozakomórkowej, podczas gdy region δ znajduje się w błonie komórkowej i zaobserwowano, że jest zakotwiczony za pomocą kotwicy glikozylofosfatydyloinozytolu (GPI).
Podjednostka γ ma osiem izoform (γ1-γ8) i jest połączona z podjednostką α1 i została znaleziona tylko w komórkach mięśniowych w kanałach CaV1.1 i CaV1.2. Niewiele wiadomo o podjednostce γ, ale powiązano ją z oddziaływaniami sił hydrofobowych.
Mechanizm
Otwarcie porów w kanałach wapniowych typu L następuje w podjednostce α1. Kiedy błona ulega depolaryzacji, helisa S4 przemieszcza się przez łączniki S4 i S5 do cytoplazmatycznych końców helis S5 i S6. Otwiera to bramkę aktywacyjną utworzoną przez wewnętrzną stronę helis S6 w podjednostce α1.
Najbardziej dominującym sposobem autoinhibicji kanałów wapniowych typu L jest kompleks Ca2 + /Cam. Gdy pory otwierają się i powodują napływ wapnia, wapń wiąże się z kalmoduliną, a następnie oddziałuje z pętlą, która łączy sąsiednie motywy ręki EF i powoduje zmianę konformacyjną w motywie ręki EF, dzięki czemu oddziałuje z porem, powodując szybkie hamowanie w kanale. Nadal trwa debata na temat tego, gdzie i jak oddziałują pory i ręka EF. Kieszenie hydrofobowe w kompleksie Ca2 + /Cam będą również wiązać się z trzema sekcjami domeny IQ, znanymi jako „kotwice aromatyczne”. Kompleks Ca 2+ /Cam ma wysokie powinowactwo do kanałów wapniowych typu L, co pozwala na jego zablokowanie nawet wtedy, gdy w komórce jest niewielka ilość wapnia. Porów ostatecznie zamyka się, gdy komórka repolaryzuje się i powoduje zmianę konformacyjną w kanale, aby wprowadzić ją w konformację zamkniętą.
Hamowanie i modulacja
Jedną z najbardziej rozpoznawalnych cech kanału wapniowego typu L jest jego wyjątkowa wrażliwość na 1,4-dihydropirydyny (DHP) . W przeciwieństwie do innych kanałów wapniowych bramkowanych napięciem, kanały wapniowe typu L są oporne na leki hamujące -CT X (GVIA) i ⍵-AG A (IVA).
Dobrze obserwowana forma modulacji wynika z alternatywnego splicingu . Powszechną formą modulacji ze splicingu alternatywnego jest modulator C-końcowy (CTM). Ma dodatnio naładowaną α-helisę na C-końcu zwaną DCRD i ujemnie naładowaną helisę tuż za motywem IQ (miejsce oddziaływania CaM) zwaną PCRD. Dwie helisy mogą tworzyć strukturę, która wiąże się konkurencyjnie z CaM, aby zmniejszyć prawdopodobieństwo stanu otwartego i obniżyć hamowanie zależne od wapnia (CDI).
Alternatywny splicing jest również obserwowany na podjednostkach β w celu stworzenia różnych izoform w celu nadania kanałom różnych właściwości dzięki palmitoilacji i edycji RNA . Inne formy modulacji podjednostki β obejmują zwiększanie lub zmniejszanie ekspresji podjednostki. Wynika to z faktu, że podjednostki β zwiększają prawdopodobieństwo otwarcia kanału, aktywność w błonie komórkowej i antagonizują ubikwitynację kanału.
Kanały wapniowe typu L są również modulowane przez receptory sprzężone z białkiem G i adrenergiczny układ nerwowy . Kinaza białkowa A (PKA) aktywowana przez kaskadę receptorów sprzężonych z białkiem G może fosforylować kanały wapniowe typu L, po utworzeniu przez kanały kompleksu sygnalizacyjnego z białkami zakotwiczającymi kinazę A (AKAP) , aby zwiększyć prąd wapnia przez kanał, zwiększając prawdopodobieństwo stanu otwartego i przyspieszony okres rekonwalescencji. Aktywowana fosfolipaza C (PLC) z receptorów sprzężonych z białkiem G może rozkładać polifosfoinozytydy, zmniejszając prąd wapniowy kanałów o 20%-30%.
Zaobserwowano, że adrenergiczny układ nerwowy moduluje kanały wapniowe typu L poprzez rozszczepianie fragmentu C-końcowego, gdy receptor β-adrenergiczny jest stymulowany w celu zwiększenia aktywacji kanałów.
Geny
Zobacz też
Bibliografia
Dalsza lektura
- Takahashi K, Hayashi S, Miyajima M, Omori M, Wang J, Kaihara K i in. (maj 2019). „Kanał wapniowy typu L moduluje mechanowrażliwość linii komórkowej kardiomiocytów H9c2” . Wapń w komórce . 79 : 68–74. doi : 10.1016/j.ceca.2019.02.008 . PMID 30836292 .
Ten artykuł zawiera tekst z Narodowej Biblioteki Medycznej Stanów Zjednoczonych , która jest własnością publiczną .
Linki zewnętrzne
- „Kanały wapniowe bramkowane napięciem” . Baza danych receptorów i kanałów jonowych IUPHAR . Międzynarodowa Unia Farmakologii Podstawowej i Klinicznej.
- L-Type+Calciu+Channel w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)