Luminol - Luminol
|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
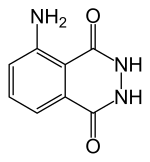
5-Amino-2,3-dihydroftalazyno-1,4-dion |
|
| Inne nazwy
5-amino-2,3-dihydro-1,4-ftalazynodion
o- aminoftaloilohydrazyd o- aminoftalilohydrazyd 3-aminoftalhydrazyd 3-aminoftalohydrazyd |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.007.556 |
| Numer WE | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 8 H 7 N 3 O 2 | |
| Masa cząsteczkowa | 177,16 g/mol |
| Temperatura topnienia | 319 ° C (606 ° F; 592 K) |
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | Karta charakterystyki dla luminolu |
| NFPA 704 (ognisty diament) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Luminol (C 8 H 7 N 3 O 2 ) jest substancją chemiczną, która po zmieszaniu z odpowiednim utleniaczem wykazuje chemiluminescencję z niebieską poświatą . Luminol jest krystalicznym ciałem stałym o barwie białej do bladożółtej, rozpuszczalnym w większości polarnych rozpuszczalników organicznych, ale nierozpuszczalnym w wodzie.
Śledczy medycyny sądowej używają luminolu do wykrywania śladowych ilości krwi na miejscu przestępstwa , ponieważ reaguje on z żelazem zawartym w hemoglobinie . Biolodzy używają go w testach komórkowych do wykrywania miedzi , żelaza , cyjanków , a także specyficznych białek metodą Western blotting .
Kiedy luminol jest równomiernie rozpylany na danym obszarze, śladowe ilości aktywującego utleniacza powodują, że luminol emituje niebieską poświatę, którą można zobaczyć w zaciemnionym pomieszczeniu. Blask trwa tylko około 30 sekund, ale można go udokumentować fotograficznie. Blask jest silniejszy w miejscach, w których jest więcej rozpylonej cieczy; intensywność blasku nie wskazuje na ilość krwi lub innego obecnego aktywatora.
Synteza
Luminol jest syntetyzowany w dwuetapowym procesie, rozpoczynającym się od kwasu 3- nitroftalowego . Najpierw hydrazyny (N 2 H 4 ) ogrzewa się z kwasu 3-nitroftalowego w wysokowrzącym rozpuszczalniku, takim jak trój glikol i glicerol . Acylową podstawienie reakcja kondensacji następuje z utratą wody, tworząc 3-nitrophthalhydrazide. Redukcja grupy nitrowej do grupy aminowej za pomocą ditionianu sodu (Na 2 S 2 O 4 ), poprzez przejściową hydroksyloaminę , prowadzi do powstania luminolu.
Związek został po raz pierwszy zsyntetyzowany w Niemczech w 1902 roku, ale nie został nazwany „luminolem” aż do 1934 roku.
Chemiluminescencja
Aby wykazać swoją luminescencję, luminol musi być aktywowany utleniaczem. Zazwyczaj aktywatorem jest roztwór zawierający w wodzie nadtlenek wodoru (H 2 O 2 ) i jony wodorotlenkowe . W obecności katalizatora, takiego jak związek żelaza lub nadjodanu , nadtlenek wodoru rozkłada się z wytworzeniem tlenu i wody:
- 2 H 2 O 2 → O 2 + 2 H 2 O
- H 2 O 2 + KIO 4 → KIO 3 + O 2 + H 2 O
Ustawienia laboratoryjne często wykorzystują jako katalizator żelazicyjanek potasu lub nadjodan potasu . W kryminalistycznym wykrywaniu krwi katalizatorem jest żelazo obecne w hemoglobinie . Enzymy w różnych układach biologicznych mogą również katalizować rozkład nadtlenku wodoru.
Dokładny mechanizm chemiluminescencji luminolu to złożona, wieloetapowa reakcja, zwłaszcza w warunkach wodnych. Ostatnie badania teoretyczne pozwoliły wyjaśnić kaskadę reakcji, jak pokazano poniżej. Luminol jest najpierw deprotonowany w warunkach zasadowych, a następnie utleniany do rodnika anionowego. Który z kolei ma dwie dostępne ścieżki do uzyskania kluczowego związku pośredniego α-hydroksynadtlenku. Po cyklizacji do endonadtlenku, monoanion ulegnie rozkładowi bez luminescencji, jeśli pH jest zbyt niskie (< 8,2) do drugiej deprotonacji. Jednak dianion endonadtlenkowy może dać produkt retro-Dielsa-Aldera: dianion 1,2-dioksano-3,6-dionu. A po chemiekscytacji przez dwa pojedyncze transfery elektronów (SET) daje dianion 3-aminoftalanu w swoim pierwszym singletowym stanie wzbudzonym (S1). Ta wysoce niestabilna cząsteczka relaksuje się do stanu podstawowego, emitując w ten sposób światło o długości fali około 425 nm (fioletowo-niebieskie), tzw. chemiluminescencję .
Wykorzystanie w dochodzeniu karnym
Historia
W 1928 r. niemiecki chemik HO Albrecht odkrył, że krew , między innymi, zwiększa luminescencję luminolu w alkalicznym roztworze nadtlenku wodoru. W 1936 roku Karl Gleu i Karl Pfannstiel potwierdzili to wzmocnienie w obecności hematyny , składnika krwi. W 1937 roku niemiecki naukowiec medycyny sądowej Walter Specht przeprowadził szeroko zakrojone badania nad zastosowaniem luminolu do wykrywania krwi na miejscach zbrodni. W 1939 roku patolodzy z San Francisco Frederick Proescher i AM Moody dokonali trzech ważnych obserwacji dotyczących luminolu:
- chociaż test jest przypuszczalny, duże obszary podejrzanego materiału można szybko zbadać;
- wysuszona i rozłożona krew dawała silniejszą i trwalszą reakcję niż krew świeża; oraz
- jeśli luminescencja zaniknie, można ją odtworzyć przez zastosowanie świeżego roztworu nadtlenku wodoru z luminolem; W ten sposób wysuszone plamy krwi mogą być wielokrotnie luminescencyjne.
Teoria
Śledczy na miejscu zbrodni używają luminolu, aby znaleźć ślady krwi, nawet jeśli ktoś ją wyczyścił lub usunął. Badacz rozpyla roztwór luminolu i utleniacza. Żelazo we krwi katalizuje luminescencję. Ilość katalizatora niezbędna do wywołania reakcji jest bardzo mała w stosunku do ilości luminolu, co pozwala na wykrycie nawet śladowych ilości krwi. Niebieska poświata utrzymuje się przez około 30 sekund na aplikację. Wykrycie blasku wymaga dość ciemnego pomieszczenia. Każdy blask wykrywane mogą być dokumentowane przez długi czas ekspozycji fotografii .
Wady
Zastosowanie Luminolu w dochodzeniu na miejscu zbrodni jest nieco utrudnione przez fakt, że reaguje on na związki zawierające żelazo i miedź , wybielacze , chrzan , mocz , kał lub pozostałości dymu. Nałożenie luminolu na dowód może uniemożliwić wykonanie na nim innych badań; jednak DNA zostało pomyślnie wyekstrahowane z próbek wystawionych na działanie luminolu.
Powiązane cząsteczki
- Luminol: 5-amino-2,3-dihydro-1,4-ftalazynodion; 3-aminoftalhydrazyd; 1,4-ftalazynodion, 5-amino-2,3-dihydro; CAS: [521-31-3]
C 8 H 7 N 3 O 2 – MW: 177,16
λ abs (w 0,1 N NaOH) λ max 1 : 347 nm & λ max 2 : 300 nm; EC (przy λ max 1): 7650 l/mol × cm
λ abs /λ em (MeOH): 355/413 nm - Luminol, sól sodowa: 3-aminoftalhydrazyd sodu; CAS: [20666-12-0]
C 8 H 6 N 3 O 2 Na – MW: 199,12 - Półwodzian luminolu : hydrat 3-aminoftalhydrazydu sodu; CAS: [206658-90-4]
C 8 H 6 N 3 O 2 Na • H 2 O – MW: 217,16 - Chlorowodorek luminolu: chlorowodorek 3-aminoftalhydrazydu; CAS [74165-64-3],
C 8 H 7 N 3 O 2 -HCl masa cząsteczkowa: 213,62 - Izoluminol: 4-aminoftalhydrazyd; CAS: [3682-14-1]
C 8 H 7 N 3 O 2 – MW: 117,16 (Xi) - Monohydrat izoluminolu: monohydrat 4-aminoftalhydrazydu
C 8 H 7 N 3 O 2 • H 2 O – MW: 195,15 - Izoluminol ABEI: monohydrat 4-aminoftalhydrazydu; Numer CAS: [66612-29-1]




![Mechanizm chemoluminescencyjny luminolu (cyklicznego hydrazydu) w zasadowym roztworze wodnym.[8]](https://upload.wikimedia.org/wikipedia/commons/thumb/0/09/Chemoluminescence_mechanism_of_luminol_%28cyclic_hydrazide%29_in_basic%2C_aqueous_solution.svg/1211px-Chemoluminescence_mechanism_of_luminol_%28cyclic_hydrazide%29_in_basic%2C_aqueous_solution.svg.png)