Metagenomika - Metagenomics

Metagenomika to badanie materiału genetycznego odzyskanego bezpośrednio z próbek środowiskowych . Szeroka dziedzina może być również określana jako genomika środowiskowa , ekogenomika lub genomika społecznościowa .
Podczas gdy tradycyjna mikrobiologia i sekwencjonowanie genomu drobnoustrojów oraz genomika opierają się na hodowanych kulturach klonalnych , wczesne sekwencjonowanie genów środowiskowych sklonowało specyficzne geny (często gen 16S rRNA ) w celu wytworzenia profilu różnorodności w naturalnej próbce. Takie prace ujawniły, że zdecydowana większość bioróżnorodności drobnoustrojów została pominięta przez metody oparte na uprawach.
Ze względu na swoją zdolność do ujawniania wcześniej ukrytej różnorodności mikroskopijnego życia, metagenomika oferuje potężne soczewki do oglądania świata drobnoustrojów, które mogą zrewolucjonizować rozumienie całego świata żywych. Ponieważ cena sekwencjonowania DNA wciąż spada, metagenomika pozwala teraz na badanie ekologii drobnoustrojów na znacznie większą skalę i szczegółowość niż wcześniej. Ostatnie badania wykorzystują sekwencjonowanie metodą „ strzelby ” lub metodą PCR, aby uzyskać w dużej mierze bezstronne próbki wszystkich genów od wszystkich członków badanych społeczności.
Etymologia
Termin „metagenomika” został po raz pierwszy użyty przez Jo Handelsmana , Jona Clardy’ego , Roberta M. Goodmana , Seana F. Brady’ego i innych, a po raz pierwszy pojawił się w publikacji w 1998 roku. Termin metagenom odnosił się do idei, że zbiór genów zsekwencjonowanych z środowisko można analizować w sposób analogiczny do badania pojedynczego genomu . W 2005 roku Kevin Chen i Lior Pachter (badacze z Uniwersytetu Kalifornijskiego w Berkeley ) zdefiniowali metagenomikę jako „zastosowanie nowoczesnej techniki genomiki bez potrzeby izolacji i laboratoryjnej hodowli poszczególnych gatunków”.
Historia
| Część serii na |
| Kod kreskowy DNA |
|---|

|
| Według taksów |
| Inne |
Konwencjonalne sekwencjonowanie zaczyna się od hodowli identycznych komórek jako źródła DNA . Jednak wczesne badania metagenomiczne ujawniły, że prawdopodobnie w wielu środowiskach istnieją duże grupy mikroorganizmów, których nie można hodować, a zatem nie można ich sekwencjonować. Te wczesne badania koncentrowały się na sekwencjach rybosomalnego RNA (rRNA) 16S , które są stosunkowo krótkie, często zachowane w obrębie gatunku i ogólnie różniące się między gatunkami. Znaleziono wiele sekwencji 16S rRNA , które nie należą do żadnego znanego hodowanego gatunku , co wskazuje, że istnieje wiele nieizolowanych organizmów. Te badania genów rybosomalnego RNA pobranych bezpośrednio ze środowiska wykazały, że metody oparte na hodowli pozwalają znaleźć mniej niż 1% gatunków bakterii i archeonów w próbce. Duże zainteresowanie metagenomiką wynika z tych odkryć, które pokazały, że ogromna większość mikroorganizmów była wcześniej niezauważana.
Wczesne prace molekularne w tej dziedzinie zostały przeprowadzone przez Normana R. Pace i współpracowników, którzy wykorzystali PCR do zbadania różnorodności sekwencji rybosomalnego RNA. Spostrzeżenia uzyskane z tych przełomowych badań doprowadziły Pace'a do zaproponowania pomysłu klonowania DNA bezpośrednio z próbek środowiskowych już w 1985 roku. Doprowadziło to do pierwszego raportu na temat izolacji i klonowania zbiorczego DNA z próbki środowiskowej, opublikowanego przez Pace'a i współpracowników w 1991 roku, podczas gdy Pace był na Wydziale Biologii Uniwersytetu Indiana . Znaczne wysiłki zapewniły, że nie były to wyniki fałszywie pozytywne PCR i poparły istnienie złożonej społeczności niezbadanych gatunków. Chociaż ta metodologia ograniczała się do badania wysoce konserwatywnych, niekodujących białek genów , wspierała wczesne obserwacje oparte na morfologii drobnoustrojów, że różnorodność jest znacznie bardziej złożona, niż było to znane z metod hodowlanych. Wkrótce potem Healy doniósł o metagenomicznej izolacji funkcjonalnych genów z „zooolibrities” skonstruowanych ze złożonej kultury organizmów środowiskowych wyhodowanych w laboratorium na suszonych trawach w 1995 roku. Po opuszczeniu laboratorium Pace Edward DeLong kontynuował pracę w terenie i opublikował pracę który w dużej mierze położył podwaliny pod filogenezy środowiskowe oparte na charakterystycznych sekwencjach 16S, poczynając od budowy bibliotek przez jego grupę z próbek morskich .
W 2002 roku Mya Breitbart , Forest Rohwer i współpracownicy zastosowali sekwencjonowanie środowiskowe (patrz poniżej), aby pokazać, że 200 litrów wody morskiej zawiera ponad 5000 różnych wirusów. Kolejne badania wykazały, że w kale człowieka występuje ponad tysiąc gatunków wirusów i prawdopodobnie milion różnych wirusów na kilogram osadów morskich , w tym wiele bakteriofagów . Zasadniczo wszystkie wirusy w tych badaniach były nowymi gatunkami. W 2004 r. Gene Tyson, Jill Banfield i współpracownicy z Uniwersytetu Kalifornijskiego w Berkeley i Joint Genome Institute zsekwencjonowali DNA wyekstrahowane z systemu odwadniania kopalni kwasu . Ten wysiłek zaowocował kompletnymi lub prawie kompletnymi genomami garstki bakterii i archeonów , które wcześniej opierały się próbom ich hodowli.
Począwszy od 2003 roku, Craig Venter , lider finansowanego ze środków prywatnych równoległości Human Genome Project , przewodził Global Ocean Sampling Expedition (GOS), okrążając glob i zbierając próbki metagenomiczne podczas całej podróży. Wszystkie te próbki są sekwencjonowane za pomocą sekwencjonowania typu shotgun, w nadziei, że zostaną zidentyfikowane nowe genomy (a tym samym nowe organizmy). W ramach projektu pilotażowego przeprowadzonego na Morzu Sargassowym znaleziono DNA prawie 2000 różnych gatunków , w tym 148 rodzajów bakterii, których nigdy wcześniej nie widziano. Venter opłynął kulę ziemską i dokładnie zbadał zachodnie wybrzeże Stanów Zjednoczonych , a także ukończył dwuletnią ekspedycję mającą na celu zbadanie Morza Bałtyckiego , Śródziemnego i Czarnego . Analiza danych metagenomicznych zebranych podczas tej podróży ujawniła dwie grupy organizmów, jedną złożoną z taksonów przystosowanych do warunków środowiskowych „uczty lub głodu”, a drugą złożoną ze stosunkowo mniej, ale obficiej i szeroko rozpowszechnionych taksonów składających się głównie z planktonu .
W 2005 roku Stephan C. Schuster z Penn State University wraz z kolegami opublikowali pierwsze sekwencje próbki środowiskowej wygenerowane za pomocą wysokoprzepustowego sekwencjonowania , w tym przypadku masowo równoległego pirosekwencjonowania opracowanego przez 454 Life Sciences . Kolejna wczesna praca w tej dziedzinie ukazała się w 2006 r. przez Roberta Edwardsa, Foresta Rohwera i współpracowników z San Diego State University .
Sekwencjonowanie
Odzyskiwanie sekwencji DNA dłuższych niż kilka tysięcy par zasad z próbek środowiskowych było bardzo trudne, dopóki niedawne postępy w technikach biologii molekularnej nie umożliwiły budowy bibliotek w sztucznych chromosomach bakteryjnych (BAC), które dostarczyły lepszych wektorów do klonowania molekularnego .
Metagenomika strzelby
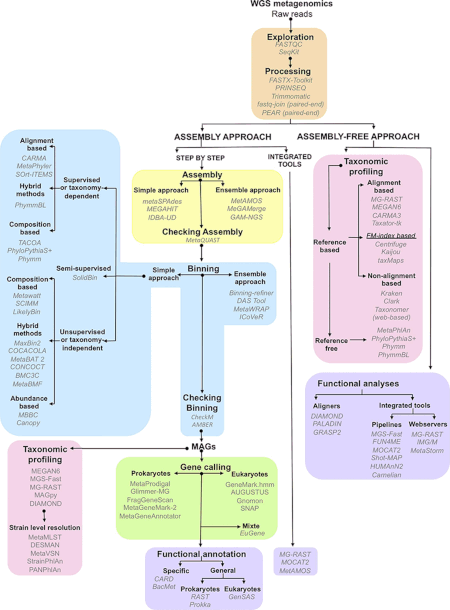
Postępy w bioinformatyce , udoskonalenia amplifikacji DNA i proliferacja mocy obliczeniowej znacznie pomogły w analizie sekwencji DNA odzyskanych z próbek środowiskowych, umożliwiając adaptację sekwencjonowania strzelbowego do próbek metagenomicznych (znanych również jako strzelba całego metagenomu lub sekwencjonowanie WMGS). Podejście, stosowane do sekwencjonowania wielu hodowanych mikroorganizmów i genomu ludzkiego , losowo ścina DNA, sekwencjonuje wiele krótkich sekwencji i rekonstruuje je w sekwencję konsensusową . Sekwencjonowanie strzelby ujawnia geny obecne w próbkach środowiskowych. Historycznie, do ułatwienia tego sekwencjonowania używano bibliotek klonów. Jednak wraz z postępem w wysokoprzepustowych technologiach sekwencjonowania etap klonowania nie jest już konieczny i można uzyskać większą wydajność danych sekwencjonowania bez tego pracochłonnego etapu wąskiego gardła. Metagenomika Shotgun dostarcza informacji zarówno o tym, jakie organizmy są obecne, jak i jakie procesy metaboliczne są możliwe w społeczności. Ponieważ zbieranie DNA ze środowiska jest w dużej mierze niekontrolowane, organizmy najobficiej występujące w próbce środowiskowej są najliczniej reprezentowane w uzyskanych danych sekwencyjnych. Aby osiągnąć wysoki stopień pokrycia potrzebny do pełnego zbadania genomów niedostatecznie reprezentowanych członków społeczności, potrzebne są duże próbki, często zbyt zaporowe. Z drugiej strony losowy charakter sekwencjonowania typu shotgun zapewnia, że wiele z tych organizmów, które w innym przypadku pozostałyby niezauważone przy użyciu tradycyjnych technik hodowli, będzie reprezentowanych przez przynajmniej kilka małych segmentów sekwencji.
Sekwencjonowanie o wysokiej przepustowości
Zaletą wysokowydajnego sekwencjonowania jest to, że technika ta nie wymaga klonowania DNA przed sekwencjonowaniem, co eliminuje jedną z głównych błędów systematycznych i wąskich gardeł w pobieraniu próbek środowiskowych. Pierwsze badania metagenomiczne przeprowadzone przy użyciu wysokoprzepustowego sekwencjonowania wykorzystywały masowo równoległe 454 pirosekwencjonowanie . Trzy inne technologie powszechnie stosowane do pobierania próbek środowiskowych to Ion Torrent Personal Genome Machine , Illumina MiSeq lub HiSeq oraz system Applied Biosystems SOLiD . Te techniki sekwencjonowania DNA generują krótsze fragmenty niż sekwencjonowanie Sangera ; System Ion Torrent PGM i pirosekwencjonowanie 454 zazwyczaj daje odczyty ~400 pz, Illumina MiSeq 400-700 pz (w zależności od tego, czy używane są opcje sparowanych końców), a SOLiD daje odczyty o wartości 25-75 pz. Historycznie te długości odczytu były znacznie krótsze niż typowa długość odczytu sekwencjonowania Sangera wynosząca ~750 pz, jednak technologia Illumina szybko zbliża się do tego wzorca. Jednak to ograniczenie jest kompensowane przez znacznie większą liczbę odczytów sekwencji. W 2009 r. metagenomy poddane pirosekwencjonowaniu generują 200–500 megabaz, a platformy Illumina generują około 20–50 gigabaz, ale w ostatnich latach te wyniki wzrosły o rzędy wielkości.
Nowe podejście łączy sekwencjonowanie metodą shotguna i wychwytywanie konformacji chromosomu (Hi-C), które mierzy bliskość dowolnych dwóch sekwencji DNA w tej samej komórce, aby kierować montażem genomu drobnoustrojów. Technologie sekwencjonowania długiego odczytu, w tym PacBio RSII i PacBio Sequel firmy Pacific Biosciences oraz Nanopore MinION, GridION, PromethION firmy Oxford Nanopore Technologies , to kolejny wybór, aby uzyskać długie odczyty sekwencjonowania typu shotgun, które powinny ułatwić proces montażu.
Bioinformatyka
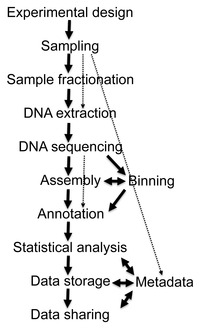
Dane generowane przez eksperymenty metagenomiczne są zarówno ogromne, jak i z natury hałaśliwe, zawierają fragmentaryczne dane reprezentujące aż 10 000 gatunków. Sekwencjonowanie metagenomu żwacza krowiego wygenerowało 279 gigapar zasad , czyli 279 miliardów par zasad danych o sekwencji nukleotydowej, podczas gdy katalog genów ludzkiego mikrobiomu jelitowego zidentyfikował 3,3 miliona genów złożonych z 567,7 giga zasad danych sekwencyjnych. Gromadzenie, opracowywanie i wydobywanie użytecznych informacji biologicznych z zestawów danych tej wielkości stanowi dla badaczy poważne wyzwania obliczeniowe.
Wstępne filtrowanie sekwencji
Pierwszy etap analizy danych metagenomicznych wymaga wykonania pewnych etapów wstępnego filtrowania, w tym usunięcia zbędnych, niskiej jakości sekwencji i sekwencji prawdopodobnego pochodzenia eukariotycznego (zwłaszcza w metagenomach pochodzenia ludzkiego). Dostępne metody usuwania zanieczyszczających eukariotycznych sekwencji genomowego DNA obejmują Eu-Detect i DeConseq.
montaż
Dane sekwencji DNA z projektów genomicznych i metagenomicznych są zasadniczo takie same, ale dane sekwencji genomowej zapewniają większy zasięg, podczas gdy dane metagenomiczne są zwykle wysoce nieredundantne. Co więcej, zwiększone wykorzystanie technologii sekwencjonowania drugiej generacji o krótkich długościach odczytu oznacza, że wiele przyszłych danych metagenomicznych będzie podatnych na błędy. W połączeniu, czynniki te sprawiają, że składanie wczytań sekwencji metagenomicznych do genomów jest trudne i niewiarygodne. Niezgodności są spowodowane obecnością powtarzających się sekwencji DNA, które szczególnie utrudniają montaż ze względu na różnicę we względnej liczebności gatunków obecnych w próbce. Niezłożenie może również obejmować kombinację sekwencji z więcej niż jednego gatunku w kontigach chimerycznych .
Istnieje kilka programów składania, z których większość może wykorzystywać informacje z sparowanych znaczników końcowych w celu poprawy dokładności złożeń. Niektóre programy, takie jak Phrap lub Celera Assembler, zostały zaprojektowane do użycia do składania pojedynczych genomów, ale mimo to dają dobre wyniki podczas łączenia zestawów danych metagenomicznych. Inne programy, takie jak asembler Velvet , zostały zoptymalizowane pod kątem krótszych odczytów generowanych przez sekwencjonowanie drugiej generacji dzięki wykorzystaniu wykresów de Bruijna . Wykorzystanie genomów referencyjnych pozwala naukowcom poprawić składanie najliczniejszych gatunków drobnoustrojów, ale podejście to jest ograniczone przez mały podzbiór typów drobnoustrojów, dla których dostępne są zsekwencjonowane genomy. Po utworzeniu zespołu dodatkowym wyzwaniem jest „metagenomiczna dekonwolucja” lub określenie, które sekwencje pochodzą z jakich gatunków w próbce.
Przewidywanie genów
Analiza metagenomiczne rurociągi użyć dwóch metod w przypisie regionów kodujących w zmontowanym kontigów. Pierwszym podejściem jest identyfikacja genów na podstawie homologii z genami, które są już publicznie dostępne w bazach danych sekwencji , zwykle przez wyszukiwanie BLAST . Tego typu podejście zostało wdrożone w programie MEGAN 4. Drugi, ab initio , wykorzystuje wewnętrzne cechy sekwencji do przewidywania regionów kodujących w oparciu o zestawy treningowe genów z organizmów pokrewnych. Takie podejście przyjmują programy takie jak GeneMark i GLIMMER . Główną zaletą przewidywania ab initio jest to, że umożliwia wykrywanie regionów kodujących, które nie mają homologów w bazach danych sekwencji; jednak jest to najdokładniejsze, gdy dostępne są duże regiony przylegającego genomowego DNA do porównania.
Różnorodność gatunkowa
Adnotacje genów dostarczają „co”, podczas gdy pomiary różnorodności gatunkowej dostarczają „kto”. Aby powiązać skład i funkcję społeczności w metagenomach, sekwencje muszą zostać pogrupowane. Binning to proces kojarzenia określonej sekwencji z organizmem. W binningu opartym na podobieństwie, metody takie jak BLAST są wykorzystywane do szybkiego wyszukiwania markerów filogenetycznych lub innych podobnych sekwencji w istniejących publicznych bazach danych. Takie podejście zostało zaimplementowane w MEGAN . Inne narzędzie, PhymmBL, wykorzystuje interpolowane modele Markowa do przypisywania odczytów. MetaPhlAn i AMPHORA to metody oparte na unikalnych markerach specyficznych dla kladu, służących do szacowania względnej liczebności organizmów z ulepszoną wydajnością obliczeniową. Inne narzędzia, takie jak mOTU i MetaPhyler, wykorzystują uniwersalne geny markerowe do profilowania gatunków prokariotycznych. Dzięki profilerowi mOTUs możliwe jest profilowanie gatunków bez genomu referencyjnego, co poprawia ocenę różnorodności społeczności drobnoustrojów. Najnowsze metody, takie jak SLIMM , wykorzystują krajobraz pokrycia odczytu poszczególnych genomów referencyjnych, aby zminimalizować wyniki fałszywie dodatnie i uzyskać wiarygodne względne obfitości. W binningu opartym na składzie metody wykorzystują wewnętrzne cechy sekwencji, takie jak częstość występowania oligonukleotydów lub stronniczość wykorzystania kodonów . Po zbindowaniu sekwencji można przeprowadzić analizę porównawczą różnorodności i bogactwa.
Integracja danych
Ogromna ilość wykładniczo rosnących danych sekwencyjnych jest zniechęcającym wyzwaniem, które komplikuje złożoność metadanych związanych z projektami metagenomicznymi. Metadane obejmują szczegółowe informacje o trójwymiarowej (w tym głębokości lub wysokości) geografii i cechach środowiskowych próbki, dane fizyczne dotyczące miejsca pobrania próbki oraz metodologię pobierania próbek. Informacje te są niezbędne zarówno do zapewnienia powtarzalności, jak i umożliwienia dalszej analizy. Ze względu na swoje znaczenie metadane oraz wspólne przeglądanie i przechowywanie danych wymagają standardowych formatów danych znajdujących się w wyspecjalizowanych bazach danych, takich jak Genomes OnLine Database (GOLD).
Opracowano kilka narzędzi do integracji metadanych i danych sekwencyjnych, umożliwiając dalsze analizy porównawcze różnych zestawów danych z wykorzystaniem szeregu wskaźników ekologicznych. W 2007 roku Folker Meyer i Robert Edwards oraz zespół z Argonne National Laboratory i University of Chicago wydali Metagenomics Rapid Annotation using Subsystem Technology server ( MG-RAST ) – zasób społecznościowy do analizy zbioru danych metagenomu. W czerwcu 2012 ponad 14,8 terabases (14x10 12 baz) DNA zostały poddane analizie, z ponad 10.000 zestawów danych publicznych swobodnie dostępnych dla porównania w MG-RAST. Ponad 8000 użytkowników przesłało do MG-RAST łącznie 50 000 metagenomów. System Integrated Microbial Genomes/Metagenomes (IMG/M) zapewnia również zbiór narzędzi do analizy funkcjonalnej zbiorowisk drobnoustrojów w oparciu o ich sekwencję metagenomów, w oparciu o referencyjne genomy izolatów zawarte w systemie Integrated Microbial Genomes (IMG) i Encyklopedii Genomowej Projekt Bakterie i Archaea (GEBA) .
Jednym z pierwszych samodzielnych narzędzi do analizy wysokoprzepustowych danych ze strzelby metagenomowej był MEGAN (METa Genome ANalyzer). Pierwsza wersja programu została wykorzystana w 2005 roku do analizy kontekstu metagenomicznego sekwencji DNA uzyskanych z kości mamuta. Na podstawie porównania BLAST przeciwko referencyjnej bazy danych, narzędzie wykonuje zarówno taksonomiczne i funkcjonalne binning poprzez umieszczenie czyta na węzłach taksonomii NCBI pomocą prostego najniższy wspólny przodek (LCA) algorytm lub na węzłach SEED lub KEGG klasyfikacji , odpowiednio.
Wraz z pojawieniem się szybkich i niedrogich instrumentów do sekwencjonowania, wzrost baz danych sekwencji DNA jest obecnie wykładniczy (np. baza danych NCBI GenBank). Potrzebne są szybsze i wydajne narzędzia, aby nadążyć za wysokoprzepustowym sekwencjonowaniem, ponieważ podejścia oparte na BLAST, takie jak MG-RAST lub MEGAN, działają powoli, aby opisywać duże próbki (np. kilka godzin na przetworzenie małego/średniego zestawu danych/próbki ). W ten sposób pojawiły się ostatnio ultraszybkie klasyfikatory dzięki bardziej przystępnym cenowo, wydajnym serwerom. Narzędzia te mogą wykonywać adnotacje taksonomiczne z bardzo dużą szybkością, na przykład CLARK (według autorów CLARK, potrafi on dokładnie sklasyfikować „32 miliony krótkich odczytów metagenomicznych na minutę”). Przy takiej szybkości bardzo duży zestaw danych/próbka miliarda krótkich odczytów może zostać przetworzony w około 30 minut.
Wraz z rosnącą dostępnością próbek zawierających pradawne DNA oraz ze względu na niepewność związaną z naturą tych próbek (uszkodzenie pradawnego DNA), udostępniono szybkie narzędzie zdolne do tworzenia konserwatywnych szacunków podobieństwa. Według autorów FALCON, może używać zrelaksowanych progów i edytować odległości bez wpływu na wydajność pamięci i szybkości.
Metagenomika porównawcza
Analizy porównawcze między metagenomami mogą dostarczyć dodatkowych informacji na temat funkcji złożonych społeczności drobnoustrojów i ich roli w zdrowiu gospodarza. Porównania parami lub wielokrotne między metagenomami można przeprowadzić na poziomie składu sekwencji (porównanie zawartości GC lub wielkości genomu), różnorodności taksonomicznej lub dopełnienia funkcjonalnego. Porównania struktury populacji i różnorodności filogenetycznej można dokonać na podstawie 16S i innych genów markerów filogenetycznych lub – w przypadku społeczności o niskim zróżnicowaniu – na podstawie rekonstrukcji genomu ze zbioru danych metagenomicznych. Porównania funkcjonalne między metagenomami można przeprowadzić porównując sekwencje z referencyjnymi bazami danych, takimi jak COG lub KEGG , oraz zestawiając obfitość według kategorii i oceniając wszelkie różnice pod kątem istotności statystycznej. To genocentryczne podejście kładzie nacisk na funkcjonalne dopełnienie społeczności jako całości, a nie na grupy taksonomiczne, i pokazuje, że funkcjonalne dopełnienia są analogiczne w podobnych warunkach środowiskowych. W związku z tym metadane dotyczące kontekstu środowiskowego próbki metagenomicznej są szczególnie ważne w analizach porównawczych, ponieważ dają naukowcom możliwość badania wpływu siedliska na strukturę i funkcję społeczności.
Ponadto w kilku badaniach wykorzystano również wzorce użycia oligonukleotydów w celu zidentyfikowania różnic między różnymi społecznościami drobnoustrojów. Przykłady takich metodologii obejmują podejście do względnej obfitości dinukleotydów Willner et al. oraz podejście HabiSign Ghosha i in. To ostatnie badanie wykazało również, że różnice we wzorcach wykorzystania tetranukleotydów można wykorzystać do identyfikacji genów (lub odczytów metagenomicznych) pochodzących z określonych siedlisk. Dodatkowo niektóre metody, takie jak TriageTools lub Compareads, wykrywają podobne odczyty między dwoma zestawami odczytów. Miarą podobieństwa one zastosowanie na odczyty opiera się na kilku identycznych słów o długości k wspólnych par czyta.
Kluczowym celem metagenomiki porównawczej jest identyfikacja grup drobnoustrojów odpowiedzialnych za nadawanie określonych cech danemu środowisku. Jednak ze względu na problemy w technologiach sekwencjonowania artefakty muszą być uwzględniane jak w metagenomeSeq. Inni scharakteryzowali interakcje między drobnoustrojami między rezydującymi grupami drobnoustrojów. GUI -na porównawcza analiza metagenomiczne aplikacja o nazwie Community-Analyzer został opracowany przez Kuntal et al. który implementuje oparty na korelacji algorytm układu wykresów, który nie tylko ułatwia szybką wizualizację różnic w analizowanych społecznościach drobnoustrojów (pod względem ich składu taksonomicznego), ale także zapewnia wgląd w nieodłączne interakcje między drobnoustrojami w nich zachodzące. Warto zauważyć, że ten algorytm układu umożliwia również grupowanie metagenomów na podstawie prawdopodobnych wzorców interakcji między drobnoustrojami, a nie po prostu porównywanie wartości liczebności różnych grup taksonomicznych. Ponadto narzędzie implementuje kilka interaktywnych funkcji opartych na graficznym interfejsie użytkownika, które umożliwiają użytkownikom wykonywanie standardowych analiz porównawczych w obrębie mikrobiomów.
Analiza danych
Metabolizm wspólnotowy
W wielu społecznościach bakteryjnych, naturalnych lub inżynieryjnych (takich jak bioreaktory ), istnieje znaczny podział pracy w metabolizmie ( syntrofia ), podczas którego produkty odpadowe jednych organizmów stają się metabolitami innych. W jednym z takich systemów, bioreaktorze metanogennym , stabilność funkcjonalna wymaga obecności kilku gatunków syntroficznych ( Syntrophobacterales i Synergistia ) współpracujących ze sobą w celu przekształcenia surowych zasobów w całkowicie zmetabolizowane odpady ( metan ). Korzystając z porównawczych badań genów i eksperymentów z ekspresją z użyciem mikromacierzy lub proteomiki, naukowcy mogą połączyć sieć metaboliczną, która wykracza poza granice gatunków. Takie badania wymagają szczegółowej wiedzy o tym, które wersje jakich białek są kodowane przez które gatunki, a nawet przez które szczepy których gatunków. Dlatego też informacje genomowe społeczności są kolejnym podstawowym narzędziem (wraz z metabolomiką i proteomiką) w dążeniu do ustalenia, w jaki sposób metabolity są przenoszone i przekształcane przez społeczność.
Metatranskryptomika
Metagenomika umożliwia naukowcom dostęp do funkcjonalnej i metabolicznej różnorodności społeczności drobnoustrojów, ale nie może pokazać, które z tych procesów są aktywne. Ekstrakcja i analiza metagenomowego mRNA ( metatranskryptomu ) dostarcza informacji na temat profili regulacji i ekspresji złożonych społeczności. Ze względu na trudności techniczne (na przykład krótki okres półtrwania mRNA) w zbieraniu środowiskowego RNA przeprowadzono do tej pory stosunkowo niewiele metatranskryptomicznych badań in situ społeczności drobnoustrojów. Chociaż pierwotnie ograniczały się do technologii mikromacierzy , badania metatranskryptomiczne wykorzystywały technologie transkryptomiczne do pomiaru ekspresji całego genomu i oceny ilościowej społeczności drobnoustrojów, po raz pierwszy zastosowanej w analizie utleniania amoniaku w glebie.
Wirusy
Sekwencjonowanie metagenomiczne jest szczególnie przydatne w badaniu społeczności wirusowych. Ponieważ wirusom brakuje wspólnego uniwersalnego markera filogenetycznego (takiego jak 16S RNA dla bakterii i archeonów oraz 18S RNA dla eukarioi), jedynym sposobem uzyskania dostępu do różnorodności genetycznej społeczności wirusów z próbki środowiskowej jest metagenomika. Metagenomy wirusowe (zwane również wiromami) powinny zatem dostarczać coraz więcej informacji o różnorodności i ewolucji wirusów. Na przykład rurociąg metagenomiczny o nazwie Giant Virus Finder wykazał pierwsze dowody na istnienie gigantycznych wirusów na słonej pustyni iw suchych dolinach Antarktyki.
Aplikacje
Metagenomika ma potencjał do pogłębiania wiedzy w wielu różnych dziedzinach. Może być również stosowany do rozwiązywania praktycznych wyzwań w medycynie , inżynierii , rolnictwie , zrównoważonym rozwoju i ekologii .
Rolnictwo
Do gleby , w której rosną rośliny zamieszkują mikroorganizmów, przy czym jeden gram gleby zawierającej około 10 9 -10 10 komórek bakteryjnych, które zawierają około jedną gigabase informacji o sekwencji. Zbiorowiska drobnoustrojów zamieszkujące glebę są jednymi z najbardziej złożonych znanych nauce i pozostają słabo poznane pomimo ich znaczenia gospodarczego. Konsorcja drobnoustrojów świadczą różnorodne usługi ekosystemowe niezbędne do wzrostu roślin, w tym wiązanie azotu atmosferycznego, obieg składników odżywczych , tłumienie chorób oraz sekwestrację żelaza i innych metali . Strategie metagenomiki funkcjonalnej są wykorzystywane do badania interakcji między roślinami a drobnoustrojami poprzez niezależne od uprawy badanie tych społeczności drobnoustrojów. Poprzez umożliwienie wglądu w rolę wcześniej nieuprawianych lub rzadkich członków społeczności w obiegu składników odżywczych i promowaniu wzrostu roślin, podejścia metagenomiczne mogą przyczynić się do lepszego wykrywania chorób w uprawach i zwierzętach hodowlanych oraz adaptacji ulepszonych praktyk rolniczych, które poprawiają zdrowie upraw poprzez wykorzystanie tego związku między drobnoustrojami a roślinami.
Biopaliwo
Biopaliwa to paliwa pochodzące z konwersji biomasy , tak jak w przypadku konwersji celulozy zawartej w łodygach kukurydzy , prosa rózgowego i innej biomasy w etanol celulozowy . Proces ten jest zależny od konsorcjów (związków) drobnoustrojów, które przekształcają celulozę w cukry , po czym następuje fermentacja cukrów w etanol . Mikroby wytwarzają również różne źródła bioenergii, w tym metan i wodór .
Wydajny skalę przemysłową rozbiórka biomasy wymaga nowych enzymów o większej wydajności i mniejszych kosztach. Metagenomiczne podejście do analizy złożonych mikroorganizmów umożliwiają ukierunkowany skriningu z enzymami w zastosowaniach przemysłowych w produkcji biopaliw, takie jak hydrolazy glikozydowe . Ponadto wiedza na temat funkcjonowania tych społeczności drobnoustrojów jest niezbędna do ich kontrolowania, a metagenomika jest kluczowym narzędziem w ich zrozumieniu. Metagenomiczne podejście pozwoli analiz porównawczych między konwergentnych systemach bakteryjnych, takich jak biogaz fermentacyjnych lub owady roślinożerne , takie jak ogród grzyba z Leafcutter mrówek .
Biotechnologia
Społeczności drobnoustrojów wytwarzają szeroki wachlarz biologicznie aktywnych chemikaliów, które są wykorzystywane w rywalizacji i komunikacji. Wiele z obecnie stosowanych leków zostało pierwotnie odkrytych w drobnoustrojach; niedawny postęp w wydobyciu bogatego zasobu genetycznego drobnoustrojów niehodowlanych doprowadził do odkrycia nowych genów, enzymów i produktów naturalnych. Zastosowanie metagenomiki umożliwiło rozwój chemikaliów towarowych i wysokowartościowych , agrochemikaliów i farmaceutyków, w których korzyści płynące z katalizowanej enzymatycznie syntezy chiralnej są coraz bardziej dostrzegane.
W bioprzeszukiwaniu danych metagenomicznych stosuje się dwa rodzaje analiz : przesiewanie zależne od funkcji pod kątem wyrażonej cechy oraz przesiewowe oparte na sekwencjach pod kątem interesujących sekwencji DNA. Analiza sterowana funkcjami ma na celu identyfikację klonów wyrażających pożądaną cechę lub użyteczną aktywność, po której następuje charakterystyka biochemiczna i analiza sekwencji. To podejście jest ograniczone dostępnością odpowiedniego badania przesiewowego i wymaganiem, aby pożądana cecha była wyrażana w komórce gospodarza. Co więcej, niski wskaźnik wykrywalności (mniej niż jeden na 1000 przebadanych klonów) i jego pracochłonny charakter dodatkowo ograniczają to podejście. W przeciwieństwie do tego, analiza sterowana sekwencjami wykorzystuje konserwatywne sekwencje DNA do projektowania starterów PCR do przeszukiwania klonów pod kątem sekwencji będącej przedmiotem zainteresowania. W porównaniu z podejściami opartymi na klonowaniu, zastosowanie podejścia opartego wyłącznie na sekwencjach dodatkowo zmniejsza ilość wymaganej pracy na stanowisku. Zastosowanie sekwencjonowania masowo równoległego również znacznie zwiększa ilość generowanych danych sekwencyjnych, które wymagają wysokoprzepustowych potoków analizy bioinformatycznej. Podejście oparte na sekwencjach do badań przesiewowych jest ograniczone przez zakres i dokładność funkcji genów obecnych w publicznych bazach danych sekwencji. W praktyce eksperymenty wykorzystują kombinację podejść funkcjonalnych i opartych na sekwencji, opartych na funkcji będącej przedmiotem zainteresowania, złożoności badanej próbki i innych czynnikach. Przykładem sukcesu wykorzystania metagenomiki jako biotechnologii do odkrywania leków są antybiotyki malacydynowe .
Ekologia
Metagenomika może dostarczyć cennych informacji na temat ekologii funkcjonalnej społeczności środowiskowych. Analiza metagenomiczna konsorcjów bakteryjnych znalezionych w defekacjach australijskich lwów morskich sugeruje, że bogate w składniki odżywcze odchody lwów morskich mogą być ważnym źródłem składników odżywczych dla ekosystemów przybrzeżnych. Dzieje się tak, ponieważ bakterie, które są wydalane jednocześnie z defekacjami, są zdolne do rozkładania składników odżywczych z kału na biodostępną formę, która może zostać przeniesiona do łańcucha pokarmowego.
Sekwencjonowanie DNA może być również szerzej stosowane do identyfikacji gatunków obecnych w zbiorniku wodnym, szczątków odfiltrowanych z powietrza, próbek brudu, a nawet odchodów zwierząt. Umożliwia to ustalenie zakresu gatunków inwazyjnych i gatunków zagrożonych oraz śledzenie populacji sezonowych.
Rekultywacja środowiska
Metagenomika może ulepszyć strategie monitorowania wpływu zanieczyszczeń na ekosystemy i oczyszczania skażonego środowiska. Lepsze zrozumienie, w jaki sposób społeczności drobnoustrojów radzą sobie z zanieczyszczeniami, poprawia oceny potencjału skażonych terenów do regeneracji po zanieczyszczeniach i zwiększa szanse powodzenia prób bioaugmentacji lub biostymulacji .
Charakterystyka drobnoustrojów jelitowych
Zbiorowiska drobnoustrojów odgrywają kluczową rolę w zachowaniu ludzkiego zdrowia , ale ich skład i mechanizm, za pomocą którego to robią, pozostają tajemnicze. Do scharakteryzowania zbiorowisk drobnoustrojów w 15-18 miejscach ciała od co najmniej 250 osób stosuje się sekwencjonowanie metagenomiczne. Jest to część inicjatywy Human Microbiome, której głównymi celami są ustalenie, czy istnieje podstawowy mikrobiom człowieka , zrozumienie zmian w ludzkim mikrobiomie, które mogą być skorelowane ze zdrowiem człowieka, oraz opracowanie nowych narzędzi technologicznych i bioinformatycznych wspierających te cele.
Inne badanie medyczne w ramach projektu MetaHit (Metagenomics of the Human Intestinal Tract) objęło 124 osoby z Danii i Hiszpanii składające się ze zdrowych pacjentów z nadwagą i chorobą jelita drażliwego. W badaniu podjęto próbę kategoryzacji głębokości i różnorodności filogenetycznej bakterii żołądkowo-jelitowych. Korzystając z danych sekwencyjnych Illumina GA i SOAPdenovo, narzędzia opartego na wykresach de Bruijna, zaprojektowanego specjalnie do składania krótkich odczytów, byli w stanie wygenerować 6,58 miliona kontigów większych niż 500 pz dla całkowitej długości kontigów 10,3 Gb i długości N50 2,2 kb.
Badanie wykazało, że dwie grupy bakterii, Bacteroidetes i Firmicutes, stanowią ponad 90% znanych kategorii filogenetycznych, które dominują w dystalnych bakteriach jelitowych. Korzystając ze względnych częstości występowania genów w jelitach, badacze zidentyfikowali 1244 klastry metagenomiczne, które mają krytyczne znaczenie dla zdrowia przewodu pokarmowego. Istnieją dwa rodzaje funkcji w tych klastrach: sprzątanie i funkcje specyficzne dla jelit. Klastry genów porządkowych są wymagane we wszystkich bakteriach i często są głównymi graczami w głównych szlakach metabolicznych, w tym w centralnym metabolizmie węgla i syntezie aminokwasów. Funkcje specyficzne dla jelit obejmują adhezję do białek gospodarza i zbieranie cukrów z glikolipidów z serii Globoseries. Wykazano, że pacjenci z zespołem jelita drażliwego wykazują o 25% mniej genów i mniejszą różnorodność bakteryjną niż osoby nie cierpiące na zespół jelita drażliwego, co wskazuje, że zmiany w różnorodności biomów jelitowych pacjentów mogą być związane z tym stanem.
Chociaż badania te podkreślają niektóre potencjalnie cenne zastosowania medyczne, tylko 31–48,8% odczytów można powiązać z 194 publicznymi genomami bakterii jelitowych człowieka i 7,6–21,2% z genomami bakteryjnymi dostępnymi w GenBank, co wskazuje, że wciąż potrzeba znacznie więcej badań, aby wychwytują nowe genomy bakteryjne.
W ramach projektu Human Microbiome Project (HMP) zbadano zbiorowiska drobnoustrojów jelitowych przy użyciu wysokoprzepustowego sekwencjonowania DNA. HMP wykazał, że w przeciwieństwie do poszczególnych gatunków drobnoustrojów, wiele procesów metabolicznych występuje we wszystkich siedliskach organizmu z różną częstotliwością. W ramach projektu dotyczącego ludzkiego mikrobiomu zbadano zbiorowiska drobnoustrojów składające się z 649 metagenomów pobranych z siedmiu pierwotnych miejsc w ciele 102 osobników . Analiza metagenomiczna ujawniła różnice w obfitości specyficznej dla nisz między 168 modułami funkcjonalnymi i 196 szlakami metabolicznymi w obrębie mikrobiomu. Obejmowały one degradację glikozaminoglikanów w jelitach, a także transport fosforanów i aminokwasów związany z fenotypem żywiciela (pH pochwy) w tylnym sklepieniu. HMP ujawnił użyteczność metagenomiki w diagnostyce i medycynie opartej na dowodach . Zatem metagenomika jest potężnym narzędziem do rozwiązywania wielu palących problemów w dziedzinie medycyny spersonalizowanej .
Diagnoza choroby zakaźnej
Odróżnienie choroby zakaźnej od niezakaźnej oraz określenie podstawowej etiologii infekcji może być dość trudne. Na przykład ponad połowa przypadków zapalenia mózgu pozostaje niezdiagnozowana, pomimo szeroko zakrojonych testów przy użyciu najnowocześniejszych klinicznych metod laboratoryjnych. Sekwencjonowanie metagenomiczne jest obiecujące jako czuła i szybka metoda diagnozowania infekcji poprzez porównanie materiału genetycznego znalezionego w próbce pacjenta z bazami danych wszystkich znanych mikroskopijnych patogenów ludzkich i tysięcy innych organizmów bakteryjnych, wirusowych, grzybiczych i pasożytniczych oraz baz danych dotyczących sekwencji genów oporności na środki przeciwdrobnoustrojowe z towarzyszącymi fenotypami klinicznymi.
Nadzór arbowirusów
Metagenomika jest nieocenionym narzędziem pomagającym scharakteryzować różnorodność i ekologię patogenów przenoszonych przez owady krwiożerne (żywiące się krwią), takie jak komary i kleszcze. Metagenomika jest rutynowo wykorzystywana przez urzędników i organizacje zdrowia publicznego do nadzoru nad arbowirusami.
Zobacz też
Bibliografia
Zewnętrzne linki
- Skoncentruj się na Metagenomice na stronie czasopisma Nature Reviews Microbiology
- Inicjatywa „Critical Assessment of Metagenome Interpretation” (CAMI) mająca na celu ocenę metod w metagenomice