Neuroprzekaźnik - Neurotransmitter
| Struktura typowej synapsy chemicznej |
|---|
Neuroprzekaźnikiem jest cząsteczka sygnalizacji wydzielane przez neuronów lub komórek glejowych do wpływania na inną komórkę w poprzek synapsie . Komórką odbierającą sygnał lub komórką docelową może być inny neuron, ale może to być również komórka gruczołu lub mięśnia .
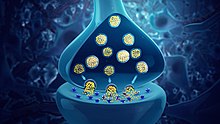
Neuroprzekaźniki są uwalniane z pęcherzyków synaptycznych do szczeliny synaptycznej, gdzie są odbierane przez receptory neuroprzekaźników na komórce docelowej. Wiele neuroprzekaźników jest syntetyzowanych z prostych i obfitych prekursorów, takich jak aminokwasy , które są łatwo dostępne i wymagają jedynie niewielkiej liczby etapów biosyntezy do konwersji. Neuroprzekaźniki są niezbędne do funkcjonowania złożonych systemów nerwowych. Dokładna liczba unikalnych neuroprzekaźników u ludzi nie jest znana, ale zidentyfikowano ponad 500.
Mechanizm
Neuroprzekaźniki są przechowywane w pęcherzykach synaptycznych , skupionych blisko błony komórkowej na końcu aksonu neuronu presynaptycznego. Neuroprzekaźniki są uwalniane i dyfundują przez szczelinę synaptyczną , gdzie wiążą się ze specyficznymi receptorami na błonie neuronu postsynaptycznego. Wiązanie neuroprzekaźników może wpływać na neuron postsynaptyczny w sposób wzbudzający lub hamujący , odpowiednio go depolaryzując lub repolaryzując .
Większość neuroprzekaźników ma wielkość jednego aminokwasu; jednak niektóre neuroprzekaźniki mogą być wielkości większych białek lub peptydów . Uwolniony neuroprzekaźnik jest zazwyczaj dostępny w szczelinie synaptycznej przez krótki czas, zanim zostanie zmetabolizowany przez enzymy, wciągnięty z powrotem do neuronu presynaptycznego poprzez wychwyt zwrotny lub związany z receptorem postsynaptycznym . Niemniej jednak krótkotrwała ekspozycja receptora na neuroprzekaźnik jest typowo wystarczająca do wywołania odpowiedzi postsynaptycznej poprzez transmisję synaptyczną .
Na ogół neuroprzekaźnik jest uwalniany na końcu presynaptycznym w odpowiedzi na progowy potencjał czynnościowy lub stopniowany potencjał elektryczny w neuronie presynaptycznym. Jednak uwalnianie „podstawowe” na niskim poziomie występuje również bez stymulacji elektrycznej.
Odkrycie
Do początku XX wieku naukowcy zakładali, że większość komunikacji synaptycznej w mózgu ma charakter elektryczny. Jednak dzięki badaniom histologicznym przeprowadzonym przez Ramóna y Cajala odkryto szczelinę między neuronami o długości od 20 do 40 nm, zwaną dziś szczeliną synaptyczną . Obecność takiej luki sugerowała komunikację za pośrednictwem chemicznych posłańców przechodzących przez szczelinę synaptyczną, a w 1921 r. niemiecki farmakolog Otto Loewi potwierdził, że neurony mogą komunikować się poprzez uwalnianie substancji chemicznych. Dzięki serii eksperymentów z nerwami błędnymi żab Loewi był w stanie ręcznie spowolnić tętno żab, kontrolując ilość roztworu soli fizjologicznej obecnego wokół nerwu błędnego. Po zakończeniu tego eksperymentu Loewi stwierdził, że współczulna regulacja czynności serca może być pośredniczona przez zmiany stężeń chemicznych. Ponadto Otto Loewi przypisuje się odkryciu acetylocholiny (ACh) – pierwszego znanego neuroprzekaźnika.
Identyfikacja
Istnieją cztery główne kryteria identyfikacji neuroprzekaźników:
- Substancja chemiczna musi być zsyntetyzowana w neuronie lub w inny sposób być w nim obecna.
- Kiedy neuron jest aktywny, substancja chemiczna musi zostać uwolniona i wywołać reakcję w niektórych celach.
- Ta sama reakcja musi zostać uzyskana, gdy substancja chemiczna zostanie eksperymentalnie umieszczona na celu.
- Musi istnieć mechanizm usuwania substancji chemicznej z miejsca aktywacji po zakończeniu jej pracy.
Jednak biorąc pod uwagę postępy w farmakologii , genetyce i neuroanatomii chemicznej , termin „neuroprzekaźnik” może być stosowany do substancji chemicznych, które:
- Przenoszenie wiadomości między neuronami poprzez oddziaływanie na błonę postsynaptyczną.
- Mają niewielki lub żaden wpływ na napięcie błony, ale mają wspólną funkcję przenoszenia, taką jak zmiana struktury synapsy.
- Komunikuj się, wysyłając komunikaty w kierunku odwrotnym, które wpływają na zwolnienie lub ponowne wychwytywanie nadajników.
Anatomiczną lokalizację neuroprzekaźników określa się zazwyczaj za pomocą technik immunocytochemicznych , które identyfikują lokalizację samych substancji przekaźnikowych lub enzymów biorących udział w ich syntezie. Techniki immunocytochemiczne ujawniły również, że wiele przekaźników, zwłaszcza neuropeptydów , jest zlokalizowanych w tej samej lokalizacji, co oznacza, że neuron może uwalniać więcej niż jeden przekaźnik ze swojego zakończenia synaptycznego . Do identyfikacji neuroprzekaźników w ośrodkowym układzie nerwowym można zastosować różne techniki i eksperymenty, takie jak barwienie , stymulacja i zbieranie .
Rodzaje
Istnieje wiele różnych sposobów klasyfikacji neuroprzekaźników. Do niektórych celów klasyfikacyjnych wystarczy ich podział na aminokwasy , peptydy i monoaminy .
Główne neuroprzekaźniki:
- Aminokwasy : glutaminian , asparaginian , D-seryna , kwas gamma-aminomasłowy (GABA), glicyna
- Gazoprzekaźniki : tlenek azotu (NO), tlenek węgla (CO), siarkowodór (H 2 S)
-
Monoaminy : dopamina (DA), norepinefryna (noradrenalina; NE, NA), epinefryna (adrenalina), histamina , serotonina (SER, 5-HT)
- Katecholaminy : dopamina , norepinefryna (noradrenalina), epinefryna (adrenalina)
- Aminy śladowe : fenetylamina , N- metylofenetyloamina , tyramina , 3-jodotyronamina , oktopamina , tryptamina itp.
- Peptydy : oksytocyna , somatostatyna , substancja P , transkrypt regulowany kokainą i amfetaminą , peptydy opioidowe
- Puryny : trifosforan adenozyny (ATP), adenozyna
- Inne: acetylocholina (ACh), anandamid itp.
Ponadto odkryto ponad 100 neuroaktywnych peptydów i regularnie odkrywane są nowe. Wiele z nich jest uwalnianych razem z nadajnikiem drobnocząsteczkowym. Niemniej jednak w niektórych przypadkach peptyd jest głównym przekaźnikiem w synapsie. Beta-endorfina jest stosunkowo dobrze znanym przykładem neuroprzekaźnika peptydowego, ponieważ wchodzi w wysoce specyficzne interakcje z receptorami opioidowymi w ośrodkowym układzie nerwowym .
Pojedyncze jony (takie jak cynk uwalniany synaptycznie ) są również uważane przez niektórych za neuroprzekaźniki, podobnie jak niektóre cząsteczki gazowe, takie jak tlenek azotu (NO), tlenek węgla (CO) i siarkowodór (H 2 S). Gazy wytwarzane są w cytoplazmie neuronalnej i natychmiast dyfundowane przez błonę komórkową do płynu pozakomórkowego i do pobliskich komórek, aby stymulować produkcję wtórnych przekaźników. Neuroprzekaźniki gazów rozpuszczalnych są trudne do zbadania, ponieważ działają szybko i natychmiast ulegają rozkładowi, istniejąc tylko przez kilka sekund.
Najbardziej rozpowszechnionym przekaźnikiem jest glutaminian , który pobudza w ponad 90% synaps w ludzkim mózgu. Kolejnym najbardziej rozpowszechnionym jest kwas gamma-aminomasłowy lub GABA, który hamuje ponad 90% synaps, które nie wykorzystują glutaminianu. Chociaż inne przekaźniki są wykorzystywane w mniejszej liczbie synaps, mogą być bardzo ważne funkcjonalnie: zdecydowana większość leków psychoaktywnych wywiera swoje działanie poprzez zmianę działania niektórych układów neuroprzekaźników, często działających poprzez przekaźniki inne niż glutaminian lub GABA. Uzależniające narkotyki, takie jak kokaina i amfetamina, wywierają wpływ przede wszystkim na układ dopaminowy. Uzależnienia od opiatów leki wywierają wpływ przede wszystkim jako funkcjonalne analogi peptydów opioidowych , które, z kolei, reguluje poziomy dopaminy.
Lista neuroprzekaźników, peptydów i gazowych cząsteczek sygnałowych
działania
Neurony tworzą rozbudowane sieci, przez które przemieszczają się impulsy nerwowe – potencjały czynnościowe . Każdy neuron ma aż 15 000 połączeń z sąsiednimi neuronami.
Neurony nie stykają się ze sobą (z wyjątkiem synapsy elektrycznej przez złącze szczelinowe); zamiast tego neurony oddziałują na punkty kontaktowe zwane synapsami: połączenie w dwóch komórkach nerwowych, składające się z miniaturowej szczeliny, w której impulsy są przenoszone przez neuroprzekaźnik. Neuron przenosi informacje za pomocą impulsu nerwowego zwanego potencjałem czynnościowym. Kiedy potencjał czynnościowy dociera do presynaptycznego przycisku końcowego synapsy, może stymulować uwalnianie neuroprzekaźników. Te neuroprzekaźniki są uwalniane do szczeliny synaptycznej, aby wiązać się z receptorami błony postsynaptycznej i wpływać na inną komórkę w sposób hamujący lub pobudzający. Następny neuron może być podłączony do znacznie większej liczby neuronów i jeśli suma wpływów pobudzających minus wpływy hamujące jest wystarczająco duża, to również „odpali”. Innymi słowy, wytworzy nowy potencjał czynnościowy na swoim wzniesieniu aksonowym, uwalniając neuroprzekaźniki i przekazując informacje do kolejnego sąsiedniego neuronu.
Pobudzający i hamujący
Neuroprzekaźnik może wpływać na funkcję neuronu poprzez niezwykłą liczbę mechanizmów. Jednak w swoich bezpośrednich działaniach wpływających na pobudliwość elektryczną neuronu , neuroprzekaźnik działa tylko na dwa sposoby: pobudzający lub hamujący. Neuroprzekaźnik wpływa na przepływ jonów przezbłonowych, zwiększając (pobudzający) lub zmniejszając (hamujący) prawdopodobieństwo, że komórka, z którą się styka, wytworzy potencjał czynnościowy. Tak więc, pomimo dużej różnorodności synaps, wszystkie przekazują wiadomości tylko tych dwóch typów i są jako takie oznaczone. Synapsy typu I działają pobudzająco , natomiast synapsy typu II działają hamująco . Każdy typ ma inny wygląd i znajduje się w różnych częściach neuronów pod jego wpływem.
Synapsy typu I (pobudzające) są zazwyczaj zlokalizowane na trzonach lub kolcach dendrytów, podczas gdy synapsy typu II (hamujące) są zazwyczaj zlokalizowane na ciele komórki. Ponadto synapsy typu I mają okrągłe pęcherzyki synaptyczne, podczas gdy pęcherzyki synaps typu II są spłaszczone. Materiał na błonach presynaptycznych i postsynaptycznych jest gęstszy w synapsie typu I niż w synapsie typu II, a szczelina synaptyczna typu I jest szersza. Wreszcie, aktywna strefa synapsy typu I jest większa niż ta w synapsie typu II.
Różne lokalizacje synaps typu I i typu II dzielą neuron na dwie strefy: pobudzające drzewo dendrytyczne i hamujące ciało komórki. Z perspektywy hamowania, pobudzenie przechodzi przez dendryty i rozprzestrzenia się na wzgórek aksonu, aby wyzwolić potencjał czynnościowy . Jeśli wiadomość ma zostać zatrzymana, najlepiej jest ją zatrzymać przez zastosowanie inhibicji na ciele komórki, w pobliżu wzgórka aksonu, z którego pochodzi potencjał czynnościowy. Innym sposobem konceptualizacji interakcji pobudzająco-hamującej jest wyobrażenie sobie, jak pobudzenie przezwycięża hamowanie. Jeśli ciało komórki jest normalnie w stanie zahamowania, jedynym sposobem na wytworzenie potencjału czynnościowego na wzgórku aksonu jest zmniejszenie inhibicji ciała komórki. W tej strategii „otwórz bramę” podniecający komunikat jest jak koń wyścigowy gotowy do jazdy po torze, ale najpierw należy usunąć blokującą bramkę startową.
Przykłady ważnych działań neuroprzekaźników
Jak wyjaśniono powyżej, jedynym bezpośrednim działaniem neuroprzekaźnika jest aktywacja receptora. Dlatego efekty działania systemu neuroprzekaźników zależą od połączeń neuronów korzystających z przekaźnika oraz chemicznych właściwości receptorów, z którymi łączy się przekaźnik.
Oto kilka przykładów ważnych działań neuroprzekaźników:
- Glutaminian jest stosowany w ogromnej większości szybkich synaps pobudzających w mózgu i rdzeniu kręgowym. Stosuje się go również w większości synaps, które są „modyfikowalne”, tj. zdolne do zwiększania lub zmniejszania siły. Uważa się, że modyfikowalne synapsy są głównymi elementami pamięci w mózgu. Nadmierne uwalnianie glutaminianu może nadmiernie stymulować mózg i prowadzić do ekscytotoksyczności powodującej śmierć komórek, co skutkuje drgawkami lub udarami. Ekscytotoksyczność odgrywa rolę w pewnych chorobach przewlekłych, w tym udar niedokrwienny mózgu , padaczka , stwardnienie rozsiane boczne , choroba Alzheimera , choroba Huntingtona , i choroba Parkinsona .
- GABA jest stosowany w ogromnej większości szybkich synaps hamujących praktycznie w każdej części mózgu. Wiele leków uspokajających/uspokajających działa poprzez wzmocnienie działania GABA. Odpowiednio, glicyna jest przekaźnikiem hamującym w rdzeniu kręgowym .
- Acetylocholina była pierwszym neuroprzekaźnikiem odkrytym w obwodowym i ośrodkowym układzie nerwowym. Aktywuje mięśnie szkieletowe w somatycznym układzie nerwowym i może pobudzać lub hamować narządy wewnętrzne układu autonomicznego. Wyróżnia się go jako przekaźnik w złączu nerwowo-mięśniowym łączącym nerwy ruchowe z mięśniami. Paralityczna kurara zatruta strzałami działa poprzez blokowanie transmisji w tych synapsach. Acetylocholina działa również w wielu rejonach mózgu, ale wykorzystując różne typy receptorów , w tym receptory nikotynowe i muskarynowe .
- Dopamina pełni wiele ważnych funkcji w mózgu; dotyczy to regulacji zachowań ruchowych, przyjemności związanych z motywacją, a także pobudzenia emocjonalnego. Odgrywa kluczową rolę w systemie nagród ; Choroba Parkinsona jest powiązana z niskim poziomem dopaminy, a schizofrenia z wysokim poziomem dopaminy.
- Serotonina jest neuroprzekaźnikiem monoaminowym . Większość jest produkowana i znajduje się w jelicie (około 90%), a pozostała część w neuronach ośrodkowego układu nerwowego . Jego funkcją jest regulowanie apetytu, snu, pamięci i uczenia się, temperatury, nastroju, zachowania, skurczu mięśni oraz funkcji układu sercowo-naczyniowego i hormonalnego . Spekuluje się, że odgrywa on rolę w depresji, ponieważ niektórzy pacjenci z depresją mają niższe stężenie metabolitów serotoniny w płynie mózgowo-rdzeniowym i tkance mózgowej.
- Norepinefryna, która jest syntetyzowana w ośrodkowym układzie nerwowym i nerwach współczulnych, moduluje reakcje autonomicznego układu nerwowego, wzorce snu, skupienie i czujność. Jest syntetyzowany z tyrozyny .
- Epinefryna, która jest również syntetyzowana z tyrozyny, jest uwalniana w nadnerczach i pniu mózgu. Odgrywa rolę we śnie, ze zdolnością do bycia i pozostawania czujnym oraz do reakcji walki lub ucieczki .
- Histamina działa z ośrodkowym układem nerwowym (OUN), w szczególności z podwzgórzem ( jądro guzowo-sutkowe ) i komórkami tucznymi OUN .
Układy neuroprzekaźników w mózgu
Neurony wyrażające pewne typy neuroprzekaźników czasami tworzą odrębne systemy, w których aktywacja systemu wpływa na duże objętości mózgu, zwane transmisją objętości . Główne układy neuroprzekaźników obejmują między innymi układ noradrenaliny (norepinefryny), układ dopaminy, układ serotoninowy i układ cholinergiczny . Aminy śladowe mają modulujący wpływ na neuroprzekaźnictwo w szlakach monoaminowych (tj. szlakach dopaminy, norepinefryny i serotoniny) w mózgu poprzez sygnalizację przez receptor związany z aminami śladowymi 1 . Oto krótkie porównanie tych systemów:
| System | Pochodzenie i projekcje ścieżki | Regulowane procesy i zachowania poznawcze |
|---|---|---|
| System noradrenaliny |
Szlaki noradrenergiczne :
|
|
| Układ dopaminy |
Szlaki dopaminergiczne :
|
|
| Układ histaminowy |
Szlaki histaminergiczne :
|
|
| Układ serotoninowy |
Szlaki serotoninergiczne :
Jądra
Jądra rostralne (RN):
|
|
| Układ acetylocholiny |
Ścieżki cholinergiczne :
Jądra cholinergiczne przodomózgowia (FCN):
Prążkowiowe tonicznie aktywne neurony cholinergiczne (TAN)
Brainstem jąder cholinergicznych (BCN)
|
|
| System adrenaliny |
Szlaki adrenergiczne :
|
Efekty leków
Zrozumienie wpływu leków na neuroprzekaźniki stanowi znaczną część inicjatyw badawczych w dziedzinie neuronauki . Większość neuronaukowców zaangażowanych w tę dziedzinę badań uważa, że takie wysiłki mogą jeszcze bardziej pogłębić naszą wiedzę o obwodach odpowiedzialnych za różne choroby i zaburzenia neurologiczne, a także o sposobach skutecznego leczenia, a kiedyś prawdopodobnie zapobiegania lub leczenia takich chorób.
Leki mogą wpływać na zachowanie poprzez zmianę aktywności neuroprzekaźników. Na przykład leki mogą zmniejszać szybkość syntezy neuroprzekaźników, wpływając na syntetyczny enzym(y) dla tego neuroprzekaźnika. Kiedy synteza neuroprzekaźników jest zablokowana, ilość neuroprzekaźników dostępnych do uwolnienia staje się znacznie niższa, co powoduje zmniejszenie aktywności neuroprzekaźników. Niektóre leki blokują lub stymulują uwalnianie określonych neuroprzekaźników. Alternatywnie, leki mogą zapobiegać gromadzeniu się neuroprzekaźników w pęcherzykach synaptycznych, powodując przeciekanie błon pęcherzyków synaptycznych. Leki, które zapobiegają wiązaniu się neuroprzekaźnika z jego receptorem, nazywane są antagonistami receptora . Na przykład leki stosowane w leczeniu pacjentów ze schizofrenią, takie jak haloperidol, chlorpromazyna i klozapina, są antagonistami receptorów dopaminy w mózgu. Inne leki działają poprzez wiązanie się z receptorem i naśladowanie normalnego neuroprzekaźnika. Takie leki nazywane są agonistami receptorów . Przykładem agonisty receptora jest morfina , opiat, który naśladuje działanie endogennego neuroprzekaźnika β-endorfiny w celu łagodzenia bólu. Inne leki zakłócają dezaktywację neuroprzekaźnika po jego uwolnieniu, przedłużając w ten sposób działanie neuroprzekaźnika. Można to osiągnąć poprzez blokowanie wychwytu zwrotnego lub hamowanie enzymów rozkładających. Wreszcie, leki mogą również zapobiegać występowaniu potencjału czynnościowego, blokując aktywność neuronów w ośrodkowym i obwodowym układzie nerwowym . Leki blokujące aktywność nerwową, takie jak tetrodotoksyna , są zazwyczaj śmiertelne.
Leki celujące w neuroprzekaźniki głównych układów wpływają na cały układ, co może wyjaśniać złożoność działania niektórych leków. Na przykład kokaina blokuje wychwyt zwrotny dopaminy z powrotem do neuronu presynaptycznego , pozostawiając cząsteczki neuroprzekaźnika w szczelinie synaptycznej na dłuższy czas. Ponieważ dopamina pozostaje dłużej w synapsie, neuroprzekaźnik nadal wiąże się z receptorami neuronu postsynaptycznego , wywołując przyjemną reakcję emocjonalną. Fizyczne uzależnienie od kokainy może wynikać z długotrwałego narażenia na nadmiar dopaminy w synapsach, co prowadzi do osłabienia niektórych receptorów postsynaptycznych. Po ustąpieniu skutków działania leku osoba może popaść w depresję z powodu zmniejszonego prawdopodobieństwa związania neuroprzekaźnika z receptorem. Fluoksetyna jest selektywnym inhibitorem wychwytu zwrotnego serotoniny (SSRI), który blokuje wychwyt zwrotny serotoniny przez komórkę presynaptyczną, co zwiększa ilość serotoniny obecną w synapsie, a ponadto umożliwia jej dłuższe pozostawanie tam, zapewniając potencjalne działanie naturalnego uwolniona serotonina. AMPT zapobiega konwersji tyrozyny do L-DOPA , prekursora dopaminy; rezerpina zapobiega gromadzeniu się dopaminy w pęcherzykach ; a deprenyl hamuje monoaminooksydazę (MAO)-B, a tym samym zwiększa poziom dopaminy.
| Narkotyk | Współdziała z: | Interakcja z receptorem: | Rodzaj | Efekty |
|---|---|---|---|---|
| Toksyna botulinowa (Botox) | Acetylocholina | – | Antagonista | Blokuje uwalnianie acetylocholiny w PNS
Zapobiega skurczom mięśni |
| Jad pająka czarnej wdowy | Acetylocholina | – | Agonista | Promuje uwalnianie acetylocholiny w PNS
Stymuluje skurcze mięśni |
| Neostygmina | Acetylocholina | – | – | Zaburza aktywność acetylocholinerazy
Zwiększa działanie ACh na receptory Stosowany w leczeniu miastenii |
| Nikotyna | Acetylocholina | Nikotynowy (mięsień szkieletowy) | Agonista | Zwiększa aktywność ACh
Zwiększa uwagę Efekty wzmacniające |
| d-tubokuraryna | Acetylocholina | Nikotynowy (mięsień szkieletowy) | Antagonista | Zmniejsza aktywność w miejscu receptora |
| Kurara | Acetylocholina | Nikotynowy (mięsień szkieletowy) | Antagonista | Zmniejsza aktywność ACh
Zapobiega skurczom mięśni |
| muskarynowy | Acetylocholina | Muscarinic (serce i mięśnie gładkie) | Agonista | Zwiększa aktywność ACh
Toksyczny |
| Atropina | Acetylocholina | Muscarinic (serce i mięśnie gładkie) | Antagonista | Blokuje zwężenie źrenic
Blokuje produkcję śliny |
| Skopolaminą ( Hioscyna ) | Acetylocholina | Muscarinic (serce i mięśnie gładkie) | Antagonista | Leczy chorobę lokomocyjną oraz nudności i wymioty pooperacyjne |
| AMPT | Dopamina/norepinefryna | – | – | Inaktywuje hydroksylazę tyrozynową i hamuje produkcję dopaminy |
| rezerpina | Dopamina | – | – | Zapobiega gromadzeniu się dopaminy i innych monoamin w pęcherzykach synaptycznych
Powoduje sedację i depresję |
| Apomorfina | Dopamina | Receptor D2 (autoreceptory presynaptyczne/receptory postsynaptyczne) | Antagonista (niska dawka)/Bezpośredni agonista (wysoka dawka) | Niska dawka: blokuje autoreceptory
Wysoka dawka: stymuluje receptory postsynaptyczne |
| Amfetamina | Dopamina/norepinefryna | – | Pośredni agonista | Uwalnia dopaminę, noradrenalinę i serotoninę
Bloki wychwytu zwrotnego |
| Metamfetamina | Dopamina/norepinefryna | – | – | Uwalnia dopaminę i noradrenalinę
Bloki wychwytu zwrotnego |
| Metylofenidat | Dopamina | – | – | Bloki wychwytu zwrotnego
Zwiększa uwagę i kontrolę impulsów w ADHD |
| Kokaina | Dopamina | – | Pośredni Agonista | Blokuje ponowne wychwytywanie do stanu przedsynaptycznego
Blokuje zależne od napięcia kanały sodowe Może być stosowany jako środek miejscowo znieczulający (krople do oczu) |
| Deprenyl | Dopamina | – | Agonista | Hamuje MAO-B
Zapobiega niszczeniu dopaminy |
| Chlorpromazyna | Dopamina | Receptory D2 | Antagonista | Blokuje receptory D2
Łagodzi halucynacje |
| MPTP | Dopamina | – | – | Wyniki w objawach podobnych do choroby Parkinsona |
| PCPA | Serotonina (5-HT) | – | Antagonista | Zaburza syntezę serotoniny poprzez blokowanie aktywności hydroksylazy tryptofanu |
| Ondansetron | Serotonina (5-HT) | 5-HT 3 receptory | Antagonista | Zmniejsza skutki uboczne chemioterapii i radioterapii
Zmniejsza nudności i wymioty |
| Buspiron | Serotonina (5-HT) | Receptory 5-HT 1A | Częściowy Agonista | Leczy objawy lęku i depresji |
| Fluoksetyna | Serotonina (5-HT) | wspiera wychwyt zwrotny 5-HT | SSRI | Hamuje wychwyt zwrotny serotoniny
Leczy depresję, niektóre zaburzenia lękowe i OCD Typowe przykłady: Prozac i Sarafem |
| Fenfluramina | Serotonina (5-HT) | – | – | Powoduje uwalnianie serotoniny
Hamuje wychwyt zwrotny serotoniny Stosowany jako środek tłumiący apetyt |
| Dietyloamid kwasu lizergowego | Serotonina (5-HT) | Postsynaptyczne receptory 5-HT 2A | Bezpośredni Agonista | Powoduje zniekształcenia percepcji wzrokowej
Stymuluje receptory 5-HT 2A w przodomózgowiu |
| Metylenodioksymetamfetamina ( MDMA ) | Serotonina (5-HT)/norepinfryna | – | – | Stymuluje uwalnianie serotoniny i noradrenaliny oraz hamuje wychwyt zwrotny
Powoduje efekty pobudzające i halucynogenne |
| Strychnina | Glicyna | – | Antagonista | Powoduje silne skurcze mięśni |
| Difenhydramina | Histamina | Przekracza barierę krew-mózg, powodując senność | ||
| Tetrahydrokannabinol (THC) | Endokannabinoidy | Receptory kannabinoidowe (CB) | Agonista | Wywołuje analgezję i sedację
Zwiększa apetyt Efekty poznawcze |
| Rymonabant | Endokannabinoidy | Receptory kannabinoidowe (CB) | Antagonista | Tłumi apetyt
Używany w rzucaniu palenia |
| MAFP | Endokannabinoidy | – | – | Hamuje FAAH
Wykorzystywane w badaniach w celu zwiększenia aktywności systemu kannabinoidowego |
| AM1172 | Endokannabinoidy | – | – | Blokuje wychwyt zwrotny kannabinoidów
Wykorzystywane w badaniach w celu zwiększenia aktywności systemu kannabinoidowego |
| Anandamid (endogenny) | – | Receptory kannabinoidowe (CB); 5-HT 3 receptory | – | Zmniejsz nudności i wymioty |
| Kofeina | Adenozyna | Receptory adenozyny | Antagonista | Blokuje receptory adenozyny
Zwiększa czuwanie |
| PCP | Glutaminian | Receptor NMDA | Pośredni antagonista | Blokuje miejsce wiązania PCP
Zapobiega przedostawaniu się jonów wapnia do neuronów Utrudnia naukę |
| AP5 | Glutaminian | Receptor NMDA | Antagonista | Blokuje miejsce wiązania glutaminianu na receptorze NMDA
Osłabia plastyczność synaptyczną i niektóre formy uczenia się |
| Ketamina | Glutaminian | Receptor NMDA | Antagonista | Używany jako znieczulenie
Wywołuje stan podobny do transu, pomaga w uśmierzaniu bólu i sedacji |
| NMDA | Glutaminian | Receptor NMDA | Agonista | Używany w badaniach do badania receptora NMDA
Receptor jonotropowy |
| AMPA | Glutaminian | receptor AMPA | Agonista | Używany w badaniach do badania receptora AMPA
Receptor jonotropowy |
| Alliglicyna | GABA | – | – | Hamuje syntezę GABA
Powoduje drgawki |
| Muscymoł | GABA | Receptor GABA | Agonista | Powoduje sedację |
| Bikukulina | GABA | Receptor GABA | Antagonista | Przyczyny napadów |
| Benzodiazepiny | GABA | Receptor GABA A | Pośredni agoniści | Niepokój, sedacja, zaburzenia pamięci, rozluźnienie mięśni |
| Barbiturany | GABA | Receptor GABA A | Pośredni agoniści | Sedacja, zaburzenia pamięci, rozluźnienie mięśni |
| Alkohol | GABA | Receptor GABA | Pośredni agonista | Sedacja, zaburzenia pamięci, rozluźnienie mięśni |
| Pirotoksyna | GABA | Receptor GABA A | Pośredni antagonista | Wysokie dawki powodują drgawki |
| Tiagabina | GABA | – | Antagonista | Antagonista transportera GABA
Zwiększ dostępność GABA Zmniejsza prawdopodobieństwo napadów |
| Moklobemid | Noradrenalina | – | Agonista | Blokuje MAO-A w leczeniu depresji |
| Idazoksan | Noradrenalina | autoreceptory alfa-2 adrenergiczne | Agonista | Blokuje autoreceptory alfa-2
Używany do badania układu noradrenaliny |
| Kwas fuzarowy | Noradrenalina | – | – | Hamuje aktywność beta-hydroksylazy dopaminy, która blokuje produkcję norepinefryny
Służy do badania układu noradrenaliny bez wpływu na układ dopaminy |
| Opiaty ( opium , morfina , heroina i oksykodon ) | Opioidy | Receptor opioidowy | Agoniści | Działanie przeciwbólowe, uspokajające i wzmacniające |
| Nalokson | Opioidy | – | Antagonista | Odwraca objawy zatrucia lub przedawkowania opiatów (tj. problemy z oddychaniem) |
Agoniści
Agonista jest substancją chemiczną zdolną do wiązania się z receptorem, takim jak receptor neuroprzekaźnika, i inicjowania tej samej reakcji typowo wytwarzanej przez wiązanie substancji endogennej. Agonista neuroprzekaźnika zainicjuje zatem tę samą odpowiedź receptorową, co przekaźnik. W neuronach lek agonistyczny może bezpośrednio lub pośrednio aktywować receptory neuroprzekaźników. Agonistów bezpośrednio wiążących można dalej scharakteryzować jako pełnych agonistów , częściowych agonistów , odwrotnych agonistów .
Bezpośredni agoniści działają podobnie do neuroprzekaźnika, wiążąc się bezpośrednio z powiązanym z nim miejscem (miejscami) receptorowymi, które mogą być zlokalizowane na neuronie presynaptycznym lub postsynaptycznym, lub na obu. Zazwyczaj receptory neuroprzekaźników są zlokalizowane na neuronie postsynaptycznym, podczas gdy autoreceptory neuroprzekaźników są zlokalizowane na neuronie presynaptycznym, tak jak w przypadku neuroprzekaźników monoaminowych ; w niektórych przypadkach neuroprzekaźnik wykorzystuje neuroprzekaźnictwo wsteczne , rodzaj sygnalizacji zwrotnej w neuronach, gdzie neuroprzekaźnik jest uwalniany postsynaptycznie i wiąże się z docelowymi receptorami zlokalizowanymi na neuronie presynaptycznym. Nikotyna , związek występujący w tytoniu , jest bezpośrednim agonistą większości nikotynowych receptorów acetylocholiny , zlokalizowanych głównie w neuronach cholinergicznych . Opiaty , takie jak morfina , heroina , hydrokodon , oksykodon , kodeina i metadon , są agonistami receptora μ-opioidowego ; to działanie pośredniczy w ich właściwościach euforycznych i przeciwbólowych .
Pośredni agoniści zwiększają wiązanie neuroprzekaźników z ich receptorami docelowymi poprzez stymulowanie uwalniania lub zapobieganie wychwytowi zwrotnemu neuroprzekaźników. Niektórzy agoniści pośredni wyzwalają uwalnianie neuroprzekaźników i zapobiegają wychwytowi zwrotnemu neuroprzekaźników . Amfetamina , na przykład, jest pośrednim agonistą postsynaptycznych receptorów dopaminy, norepinefryny i serotoniny w każdym z ich odpowiednich neuronów; wytwarza zarówno uwalnianie neuroprzekaźników do neuronu presynaptycznego , a następnie do szczeliny synaptycznej , i zapobiega ich ponownemu wychwytowi ze szczeliny synaptycznej poprzez aktywację TAAR1 , presynaptycznego receptora sprzężonego z białkiem G , i wiązanie z miejscem na VMAT2 , rodzaju transportera monoamin zlokalizowanego na synapsie . pęcherzyki w neuronach monoaminowych .
Antagoniści
Antagonista to substancja chemiczna działająca w organizmie w celu zmniejszenia aktywności fizjologicznej innej substancji chemicznej (jako opiat); zwłaszcza taki, który przeciwstawia się działaniu na układ nerwowy leku lub substancji występującej naturalnie w organizmie poprzez łączenie się i blokowanie jego receptora nerwowego.
Istnieją dwa główne typy antagonistów: antagoniści działający bezpośrednio i antagoniści działający pośrednio:
- Antagonista działający bezpośrednio – zajmuje przestrzeń obecną na receptorach, które w innym przypadku są zajmowane przez same neuroprzekaźniki. Powoduje to blokowanie neuroprzekaźników przed wiązaniem się z receptorami. Najczęstszy nazywa się Atropina.
- Antagoniści działający pośrednio – leki hamujące uwalnianie/produkcję neuroprzekaźników (np. rezerpina ).
Antagoniści leków
Lek antagonistyczny to taki, który przyłącza się (lub wiąże) do miejsca zwanego receptorem bez aktywacji tego receptora w celu wywołania odpowiedzi biologicznej. Dlatego mówi się, że nie ma wewnętrznej aktywności. Antagonista może być również nazywany „blokerem” receptora, ponieważ blokuje działanie agonisty w miejscu. Efekty farmakologiczne antagonisty powodują zatem zapobieganie wiązaniu się z nim i aktywacji agonistów odpowiedniego miejsca receptora (np. leków, hormonów, neuroprzekaźników). Antagoniści mogą być „konkurencyjni” lub „nieodwracalni”.
Konkurencyjny antagonista konkuruje z agonistą o wiązanie z receptorem. Wraz ze wzrostem stężenia antagonisty wiązanie agonisty jest stopniowo hamowane, co powoduje zmniejszenie odpowiedzi fizjologicznej. Wysokie stężenie antagonisty może całkowicie zahamować odpowiedź. To hamowanie można jednak odwrócić przez zwiększenie stężenia agonisty, ponieważ agonista i antagonista współzawodniczą o wiązanie z receptorem. Konkurencyjnych antagonistów można zatem scharakteryzować jako przesuwające w prawo zależność dawka-odpowiedź dla agonisty. W obecności kompetycyjnego antagonisty, aby wywołać taką samą odpowiedź obserwowaną przy braku antagonisty, potrzebne jest zwiększone stężenie agonisty.
Nieodwracalny antagonista wiąże się tak silnie z receptorem, że czyni go niedostępnym dla wiązania z agonistą. Nieodwracalni antagoniści mogą nawet tworzyć kowalencyjne wiązania chemiczne z receptorem. W każdym przypadku, jeśli stężenie nieodwracalnego antagonisty jest wystarczająco wysokie, liczba niezwiązanych receptorów pozostających do wiązania agonisty może być tak niska, że nawet wysokie stężenia agonisty nie wywołują maksymalnej odpowiedzi biologicznej.
Prekursory
|
|
Podczas gdy przyjmowanie prekursorów neuroprzekaźników zwiększa syntezę neuroprzekaźników, dowody na to, czy uwalnianie neuroprzekaźników i postsynaptyczne odpalanie receptorów są zwiększone , są mieszane . Nawet przy zwiększonym uwalnianiu neuroprzekaźników nie jest jasne, czy spowoduje to długotrwały wzrost siły sygnału neuroprzekaźników, ponieważ układ nerwowy może przystosować się do zmian, takich jak zwiększona synteza neuroprzekaźników, a zatem może utrzymywać ciągłe pobudzanie. Niektóre neuroprzekaźniki mogą odgrywać rolę w depresji i istnieją dowody sugerujące, że przyjmowanie prekursorów tych neuroprzekaźników może być przydatne w leczeniu łagodnej i umiarkowanej depresji.
Prekursory katecholamin i amin śladowych
L- DOPA , prekursor dopaminy, która przenika przez barierę krew-mózg , jest stosowana w leczeniu choroby Parkinsona . W przypadku pacjentów z depresją, u których w grę wchodziniska aktywność neuroprzekaźnika noradrenaliny , istnieje niewiele dowodów na korzyść z podawania prekursora neuroprzekaźnika. L- fenyloalanina i L- tyrozyna są prekursorami dopaminy , norepinefryny i epinefryny . Te konwersje wymagają witaminy B6 , witaminy C i S-adenozylometioniny . Kilka badań sugeruje potencjalne działanie przeciwdepresyjne L-fenyloalaniny i L-tyrozyny, ale jest jeszcze wiele miejsca na dalsze badania w tej dziedzinie.
Prekursory serotoniny
Okazuje się , że podawanie L-tryptofanu , prekursora serotoniny , podwaja produkcję serotoniny w mózgu. Jest znacznie skuteczniejszy niż placebo w leczeniu łagodnej i umiarkowanej depresji. Konwersja ta wymaga witaminy C . 5-hydroksytryptofan (5-HTP), również prekursor serotoniny , jest skuteczniejszy niż placebo.
Choroby i zaburzenia
Choroby i zaburzenia mogą również wpływać na określone układy neuroprzekaźników. Poniżej przedstawiono zaburzenia związane ze wzrostem, spadkiem lub brakiem równowagi niektórych neuroprzekaźników.
Dopamina :
Na przykład problemy z wytwarzaniem dopaminy (głównie w istocie czarnej ) mogą skutkować chorobą Parkinsona , zaburzeniem, które wpływa na zdolność osoby do poruszania się tak, jak chce, powodując sztywność, drżenie lub drżenie i inne objawy. Niektóre badania sugerują, że zbyt mała lub zbyt duża ilość dopaminy lub problemy z jej używaniem w obszarach mózgu myślących i czujących mogą odgrywać rolę w zaburzeniach, takich jak schizofrenia lub zespół nadpobudliwości psychoruchowej z deficytem uwagi (ADHD). Dopamina jest również zaangażowana w uzależnienie i zażywanie narkotyków, ponieważ większość narkotyków rekreacyjnych powoduje napływ dopaminy do mózgu (zwłaszcza opioidów i metamfetaminy ), co powoduje przyjemne uczucie, dlatego użytkownicy nieustannie pragną narkotyków.
Serotonina :
Podobnie, po niektórych badaniach sugerujących, że leki blokujące recykling lub wychwyt zwrotny serotoniny wydawały się pomagać niektórym osobom z rozpoznaniem depresji, wysunięto teorię, że osoby z depresją mogą mieć niższy niż normalny poziom serotoniny. Choć szeroko spopularyzowana, teoria ta nie znalazła potwierdzenia w późniejszych badaniach. Dlatego selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) stosuje się w celu zwiększenia ilości serotoniny w synapsach.
Glutaminian :
Co więcej, problemy z wytwarzaniem lub stosowaniem glutaminianu zostały sugestywnie i wstępnie powiązane z wieloma zaburzeniami psychicznymi, w tym autyzmem , zaburzeniem obsesyjno-kompulsywnym (OCD), schizofrenią i depresją . Zbyt duża ilość glutaminianu została powiązana z chorobami neurologicznymi, takimi jak choroba Parkinsona , stwardnienie rozsiane , choroba Alzheimera , udar i ALS (stwardnienie zanikowe boczne).
Brak równowagi neuroprzekaźników
Ogólnie rzecz biorąc, nie ma naukowo ustalonych „norm” dla odpowiednich poziomów lub „równowagi” różnych neuroprzekaźników. W większości przypadków pragmatycznie niemożliwe jest nawet zmierzenie poziomu neuroprzekaźników w mózgu lub ciele w dowolnym momencie. Neuroprzekaźniki regulują wzajemnie swoje uwalnianie, a słabe stałe nierównowagi w tej wzajemnej regulacji były powiązane z temperamentem zdrowych ludzi. Silne zaburzenia równowagi lub zakłócenia w układach neuroprzekaźników są związane z wieloma chorobami i zaburzeniami psychicznymi. Należą do nich choroba Parkinsona, depresja, bezsenność, zespół nadpobudliwości psychoruchowej z deficytem uwagi (ADHD), lęk, utrata pamięci, dramatyczne zmiany wagi i uzależnienia. Przewlekły stres fizyczny lub emocjonalny może przyczyniać się do zmian w układzie neuroprzekaźników. Genetyka również odgrywa rolę w aktywności neuroprzekaźników. Oprócz używania rekreacyjnego, leki, które bezpośrednio i pośrednio oddziałują z jednym lub więcej przekaźnikiem lub jego receptorem, są powszechnie przepisywane w przypadku problemów psychiatrycznych i psychologicznych. Warto zauważyć, że leki wchodzące w interakcje z serotoniną i noradrenaliną są przepisywane pacjentom z problemami, takimi jak depresja i lęk – chociaż pogląd, że istnieje wiele solidnych dowodów medycznych na poparcie takich interwencji, jest szeroko krytykowany. Badania wykazały, że brak równowagi dopaminy ma wpływ na stwardnienie rozsiane i inne zaburzenia neurologiczne.
Eliminacja neuroprzekaźników
Neuroprzekaźnik musi zostać rozłożony po dotarciu do komórki postsynaptycznej, aby zapobiec dalszemu przekazywaniu sygnału pobudzającego lub hamującego. Pozwala to na wytwarzanie nowych sygnałów z sąsiednich komórek nerwowych. Kiedy neuroprzekaźnik zostanie wydzielony do szczeliny synaptycznej, wiąże się ze specyficznymi receptorami na komórce postsynaptycznej, generując w ten sposób postsynaptyczny sygnał elektryczny. Nadajnik musi być następnie szybko usunięty, aby umożliwić komórce postsynaptycznej zaangażowanie się w kolejny cykl uwalniania, wiązania i generowania sygnału neuroprzekaźnika. Neuroprzekaźniki są terminowane na trzy różne sposoby:
- Dyfuzja – neuroprzekaźnik odrywa się od receptora, dryfując ze szczeliny synaptycznej, gdzie zostaje wchłonięty przez komórki glejowe .
- Degradacja enzymatyczna – rozkładają ją specjalne substancje chemiczne zwane enzymami . Zwykle astrocyty absorbują nadmiar neuroprzekaźników i przekazują je enzymom lub pompują je bezpośrednio do neuronu presynaptycznego.
- Wychwyt zwrotny – reabsorpcja neuroprzekaźnika do neuronu. Transportery lub białka transportu błonowego pompują neuroprzekaźniki ze szczeliny synaptycznej z powrotem do zakończeń aksonów (neuronów presynaptycznych), gdzie są przechowywane.
Na przykład, cholina jest pobierana i poddawana recyklingowi przez neuron presynaptyczny, aby zsyntetyzować więcej ACh. Inne neuroprzekaźniki, takie jak dopamina, są w stanie dyfundować z docelowych połączeń synaptycznych i są eliminowane z organizmu przez nerki lub niszczone w wątrobie. Każdy neuroprzekaźnik ma bardzo specyficzne ścieżki degradacji w punktach regulacyjnych, które mogą być celem systemu regulacyjnego organizmu lub leków.
Zobacz też
Uwagi
Bibliografia
Zewnętrzne linki
- Molekularna biologia komórki. Wydanie IV. Sekcja 21.4: Neuroprzekaźniki, synapsy i transmisja impulsów
- Galeria zdjęć wyrażeń molekularnych: kolekcja neuroprzekaźników
- Neuroprzekaźniki w mózgu
- Endogenne neuroaktywne zewnątrzkomórkowe przetworniki sygnału
- Neuroprzekaźnik w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- witryna neuronauka dla dzieci
- witryna eksploratora mózgu