Nitrozamina - Nitrosamine
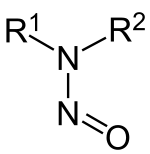
Nitrozoaminy (albo bardziej formalnie N -Nitrosamines ) są związki organiczne o strukturze chemicznej R 2 N-N = O, w którym R oznacza zazwyczaj grupę alkilową . Zawierają grupę nitrozową (NO + ) związaną z deprotonowaną aminą . Większość nitrozoamin ma działanie rakotwórcze u zwierząt. Niedawny przegląd systematyczny potwierdza „pozytywny związek między spożyciem azotynów i nitrozoaminy a rakiem żołądka, między spożyciem mięsa i przetworzonego mięsa a rakiem żołądka a rakiem przełyku oraz między spożyciem konserwowanych ryb, warzyw i wędzonej żywności a rakiem żołądka, ale nie jest rozstrzygający”. .
Chemia
Chemia organiczna nitrozoamin jest dobrze rozwinięta pod względem ich syntezy, struktury i reakcji. Zwykle powstają w wyniku reakcji kwasu azotawego (HNO 2 ) i amin drugorzędowych.
- HONO + R 2 NH → R 2 N-NO + H 2 O
Kwas azotawy zwykle powstaje w wyniku protonowania azotynu . Ta metoda syntezy jest odpowiednia do wytwarzania nitrozoamin w pewnych warunkach biologicznych.
W odniesieniu do struktury, C 2 N 2 O rdzeń nitrozoamin jest płaska, jak ustalono przez krystalografię rentgenowską . Odległości NN i NO wynoszą odpowiednio 132 i 126 pm w dimetylonitrozoaminie , jednym z najprostszych przedstawicieli dużej klasy N-nitrozoamin
Nitrozoaminy nie są bezpośrednio rakotwórcze. Aktywacja metaboliczna jest wymagana do przekształcenia ich w środki alkilujące, które modyfikują zasady w DNA, wywołując mutacje. Konkretne środki alkilujące różnią się w zależności od nitrozoaminy, ale proponuje się, aby wszystkie zawierały centra alkilodiazoniowe .
Historia i występowanie
W 1956 roku dwaj brytyjscy naukowcy, John Barnes i Peter Magee, donieśli, że prosty członek dużej klasy N-nitrozoamin, dimetylonitrozoamina , powodował powstawanie guzów wątroby u szczurów. Kolejne badania wykazały, że około 90% z 300 badanych nitrozoamin miało działanie rakotwórcze u wielu różnych zwierząt.
Ekspozycja na tytoń
Typowym sposobem, w jaki zwykli konsumenci są narażeni na nitrozoaminy, jest używanie tytoniu i dym papierosowy. Specyficzne dla tytoniu nitrozoaminy można również znaleźć w amerykańskiej tabace zanurzanej , tytoniu do żucia i, w znacznie mniejszym stopniu, snusie (127,9 ppm dla amerykańskiej tabaki dipowej w porównaniu do 2,8 ppm w tabace szwedzkiej lub snusie).
Ekspozycja dietetyczna
Nitrozoaminy powstają w wyniku reakcji azotynów i amin drugorzędowych . Azotyny stosuje się jako konserwanty żywności, np. wędlin. Aminy wtórne powstają w wyniku degradacji białek (pożywienia).
Spożycie azotynów i nitrozoaminy wiąże się z ryzykiem raka żołądka i raka przełyku .
Niekorzystna reakcja z dimetyloaminą
W latach 70. u norweskich zwierząt gospodarskich stwierdzono podwyższoną częstość występowania raka wątroby po karmieniu ich mączką śledziową konserwowaną azotynem sodu . Azotyn sodu reagował z dimetyloaminą w rybach i wytworzył dimetylonitrozoaminę , którą w badaniach w latach pięćdziesiątych uznano za rakotwórczą.
Przeciwstawne reakcje z kwasem askorbinowym
Na tworzenie endogennej nitrozoaminy może wpływać kwas askorbinowy , hamując lub zwiększając jego powstawanie, w zależności od tego, czy kwas askorbinowy jest spożywany w połączeniu z nim, w przeciwieństwie do tego, że efekt jest odwracany przez czynniki związane z tłuszczem spożytym w tym samym czasie.
W przypadku powstawania rakotwórczych nitrozoamin w żołądku z azotynu pokarmowego (stosowanego jako środek konserwujący do przetworów mięsnych), kwas askorbinowy, poprzez inhibicję, wyraźnie zmniejsza powstawanie nitrozoamin przy braku tłuszczu w posiłku. Jednak gdy 10% posiłku to tłuszcz, efekt jest odwrotny, tak że kwas askorbinowy znacznie zwiększa tworzenie nitrozoaminy. Badanie drożdży wykazało, że N-nitrozoaminy mogą zaburzać metabolizm aminokwasów i funkcje mitochondriów.
Przykłady
| Nazwa substancji | numer CAS | Synonimy | Formuła molekularna | Wygląd fizyczny | Kategoria rakotwórczości |
|---|---|---|---|---|---|
| N -Nitrosonornikotyna | 16543-55-8 | NNN | C 9 H 11 N 3 O | Jasnożółte, niskotopliwe ciało stałe | |
| 4-(metylonitrozamino)-1-(3-pirydylo)-1-butanon | 64091-91-4 | NNK, 4′-(nitrozometyloamino)-1-(3-pirydylo)-1-butanon | C 10 H 15 N 3 O 2 | Jasnożółty olej | |
| N- nitrozodimetyloamina | 62-75-9 | Dimetylonitrozamina, N , N- dimetylonitrozamina, NDMA, DMN | C, 2 H 6 N 2 O | Żółty płyn | EPA-B2; IARC-2A; rakotwórczy OSHA ; TLV -A3 |
| N- nitrozodietyloamina | 55-18-5 | Diethylnitrosamide, diethylnitrosamine, N , N -diethylnitrosamine, N -etylo- N -nitrosoethanamine, diethylnitrosamine Dana, DENA DEN, NDEA | C 4 H 10 N 2 O | Żółty płyn | EPA- B2; IARC-2A |
| 4-(Metylonitrozoamino)-1-(3-pirydylo)-1-butanol | 76014-81-8 | NNAL | |||
| N -Nitrosoanabazyna | 37620-20-5 | ZŁAPAĆ | C 10 H 13 N 3 O | Żółty olej | IARC -3 |
| N- nitrozoanatabina | 71267-22-6 | NAT | C 10 H 11 N 3 O | Klarowny olej o barwie żółtej do pomarańczowej | IARC-3 |
Zobacz też
- Przypomina bloker receptora angiotensyny II
- Hydrazyny pochodzące z tych nitrozoamin, np. UDMH , są również rakotwórcze.
- Możliwe zagrożenia zdrowotne warzyw marynowanych
- Zanieczyszczenia rakotwórcze ranitydyny
- Nitrozoaminy specyficzne dla tytoniu
- Valsartan wspomina
Dodatkowe czytanie
- Altkofer, Werner; Braune'a, Stefana; Ellendt, Kathi; Kettl-Grömminger, Margit; Steiner, Gabriela (2005). „Migracja nitrozoamin z wyrobów gumowych – czy balony i prezerwatywy są szkodliwe dla zdrowia człowieka?”. Odżywianie molekularne i badania żywności . 49 (3): 235–238. doi : 10.1002/mnfr.200400050 . PMID 15672455 .
- Proktor Robert N. (2012). Złoty holokaust: Geneza katastrofy papierosowej i sprawa abolicji . Berkeley: Wydawnictwo Uniwersytetu Kalifornijskiego. Numer ISBN 9780520950436. OCLC 784884555 .