Guz chromochłonny - Pheochromocytoma
| Guz chromochłonny | |
|---|---|
| Inne nazwy | Guz chromochłonny nadnerczy, guz rdzenia nadnerczy, nowotwory z komórek chromafinowych, przyzwojak |
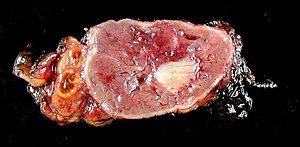 | |
| Prawidłowa pozostałość nadnercza (po lewej) z guzem chromochłonnym (po prawej) obejmującym rdzeń nadnerczy | |
| Wymowa | |
| Specjalność | Endokrynologia , onkologia |
| Objawy | Nadciśnienie , tachykardia , pocenie się , ból głowy , bladość |
| Komplikacje | Kryzys nadciśnieniowy |
| Metoda diagnostyczna | Podwyższone stężenie wolnych metanefryn w osoczu , katecholamin osocza lub katecholamin w moczu |
| Leczenie | Chirurgia, chemioterapia, radioterapia i środki farmakologiczne |
| Częstotliwość | 0,8 na 100 000 osobolat |
Guz chromochłonny ( PHEO lub PCC ) jest rzadkim nowotworem rdzenia nadnerczy złożonym z komórek chromochłonnych, znanych również jako pheochromocyty. Kiedy guz złożony z tych samych komórek co guz chromochłonny rozwija się poza nadnerczem, nazywa się go przyzwojakiem . Te guzy neuroendokrynne są zdolne do wytwarzania i uwalniania ogromnych ilości katecholamin , metanefryn lub metoksytyraminy, co powoduje najczęstsze objawy, w tym nadciśnienie (wysokie ciśnienie krwi), tachykardię (szybkie bicie serca) i pocenie się (pocenie). Jednak nie wszystkie z tych guzów wydzielają katecholaminy. Te, które nie są określane jako biochemicznie ciche i są zlokalizowane głównie w głowie i szyi . Podczas gdy pacjenci z biochemicznie cichą chorobą nie będą cierpieć z powodu typowych objawów chorobowych opisanych powyżej, guzy rosną i uciskają otaczające struktury głowy i szyi, co może powodować pulsacyjny szum w uszach (dzwonienie w uszach), utratę słuchu, uczucie pełności słuchu, duszność (trudności w oddychaniu) i chrypka. Podczas gdy guzy głowy i szyi są przywspółczulne, ich współczulne odpowiedniki zlokalizowane są głównie w jamie brzusznej i miednicy, szczególnie skoncentrowane w narządzie Zuckerkandla .
Symptomy i objawy
Te oznaki i objawy o pheochromocytoma są te związane z współczulnego układu nerwowego nadpobudliwość . Klasyczna triada obejmuje bóle głowy (prawdopodobnie związane z podwyższonym ciśnieniem krwi lub nadciśnieniem ), tachykardię / podwyższoną częstość akcji serca i obfite pocenie (nadmierne pocenie się, szczególnie w nocy, znane również jako nadmierna potliwość ). Jednak jest mało prawdopodobne, aby pacjenci odczuwali ciągłe objawy. Ze względu na napadowy charakter syntezy i uwalniania katecholamin pacjenci mogą doświadczać „ataków” lub „zaklęć”, w których nagle są przytłoczeni oznakami i objawami guza. Ataki mogą wystąpić spontanicznie (bez ostrzeżenia) lub mogą być wywołane przez różne środki farmaceutyczne, pokarmy, śródoperacyjną manipulację guzem, intubację lub podczas indukcji znieczulenia.

| Styl życia | Leki | Dieta |
|---|---|---|
| Wysiłek fizyczny | Histamina | Ser |
| Niepokój/Stres | Metoklopramid | Fermentowane wino/piwo |
| Trauma/Ból | Glukagon | Pomidory |
| Oddawanie moczu | ACTH | Ziarna kawy |
Chociaż powyższe objawy są klasyczne, zgłoszono inne powszechne objawy kliniczne i obejmują (w dowolnej kolejności)
- Bladość
- Nietolerancja ciepła
- Utrata masy ciała
- Dyskomfort w klatce piersiowej i/lub w jamie brzusznej
- Nudności / Wymioty
- Zaparcie
-
Niedociśnienie ortostatyczne
- Medycznie zdefiniowany jako spadek skurczowego ciśnienia krwi (górna liczba) o 20 mm Hg lub rozkurczowego ciśnienia krwi (dolna liczba) o 10 mm Hg po zmianie pozycji z leżącej lub siedzącej na stojącą
- Uczucie oszołomienia lub zawrotów głowy po szybkiej zmianie pozycji
- Manifestacje psychiatryczne
- Lęk , Ataki paniki , Nerwowość, Drżenie
- Hiperglikemia (wysoki poziom cukru we krwi)
Komplikacje
Chociaż objawy guza chromochłonnego są dość powszechne, chorobę tę określa się mianem „wielkiego naśladowcy”. Literatura podaje, że zaledwie 0,1% pacjentów z nadciśnieniem diagnozuje się to rzadkie zaburzenie endokrynologiczne, a pacjenci z objawami są często myleni z dużo częstszymi chorobami. Ponieważ objawy są często napadowe (epizodyczne/sporadyczne), pacjenci mogą nie szukać natychmiastowego leczenia, ponieważ problem „znika sam”. Co więcej, w idealnym scenariuszu klinicznym (starsza kobieta po pięćdziesiątce) spontaniczne napady zaczerwienienia, pocenia się i przyspieszone bicie serca mogą być mylone z uderzeniami gorąca związanymi z okresem przedmenopauzalnym . Niekontrolowany guz chromochłonny jest niebezpieczny i może prowadzić do poważnych powikłań, w tym śmierci. Sercowo- System jest najczęściej zaangażowane.
Układu sercowo-naczyniowego
- Przełom nadciśnieniowy : stany nadciśnieniowe związane z guzem chromochłonnym są jednym z najbardziej przerażających objawów klinicznych. Ataki są losowe i mogą wystąpić wtórnie do wyzwalacza (patrz „Oznaki i objawy” powyżej) lub spontanicznie po wyrzuceniu katecholamin. Dominującym objawem jest podwyższone skurczowe ciśnienie krwi (>200 mmHg), które nie odpowiada na tradycyjne schematy leczenia i grozi uszkodzeniem narządów końcowych . Pacjenci wymagają natychmiastowego leczenia ratującego życie, aby zapobiec dalszemu uszkodzeniu innych narządów i/lub śmierci.
- Niedokrwienie /zawał mięśnia sercowego: Zawał serca jest często spowodowany znacznym nagromadzeniem się blaszki miażdżycowej ( miażdżycy ) wnaczyniach wieńcowych . Pacjenci z guzem chromochłonnym nadnerczy zgłaszają się z zawałem mięśnia sercowego pomimo ogólnego braku odkładania się blaszki miażdżycowej, co wskazuje na inny mechanizm zawału mięśnia sercowego. Obecne badania stawiają hipotezę, że guz wydziela ogromne ilości katecholamin, które bezpośrednio oddziałują ztkanką mięśnia sercowego (serca) i wywierają negatywne skutki, w tym pozbawienie tlenu, prowadząc do przyspieszonego bliznowacenia i śmierci komórek.
- Toksyczne zapalenie mięśnia sercowego : nawet u pacjentów bez uszkodzenia mięśnia sercowego , nadmierna ilość katecholamin może powodować nieprawidłowe zmiany odcinka ST w EKG . Przypuszcza się, że noradrenalina (katecholamina) powoduje uszkodzenie tkanki serca poprzez hamowanie przepływu krwi wieńcowej i pozbawienie komórek tlenu, co prowadzi do niedokrwienia tkanki. Na szczęście, po wycięciu guza i późniejszym stłumieniu katecholamin, uszkodzenia okazały się odwracalne.
- Kardiomiopatia : Guz chromochłonny jest związany z różnymi typami kardiomiopatii, w tym (zapalenie mięśnia sercowego, patrz powyżej), kardiomiopatia rozstrzeniowa oraz kardiomiopatia wywołana stresem lub takotsubo . Podobnie jak w przypadku innych powikłań sercowo-naczyniowych, nadmiar katecholamin jest odpowiedzialny za zwiększone obciążenie mięśnia sercowego i znaczny stres fizjologiczny. Aktualna literatura wskazuje, że większość uszkodzeń wywołanych katecholaminą jest odwracalna, co wzmacnia argumenty za wczesną i dokładną diagnozą, aby umożliwić przebudowę serca i zapobiec dalszym zniszczeniom.
- Arytmie : Tachykardia zatokowa jest najczęstszym nieprawidłowym rytmem serca związanym z guzem chromochłonnym i jest odczuwany przez pacjentów jako uczucie „trzepotania serca” lub kołatanie serca . Zgłoszono równieżwiele innych tachyarytmii (szybkie tętno).
System nerwowy
- Wypadek mózgowo-naczyniowy (udar): W wielu raportach szczegółowo opisano przemijające ataki niedokrwienne lub udary u pacjentów z guzem chromochłonnym. W badaniu 130 pacjentów z guzem chromochłonnym u 7 pacjentów zdiagnozowano przemijający atak niedokrwienny (całkowicie ustąpił deficyt neurologiczny), a u 3 pacjentów wystąpił udar z utrzymującymi się objawami.
- Ból głowy : Bóle głowy są jednym z głównych objawów klinicznych guza chromochłonnego i mogą powodować wyniszczający ból. Większość badanych pacjentów zgłasza, że ich ból zaczyna się i kończy nagle, bez ostrzeżenia i opisuje ból jako silny, obustronny pulsujący (chociaż skala nasilenia nie została opublikowana). Podczas gdy 71% badanych pacjentów zgłaszało bóle głowy, nieco ponad 20% dotkniętych nimi pacjentów popierało związane z nimi nudności , wymioty, światłowstręt lub fonofobię , które są zwykle związane z migrenami .
Układ moczowy
- Ostra niewydolność nerek : W kilku doniesieniachjako główny objaw pojawia się szczegółowa rabdomioliza (szybki rozpad mięśni szkieletowych), prowadząca do ostrego uszkodzenia nerek i konieczności przejściowej dializy u nierozpoznanego pacjenta z guzem chromochłonnym. Niewydolność nerek jest spowodowana uszkodzeniem mięśni wywołanym katecholaminą. Norepinefryna powoduje zwężenie naczyń krwionośnych, ograniczając w ten sposób przepływ krwi i wywołując niedokrwienie.
Zespół dysfunkcji wielonarządowej (MODS) : Spowodowana przez podwyższoną odpowiedź zapalną, dysfunkcja wielonarządowa jest poważnym, zagrażającym życiu stanem nagłym ze wzrostem śmiertelności w zależności od liczby zaangażowanych układów. MODS związany z guzem chromochłonnym jest związany z niewydolnością wielonarządową, hipertermią > 40 stopni Celsjusza, objawami neurologicznymi i niestabilnością sercowo-naczyniową skutkującą hipo lub nadciśnieniem. W przeciwieństwie do przełomu nadciśnieniowego, MODS związane z guzem chromochłonnym mogą nie reagować na tradycyjne leki alfa-receptorowe i mogą wymagać natychmiastowego wycięcia chirurgicznego, jeśli nie zostanie osiągnięta stabilność kliniczna.
Genetyka
Aktualne szacunki przewidują, że ponad 40% wszystkich guzów chromochłonnych jest związanych z dziedziczną mutacją podatności linii zarodkowej . Z pozostałych 60% guzów ponad 30% jest związanych z mutacją somatyczną . Biorąc pod uwagę wysoki związek z dziedziczeniem genetycznym, Amerykańskie Towarzystwo Endokrynologiczne zaleca, aby wszyscy pacjenci, u których zdiagnozowano guza chromochłonnego, byli poddawani ocenie przez doradcę genetycznego w celu rozważenia wykonania badań genetycznych . Najnowsze dane wskazują, że istnieje 25 genów podatności na guz chromochłonny; jednak tylko 12 jest rozpoznawanych jako część dobrze znanego zespołu. Określenie statusu genetycznego pacjenta z guzem chromochłonnym ma kluczowe znaczenie – każdy gen jest dziedziczony według innego wzorca, związany z określoną charakterystyką choroby i może korzystniej reagować na określone opcje leczenia. Co więcej, wczesna identyfikacja może wskazywać lekarzom zalecenia dotyczące badań przesiewowych dla krewnych pierwszego stopnia pacjentów z guzem chromochłonnym. Nie ma obecnie konsensusu co do tego, jak i kiedy należy oceniać bezobjawowych nosicieli (osoba z genetycznym wariantem związanym z guzem chromochłonnym, ale brak aktualnych dowodów na chorobę). Rozmowy powinny odbywać się na poziomie indywidualnym z pacjentem i jego lekarzem, aby opracować spersonalizowany plan badań przesiewowych, który naprzemiennie obejmuje ocenę biochemiczną (praca z krwią) i obrazowanie całego ciała w celu monitorowania postępu choroby.
Rozważania pediatryczne
Dodatkowe praktyki mogą pomóc w utrzymaniu dobrego samopoczucia emocjonalnego i psychicznego nieletniego. Badania przesiewowe obejmują zespół multidyscyplinarny ( endokrynolog , onkolog , psycholog , genetyk , rodzic i dziecko), którego głównym celem jest wspieranie dziecka.
- Pozytywny wynik testów podczas rodzinnych dni świątecznych może maskować szczęście związane z tymi wydarzeniami w przyszłości.
- Testowanie jednego rodzeństwa pediatrycznego na raz pozwala rodzinie zawęzić koncentrację, gdy wyniki są zwracane i wspierać każde rodzeństwo z osobna.
- Negatywny wynik może być denerwujący dla dziecka, jeśli jego rodzeństwo było pozytywne; pomocna może być okazja do zadawania pytań i wyników procesu.
Zespoły dziedziczne
Poniższa tabela (tabele) szczegółowo opisuje kliniczną charakterystykę dobrze znanych dziedzicznych wariantów genów guza chromochłonnego
| Gen | Dziedzictwo | Penetracja | Potencjał przerzutowy | 1 o Charakterystyka choroby | |
|---|---|---|---|---|---|
| MEN2 | GNIĆ | Autosomalna Dominująca | 40-50% | <5% | Rak rdzeniasty tarczycy , nadczynność przytarczyc , pokrój marfanoidalny , guz chromochłonny nadnerczy |
| VHL | VHL | 10-30% | 5% | Rak nerki , NET trzustki , naczyniak zarodkowy siatkówki i OUN , guz chromochłonny | |
| NF1 | NF1 | 1-5% | 12% | nerwiakowłókniaki , plamki cafe-au-lait , guzki lischa , zaburzenia funkcji poznawczych, guz chromochłonny |
MEN2 (Wielokrotna neoplazja endokrynna-2); VHL (von-Hippel Lindau); NF1 (nerwiakowłókniakowatość-1); NET (guz neuroendokrynny); OUN ( ośrodkowy układ nerwowy)
| Gen | Dziedzictwo | Penetracja | Potencjał przerzutowy | 1 o Charakterystyka choroby | |
|---|---|---|---|---|---|
| PGL1 | SDHD | Autosomalna Dominująca | 90% | <5% | Przyzwojak głowy i szyi, guz chromochłonny nadnerczy, guz podścieliskowy przewodu pokarmowego |
| PGL2 | SDHAF2 | 100% | Niski | Paraganglioma głowy i szyi | |
| PGL3 | SDHC | Autosomalna Dominująca | Niespójny | Niespójny | Guz chromochłonny, przyzwojak głowy i szyi, guz podścieliskowy przewodu pokarmowego |
| PGL4 | SDHB | 30-50% | 30–70% | Przyzwojak głowy i szyi, guz chromochłonny nadnerczy, guz podścieliskowy przewodu pokarmowego | |
| PGL5 | SDHA | 10-15% | Niski | Guz chromochłonny, przyzwojak głowy i szyi, guz podścieliskowy przewodu pokarmowego |
SDHx (podjednostka dehydrogenazy bursztynianowej x)
| Dziedzictwo | Penetracja | Potencjał przerzutowy | 1 o Charakterystyka choroby | |
|---|---|---|---|---|
| MAX | Autosomalna Dominująca | Niespójny | <5% | Obustronny guz chromochłonny |
| TMEM127 | Niespójny | Niski | Guz chromochłonny, przyzwojak głowy i szyi |
MAX (współczynnik X powiązany z MYC); TMEM127 (białko transbłonowe 127)
Inne warianty genów
Opublikowano kilka opisów przypadków innych, rzadkich genów podatności związanych z guzem chromochłonnym:
-
Zespół Pacaka-Zhuanga
- Czynnik indukowany niedotlenieniem 2 alfa ( HIF2A )
- Czerwienica
- dwunastnicy Somatostatinoma
- Zmiany naczyniowe siatkówki i naczyniówki
- Przyzwojak/guz chromochłonny
- Guz chromochłonny i guz olbrzymiokomórkowy kości
-
Triada Carneya
- Guz podścieliskowy przewodu pokarmowego
- Chrzęstniak płucny
- Przyzwojak
- Zespół Carneya-Stratakisa
- Guz podścieliskowy przewodu pokarmowego
- Przyzwojak
Opisano kilka dodatkowych wariantów genów, ale dostarczone informacje są niespójne i nie osiągnięto konsensusu w społeczności, czy te mutacje są rzeczywiście genami podatności na pheochromocytoma.
Diagnoza
Mechanizm różnicowy
Jeśli pacjent ma charakterystyczne oznaki i objawy guza chromochłonnego i podjęto decyzję o przeprowadzeniu dodatkowej oceny biochemicznej (pracy krwi), diagnostyka różnicowa jest ważna, ponieważ bardziej prawdopodobne jest, że jest to coś innego niż guz chromochłonny, biorąc pod uwagę względną częstość 0,8 na 100 000 osobolat.
| Wewnątrzwydzielniczy | Układ sercowo-naczyniowy | Neurologia | Psychiatryczny | Inne |
|---|---|---|---|---|
| Nadczynność tarczycy | Niewydolność serca | Migrena | Lęk | Porfiria |
| Zespół rakowiaka | arytmie | Udar mózgu | Zaburzenie lękowe | Leki |
| Hipoglikemia | Choroba niedokrwienna serca | Padaczka | Stosowanie substancji | |
| Zespół menopauzy | Awaria barorefleksu | oponiak | Zaburzenie pozorowane | |
| Rak rdzeniasty tarczycy | – | garnki | – |
Uwagi
Ocena biochemiczna
Złotym standardem
Podwyższone stężenie wolnych metanefryny w osoczu jest uważane za złoty standard diagnostyki guza chromochłonnego. Ponad 10 badań potwierdziło, że czułość i swoistość tego testu wynosi odpowiednio 97% i 93%; jednak nadal istnieje obawa o wyniki fałszywie dodatnie we właściwym scenariuszu klinicznym. Interpretując analizę biochemiczną pod kątem guza chromochłonnego, świadczeniodawca musi zwrócić szczególną uwagę na (1) warunki pobrania, (2) wszystkie przyjmowane przez pacjenta leki oraz (3) dietę.
- Warunki pobierania: W przeciwieństwie do wielu rutynowych testów laboratoryjnych, które można wykonać natychmiast, istnieje kilka zaleceń, których należy przestrzegać, aby zapewnić idealne warunki i dokładną próbkę. Aktualne badania wskazują, że badanie krwi powinno być pobierane tylko wtedy, gdy pacjent odpoczywa na wznak (płasko na plecach) przez 30 minut przed pobraniem. W tym scenariuszu należy stosować określone wartości odniesienia w pozycji leżącej. Zapewnienie tych warunków jest trudne i może być nieopłacalne w większości instytucji. W takich przypadkach wyciąganie w pozycji leżącej w stanie spoczynku można powtórzyć po pozytywnym wyniku w pozycji siedzącej, aby wyeliminować wyniki fałszywie dodatnie.
- Zakłócenia farmaceutyczne: Wiele substancji wydawanych na receptę, dostępnych bez recepty i nielegalnych może zakłócać prawidłowe gromadzenie metanefryny w osoczu i prowadzić do wyników fałszywie dodatnich. Świadczeniodawcy powinni szczegółowo przejrzeć listę leków pacjenta i przeprowadzić dyskusję, jeśli możliwe jest tymczasowe odstawienie któregokolwiek z leków zakłócających. Najczęściej zgłaszane leki powodujące fałszywie podwyższone stężenie metanefryny to: blokery receptorów β-adrenergicznych , fenoksybenzamina , trójpierścieniowe leki przeciwdepresyjne , inhibitory monoaminooksydazy , inhibitory wychwytu zwrotnego serotoniny i noradrenaliny ( SNRI ) i metyldopa . Ponieważ większość tych leków jest powszechnie przepisywana w stanach psychiatrycznych, rozmowa z lekarzem może być konieczna w celu ułatwienia alternatywnych opcji terapeutycznych podczas badania pacjenta w kierunku guza chromochłonnego. Po otrzymaniu wszelkich możliwych leków na receptę ważne jest, aby przejrzeć wszelkie dostępne bez recepty leki/suplementy, a także powszechnie stosowany paracetamol i pseudoefedrynę powodują fałszywe podwyższenie poziomu metanefryny. Wreszcie, ważne jest prowadzenie otwartych, nieoceniających dyskusji na temat używania substancji rekreacyjnych przez pacjenta. Amfetamina , nikotyna i kokaina mogą powodować znaczne stężenie norepinefryny w osoczu.
- Styl życia i dieta: Podobnie jak w przypadku większości prac laboratoryjnych, pacjent powinien powstrzymać się od jedzenia (postu) po północy w nocy przed pobraniem. Istnieją jednak dalsze zalecenia specyficzne dla kolekcji metanefryn, w tym powstrzymanie się od nikotyny, alkoholu i ćwiczeń przez co najmniej 12 godzin przed badaniem laboratoryjnym. Pacjent powinien również unikać pokarmów zawierających katecholaminy (owoce, napoje owocowe, czekolada, kofeina, pomidory, fasola, orzechy i ziemniaki) przez co najmniej 24 godziny przed pobraniem.
Chociaż powyższe (3) warunki prawdopodobnie przyczynią się do uzyskania wyników fałszywie dodatnich, jeśli nie zostaną opanowane, każda wartość większa niż 3 do 4 razy większa od górnej granicy normy powinna być uznana za diagnostyczną dla guza chromochłonnego.
Testy alternatywne
Dwudziestoczterogodzinne metanefryny w moczu są dopuszczalną alternatywą, jeśli badanie osocza jest niedostępne. Inne dodatkowe biomarkery mogą być również pomocne w diagnozowaniu guza chromochłonnego, z których najbardziej godna uwagi jest Chromogranina A . W porównaniu ze specyficznością podwyższonych katecholamin u pacjentów z guzem chromochłonnym, chromogranina A jest niespecyficznym polipeptydem, który jest wysoki w różnych guzach neuroendokrynnych. Jednak raport z 2006 roku z Włoch wykazał, że ponad 90% badanych pacjentów z guzem chromochłonnym wykazywało podwyższone poziomy chromograniny A. Jeśli wartości metanefryny są niejednoznaczne, chromograninę A można zastosować jako marker pomocniczy do przewidywania obecności guza.
Poziom metanefryny o wartości granicznej stanowi wyzwanie diagnostyczne dla lekarza – pierwszym krokiem jest powtórzenie badań laboratoryjnych, z zachowaniem dodatkowych środków ostrożności, aby postępować zgodnie ze złotym standardem diagnozy opisanej powyżej, w tym warunków pobierania, ingerencji farmaceutycznych oraz wszelkich potencjalnych nawyków żywieniowych i stylu życia, które mogą zmienić wyniki. Jeśli nie można odstawić naruszających leków lub powtarzane badania pozostały takie same, rozważ podanie testu supresji klonidyny . W latach 70. na rynku pojawił się chlorowodorek klonidyny jako nowy lek na nadciśnienie ; jednak zgłaszane skutki uboczne ( nudności , wymioty , senność , suchość oczu i ust, zaparcia i uogólnione osłabienie) ograniczają stosowanie się do zaleceń i znacznie zmniejszają liczbę recept. Podczas gdy niepożądane skutki uboczne klonidyny są niewygodne, najbardziej niebezpiecznym aspektem klonidyny jest nadciśnienie z odbicia – to znaczy, gdy lek jest nagle odstawiany, ciśnienie krwi może szybko powrócić lub przekroczyć pierwotną wartość. Jednak w ograniczonych warunkach można zastosować jednorazową dawkę opartą na wadze, aby pomóc w określeniu stanu choroby. Po całonocnym poście , pacjenci zgłaszają się do miejsca badania w celu uzyskania podstawowego pobrania krwi metanefryny i podania klonidyny. Pozostaną w pozycji leżącej przez (3) godziny i zostanie pobrane powtórne pobranie krwi. Wynik dodatni (wskazujący na guz chromochłonny) wystąpi, jeśli stężenie metanefryny w osoczu pozostanie podwyższone po podaniu klonidyny. Jeśli wyniki są takie same lub spadają, test jest ujemny, a pacjent nie ma guza chromochłonnego. Ważne jest, aby pamiętać, że jeśli pacjent nie ma guza chromochłonnego, po klonidynie może stać się bardzo hipotensyjny . Pacjent nie powinien polegać na sobie podczas transportu po tym teście.
Metoksytyramina w osoczu jest produktem rozpadu katecholaminy, dopaminy . Przyzwojaki głowy i szyi zwykle wydzielają dopaminę, ale są określane jako „nieme biochemicznie”, ponieważ nie powodują charakterystycznych objawów związanych z guzem chromochłonnym. Metoksytyramina może być jednak wykorzystywana do wykrywania guzów głowy i szyi. Dalsze badania wskazują, że biomarker jest również użytecznym wskaźnikiem choroby przerzutowej - co jest jak dotąd jedynym aktualnym biochemicznym dowodem przerzutów.
Fenotypy biochemiczne
Chociaż diagnostyczne wartości laboratoryjne mogą również dostarczyć lekarzom ważnych informacji na temat typu, lokalizacji, wielkości i związanego genotypu nowotworu . Istnieją (3) główne, dobrze rozpoznane fenotypy biochemiczne, które mogą być wykorzystywane przez pracowników służby zdrowia do kierowania opieką nad pacjentem.
-
Adrenergiczny ( epinefryna i metanefryna )
- Bardziej prawdopodobne, że wskazuje na guza nadnerczy
- Gdy stężenie metanefryny w osoczu jest podwyższone do ponad 15% łącznego stężenia normetanefryny i metanefryny, można przewidzieć guza nadnercza lub nawrót guza nadnercza, który został już wycięty
- Pacjenci częściej prezentują klasyczne, napadowe (epizodyczne) objawy opisane powyżej
-
Noradrenergiczny ( Norepinefryna i normetanefryna )
- Bardziej prawdopodobne, że wskazuje na guza pozanadnerczowego
- Pacjenci częściej prezentują ciągłe, przetrwałe objawy związane z guzem chromochłonnym ( nadciśnienie tętnicze i tachykardia ) w porównaniu z pacjentami z klasycznym epizodem o fenotypie adrenergicznym
- Często u pacjentów z wariantami genetycznymi podjednostki X von-Hippel Lindau i dehydrogenazy bursztynianowej
-
Dopaminergiczny ( Dopamina i 3-metoksytyramina)
- Bardziej prawdopodobne, że wskazuje na guz pozanadnerczowy głowy i szyi
- Pacjenci częściej są bezobjawowi; mogą jednak objawiać się nieswoistymi objawami nudności , wymiotów , bólu brzucha, biegunki i utraty wagi wtórnie do stymulacji receptorów dopaminowych w przewodzie pokarmowym
- Szczególnie powszechne u pacjentów z wariantami genetycznymi podjednostki B dehydrogenazy bursztynianowej
Zarówno w przypadku fenotypu adrenergicznego, jak i noradrenergicznego, im większa suma stężeń metanefryny i normetanefryny w osoczu lub moczu, tym większa oczekiwana średnica guza.
Lokalizacja guza
Obrazowanie anatomiczne
Obrazowanie anatomiczne odnosi się do tomografii komputerowej (CT) [skan CAT] lub obrazowania rezonansu magnetycznego (MR). Te metody obrazowania służą do początkowej lokalizacji guza i dostarczenia szczegółowych informacji na temat wielkości, morfologii i związku strukturalnego z sąsiednimi strukturami wewnętrznymi. Tradycyjnie pacjent zgłasza się do lekarza z objawami dotyczącymi guza chromochłonnego, co skłania do oceny biochemicznej. Jeśli wyniki są pozytywne, pacjent jest kierowany na obrazowanie anatomiczne za pomocą tomografii komputerowej lub rezonansu magnetycznego. Ponieważ jednak obrazowanie anatomiczne staje się coraz łatwiej dostępne, pacjenci są kierowani do endokrynologa po przypadkowym (nieprzewidzianym wykryciu) guzka nadnercza na skanie zleconym z innego powodu. Na przykład, „Pacjent M” zgłasza się do miejscowej izby przyjęć z powodu bólu brzucha i zleca tomografię komputerową, aby wykluczyć zapalenie wyrostka robaczkowego; jednak radiolog zauważa, że w prawym nadnerczu znajduje się 3,5-centymetrowa masa.
Chociaż nie ma zgody co do tego, czy CT czy MR jest preferowaną metodą obrazowania w guzie chromochłonnym, każda metoda ma swoje mocne i słabe strony. Ponieważ tomografia komputerowa naraża pacjenta na promieniowanie jonizujące , MR jest preferowana u dzieci i kobiet w ciąży. Ponadto kontrast dożylny stosowany w tomografii komputerowej może powodować uszkodzenie nerek i dlatego należy go unikać u pacjentów z wcześniej istniejącymi uszkodzeniami. Jednak pacjenci, którzy zmagają się z przebywaniem w zamkniętych przestrzeniach przez dłuższy czas ( klaustrofobia ), często nie mogą tolerować MR, ponieważ urządzenie jest zamknięte w porównaniu z otwartą konstrukcją tomografii komputerowej. Kiedy pacjenci stają się niespokojni i zaczynają poruszać się w maszynie, powoduje to artefakt ruchu, który występuje rzadziej w obrazach z tomografii komputerowej.
W porównaniu z CT i MR ultrasonografia nie jest preferowaną metodą obrazowania i należy jej unikać u pacjentów z guzem chromochłonnym. Jednak w określonych populacjach pacjentów, w których priorytetem jest unikanie promieniowania jonizującego (dzieci, kobiety w ciąży), ultradźwięki mogą być stosowane jako metoda pomocnicza, gdy MR może być niedostępna lub pacjent nie jest w stanie ukończyć badania. Ponadto, jeśli podejrzewa się ostry krwotok do nadnerczy u pacjenta z guzem chromochłonnym, ultrasonografia jest szybką, bezbolesną, bezpromieniową i tanią metodą „pierwszego przejścia” przed zastosowaniem powyższych metod obrazowania lub operacji w celu potwierdzenia diagnozy.
Obrazowanie funkcjonalne
Omówione poniżej metody obrazowania służą charakteryzowaniu guza, potwierdzaniu przerzutów i planowaniu leczenia – nie służą do określenia lokalizacji guza ani nie pomagają zespołowi chirurgicznemu przygotować się do wycięcia. W przypadku większości pacjentów z guzem chromochłonnym nadnerczy czynnościowe obrazowanie będzie następować po CT lub MR. Jeśli obrazowanie anatomiczne wykaże jedynie guza nadnercza bez objawów choroby w jakimkolwiek innym miejscu ciała, a poziom metanefryny jest wyraźnie podwyższony, można zrezygnować z obrazowania funkcjonalnego na rzecz szybkiego wycięcia chirurgicznego. W ciągu ostatniej dekady pojawiło się pięć funkcjonalne techniki stosowane do oceny pacjenta pheochromocytoma (1), 18F fluorodeoksyglukozy pozytronowa tomografia emisyjna ( 18 F-FDG PET ), powszechnie określane jako skanowanie PET, (2), jod-123 meta- iodobenzylguanadine ( 123 I-MIBG), (3) 18F-flurodihydroxyphenylalanine ( 18 F FDOPA ), (4), 68Ga-DOTA połączony analogów somatostatyny ( 68 ga- DOTA ), (5) 11C-hydroksy efedryny (HED PET). Od tego momentu te modalności obrazowania będą określane w ich skróconych nazwach znajdujących się w nawiasach.

Pierwszy funkcjonalny wykorzystywana technika obrazowania u pacjentów guza chromochłonnego 123 I- MIBG scyntygrafii (prawym na rysunku). Biorąc pod uwagę strukturę związków zbliżoną do katecholaminy norepinefryny (wydzielanej przez guzy chromochłonne), MIBG dobrze nadawał się do wychwytu przez większość guzów neuroendokrynnych . Ponadto, jeśli u pacjenta stwierdzono dodatni wynik badania MIBG, kwalifikuje się on do leczenia MIBG, oferując dodatkowe możliwości dla osób cierpiących na rozległą chorobę przerzutową. Jednak dalsze badania wykazały, że chociaż MIBG przewyższał zmiany w nadnerczach, był znacznie mniej lepszy u pacjentów z przyzwojakami pozanadnerczowymi, szczególnie ze specyficznymi wariantami genetycznymi, takimi jak podjednostka X dehydrogenazy bursztynianowej ( SDHx). W miarę rozwoju skanów pozytonowej tomografii emisyjnej MIBG powoli traciło swoją przychylność dla pacjenta z guzem chromochłonnym.

Spośród czterech wymienionych powyżej metod, 18 F- FDG PET jest najpowszechniejszą i najłatwiej dostępną techniką obrazowania funkcjonalnego w większości systemów szpitalnych, ale najmniej specyficzną dla guzów neuroendokrynnych (Obraz po lewej). W 2012 roku ponad 200 pacjentów wzięło udział w badaniu, w którym porównano ówczesny złoty standard (MIBG/CT/MRI) z nowym FDG PET. W porównaniu ze swoim funkcjonalnym odpowiednikiem, FDG przewyższa MIBG w wykrywaniu przerzutów do tkanek miękkich i kości z większą swoistością u pacjentów z nowotworami aktywnymi biochemicznie.
Po opracowaniu FDG-PET zaczęły pojawiać się skany PET specyficzne dla neuroendokrynologii. Jeden z pierwszych korzystnych sposobów obrazowych 18 F FDOPA , w których wykazano dużą czułość w wykrywaniu przyzwojaki głowy i szyi, a także bez przerzutów, choroby poza głowy i szyi. Niestety, w przypadku przerzutów choroby, w szczególności związane z podjednostką B, dehydrogenazy bursztynianowe ( sdhB ) mutacji 18 F FDOPA spadła gorsze tradycyjnego FDG-PET. Jednakże, u pacjentów z wariantów genetycznych z innych genów, guz chromochłonny, podatność ( NF1 , VHL , RET ) 18 F FDOPA stała korzystnym środkiem radiofarmaceutycznym.
Najnowsza metoda PET polega na obrazowaniu receptorów somatostatynowych typu 2 za pomocą 68 analogów Ga- DOTA . W ciągu ostatniej dekady dalsze badania nadal wskazują na wyższość tej funkcjonalnej modalności obrazowania w szerokim zakresie scenariuszy klinicznych, nawet przewyższających obrazowanie anatomiczne ( CT / MR ) u pacjentów pediatrycznych z mutacjami dehydrogenazy bursztynianowej ( SDHx) . Podczas FDOPA niezgodnie wykryto chorobę przerzutową, 68 ga- DOTA analogi wykazują doskonałą lokalizację przerzutów guza chromochłonnego. Przy bezpośrednim porównaniu w jednym badaniu head-to-head w 2019 roku, 68 ga- DOTA analogi przewyższała FDOPA, zwłaszcza do wykrywania zmian przerzutowych kości. Dodatkową korzyścią analogów DOTA jest możliwość leczenia terapią radionuklidową receptora peptydowego, co zostanie omówione w sekcji leczenia poniżej.
Ponadto HED-PET okazał się być dokładnym narzędziem do diagnozowania i wykluczania guza chromochłonnego nadnerczy w złożonych scenariuszach klinicznych oraz do charakteryzowania niejednoznacznych guzów nadnerczy.
Kierownictwo
Chirurgia
Resekcja chirurgiczna jest jedyną opcją wyleczenia guza chromochłonnego od 2019 roku. Pomyślne wycięcie to wielodyscyplinarny wysiłek, w który zaangażowany jest endokrynolog i pacjent przed operacją (omówione poniżej) oraz zespół chirurgiczny i anestezjolog śródoperacyjnie. Bez częstej i adekwatnej komunikacji pomiędzy wszystkimi wyżej wymienionymi zespołami uzyskanie pozytywnego wyniku jest znacznie trudniejsze. The United States Endocrine Society 2014 Clinical Practice Guideline for pheochromocytoma zalecają laparoskopową adrenalektomię (technika minimalnie inwazyjna) w przypadku większości guzów nadnerczy, chyba że są inwazyjne lub są większe niż 6,0 centymetrów. Ważne jest, aby pamiętać, że większe guzy można próbować z minimalnie inwazyjnym podejściem, ale zespół powinien być przygotowany do przejścia na procedurę otwartą, jeśli to konieczne. Otwarty procedura (tradycyjna technika chirurgiczna), obecnie korzystne jest dla bardzo choroby nadnerczy, jeżeli guz jest mały, nieinwazyjny i w sposób łatwy do położenia manewru. Podczas gdy poprzednie dane wskazywały na potrzebę minimalnie inwazyjnego podejścia w przypadku choroby nowotworowej i/lub przerzutowej , obecne badania wskazują, że udana operacja jest możliwa i skutkuje krótszym pobytem w szpitalu. Literatura ostatniej dekady wykazała również, że technikę robotyczną można z powodzeniem wykorzystać w przypadku guzów nadnerczy .
Zazwyczaj wykonuje się całkowitą lub całkowitą adrenalektomię; jednak technika określana jako „oszczędzająca korę” może pozostawić resztki (kawałek) nadnercza w nadziei na uniknięcie dożywotniej wymiany sterydów, jeśli konieczne jest usunięcie lewego i prawego nadnercza. Problem jest szczególnie ważne u pacjentów z MEN i VHL - choroby powiązanej, która ma większą szansę guzów chromochłonnych dwustronnych. Ryzyko pozostawienia tkanki nadnerczy to choroba nawracająca (nowotwór guza). Badanie kohortowe z 2019 r. wykazało, że pomimo 13% odsetka nawrotów u pacjentów, którzy przeszli adrenalektomię oszczędzającą korę z powodu guza chromochłonnego, nie zaobserwowano zmniejszenia przeżycia w porównaniu z ich odpowiednikami z adrenalektomią ogółem.
Postępowanie przedoperacyjne
Prawdopodobnie najważniejszą częścią planu chirurgicznego guza chromochłonnego jest odpowiednia blokada przedoperacyjna. Nadmiar katecholamin został opisany jako uśpiony wulkan, gotowy do wybuchu w każdej chwili, siejąc katastrofalne spustoszenie w ciele. Chociaż erupcja może wystąpić w dowolnym momencie, dwa z najczęstszych wyzwalaczy to znieczulenie i bezpośrednia manipulacja guzem, co sprawia, że operacja jest jednym z najniebezpieczniejszych momentów dla pacjenta z guzem chromochłonnym, jeśli nie jest odpowiednio przygotowany. Aby pomóc ominąć kryzys katecholaminowy, Amerykańskie Towarzystwo Endokrynologiczne zaleca, aby wszyscy pacjenci z guzami funkcjonalnymi (aktywnymi hormonalnie) rozpoczęli przedoperacyjną blokadę receptorów alfa-adrenergicznych co najmniej siedem dni przed operacją. Istnieje kilka opcji leczenia w zależności od scenariusza klinicznego, z których każda ma swoje mocne i słabe strony.
Blokada alfa
Jeśli ciśnienie krwi pacjenta jest umiarkowanie podwyższone, preferowanym lekiem jest selektywny, krótko działający antagonista receptora adrenergicznego alfa-1 ( doksazosyna , prazosyna , terazosyna ). Należy jednak ostrzec pacjenta o potencjalnym efekcie ubocznym znanym jako „ zjawisko pierwszej dawki ”. Kiedy pacjenci są początkowo narażeni na jeden z powyższych środków, mogą odczuwać zawroty głowy , zawroty głowy i nudności , szczególnie przy przejściu z pozycji siedzącej do stojącej z powodu gwałtownego spadku ciśnienia krwi . Efekty te będą się zmniejszać z czasem, ale dostawcy mogą próbować ich uniknąć, zaczynając od niskiej dawki i powoli zwiększając, aż osiągną pożądaną ilość. U pacjentów z niekontrolowanym nadciśnieniem tętniczym należy zastosować nieselektywnego antagonistę receptorów alfa-1 i 2 adrenergicznych ( fenoksybenzaminę ). Niestety, w porównaniu z wymienionymi powyżej środkami selektywnymi, fenoksybenzamina jest znacznie droższa i może nie być łatwo dostępna dla niektórych pacjentów. Częste działania niepożądane to suchość w ustach , przekrwienie błony śluzowej nosa i zaburzenia wytrysku u mężczyzn , które nie ustępują z czasem i mogą ograniczać podatność pacjenta . Chociaż niezbyt często, pacjenci mogą mieć hormonalnie czynnego guza chromochłonnego i prawidłowe ciśnienie krwi. Jedno porównanie z 2014 r. wykazało, że u niektórych osób przed operacją można zastosować niewielką dawkę blokera kanału wapniowego (takiego jak amlodypina ). Nie obniży to drastycznie ciśnienia tętniczego krwi i nie spowoduje hipotensji , ale pomoże zespołom chirurgicznym i anestezjologicznym w przypadku niestabilności hemodynamicznej podczas operacji.
Blokada beta
Podwyższona częstość akcji serca ( tachykardia ) i uczucie przyspieszonego bicia serca ( kołatanie serca ) może wystąpić po podaniu antagonisty receptora alfa adrenergicznego . W takim przypadku przepisuje się antagonistę receptora beta-adrenergicznego w celu kontrolowania częstości akcji serca. Podobnie jak w przypadku antagonistów alfa, istnieją selektywni (beta-1) i nieselektywni (beta-1 i beta-2) antagoniści receptorów adrenergicznych. Środki selektywne ( atenolol , metoprolol ) są korzystniejsze od środków nieselektywnych ( propranolol ). Istnieje kilka ( labetalol , karwedilol ) połączonych antagonistów receptorów alfa-beta-adrenergicznych. Należy unikać tych środków, gdy tylko jest to możliwe, ponieważ istnieje ponad siedmiokrotnie większy antagonizm receptorów beta-adrenergicznych niż alfa, co może pogorszyć nadciśnienie i prowadzić do przełomu katecholaminowego.
Komplikacje
Antagonistów receptorów beta-adrenergicznych nie należy podawać pacjentom z guzem chromochłonnym nadnerczy samodzielnie – może to prowadzić do poważnych konsekwencji. W 1995 roku zespół lekarzy z Londynu opisał zgon osoby, u której niedawno zdiagnozowano guza chromochłonnego po rozpoczęciu podawania propranololu , nieselektywnego beta-blokera . Szybko doznała przełomu nadciśnieniowego prowadzącego do wstrząsu , zawału mięśnia sercowego , niewydolności serca i gęstej prawej hemiplegii . Mimo prób reanimacji osoba zmarła kilka dni później. Powikłanie to jest związane z wpływem antagonistów receptorów alfa i beta-adrenergicznych na naczynia krwionośne w połączeniu z działaniem katecholamin . Normalne naczynie krwionośne jest otwarte, co pozwala na odpowiedni przepływ krwi. Gdy katecholaminy aktywują receptor alfa, naczynie kurczy się (zmniejsza się), co skutkuje nadciśnieniem . Jednak gdy katecholaminy aktywują receptor beta, naczynie krwionośne rozszerza się (powiększa się) i pozwala na zwiększony przepływ krwi, obniżając ciśnienie krwi. Jeśli u pacjenta z guzem chromochłonnym nadnerczy rozpoczyna się tylko leczenie antagonistą receptora beta-adrenergicznego, odwraca to ochronne rozszerzenie naczyń krwionośnych i pogarsza nadciśnienie tętnicze u pacjenta.
Spór
Chociaż omówiona powyżej przedoperacyjna blokada alfa i beta jest w przeważającej mierze uznawana za standard opieki, szczególnie w Stanach Zjednoczonych, na szczeblu międzynarodowym toczyła się dyskusja, czy blokada jest konieczna. W 2017 roku zespół badaczy z Niemiec opublikował obserwacyjną serię przypadków , w której zakwestionowano aktualne zalecenia dotyczące blokady. W badaniu oceniano śródoperacyjne maksymalne skurczowe ciśnienie tętnicze u osób z blokadą receptorów alfa-adrenergicznych i bez tej blokady i nie stwierdzono różnic w powikłaniach między obiema grupami. W następnym roku grupa z Francji opublikowała podobny artykuł z ostrzeżeniem przed czekaniem całego tygodnia na rozpoczęcie blokady alfa. Francuscy naukowcy wezwali do natychmiastowej interwencji chirurgicznej i rozważenia kroków w celu złagodzenia śródoperacyjnego kryzysu katecholaminowego. Artykuły te spotkały się z obaleniem ze strony zespołów badawczych w Stanach Zjednoczonych, ale nie osiągnięto jeszcze międzynarodowego konsensusu.
Stan płynu okołooperacyjnego
Nadmiar katecholamin powoduje zmniejszenie całkowitej objętości krwi , narażając pacjenta na niedociśnienie podczas operacji. Dlatego przed zabiegiem należy zachęcać do diety wysokosodowej z odpowiednią ilością płynów. Niektóre instytucje w Stanach Zjednoczonych przyjmują pacjentów nawet noc przed operacją w celu dożylnego uzupełnienia płynów, począwszy od północy do czasu operacji. Jednak małe badanie z 2009 r. wykazało brak różnicy w śmiertelności u pacjentów leczonych płynami dożylnymi przed operacją w porównaniu z tymi, którzy tego nie robili.
W ankiecie przeprowadzonej w 2010 roku wśród 40 endokrynologów przez naukowców z Centrum Medycznego Cedars-Sinai w Los Angeles w Kalifornii prawie wszyscy wskazali na znaczenie przedoperacyjnej resuscytacji objętościowej ( podanie pacjentowi dużej ilości płynów przed operacją). Jednak po przejrzeniu danych pacjentów ponad 60% tych samych lekarzy nie omówiło kwestii obciążenia solą i odpowiedniego nawodnienia. Kiedy pacjenci byli stratyfikowani według wieku, ci, którzy byli młodsi, otrzymywali zalecenie nawadniania , ale starsi pacjenci nie. Został on hipotezę, że dostawcy wybrał zrezygnować przywróceniu objętości w starszej populacji pacjentów z obawy przed ich potencjalne choroby współistniejące ( niewydolność serca ), gdzie nadmiar płynu jest niebezpieczne. Chociaż nadal nie ma uznanego konsensusu ani złotego standardu, świadczeniodawcy powinni indywidualizować decyzję na podstawie postrzeganej przez pacjenta stanu odżywienia, stanu objętości , chorób współistniejących i zdolności do samonawadniania się.
Postępowanie pooperacyjne
Najczęstsze powikłania pooperacyjne, prawdopodobne przyczyny i opcje leczenia to:
- Nadciśnienie : U pacjenta z guzem chromochłonnym nadciśnienie pooperacyjne może wskazywać na niecałkowitą resekcję guza lub inny guz o nieznanej lokalizacji. Należy jednak wziąć pod uwagę tradycyjne, niespecyficzne przyczyny nadciśnienia pooperacyjnego, takie jak ból, przeciążenie płynami i nadciśnienie pierwotne . W okresie okołooperacyjnym kryzys nadciśnieniowy traktuje się najpierw 5,0 miligrama (mg) dożylnie w bolusie do fentolaminy z dodatkowym 5,0 mg dawkę co dziesięć minut, aż ciśnienie mieści się w dopuszczalnym zakresie. Jeśli ciśnienie krwi jest tylko minimalnie podwyższone, pacjent może wznowić działanie antagonisty receptorów alfa i beta-adrenergicznych sprzed operacji.
- Niedociśnienie : Istnieje kilka powodów, dla których pacjent może mieć niskie ciśnienie krwi w okresie pooperacyjnym. Przede wszystkim usunięto guz (i obfitość katecholamin powodujących nadciśnienie). Ponadto pacjent może nadal odczuwać skutki działania antagonisty receptora alfa-adrenergicznego , co powoduje obniżenie ciśnienia krwi. Leczeniem pierwszego rzutu niedociśnienia pooperacyjnego jest agresywna resuscytacja płynowa , dlatego tak ważne jest upewnienie się, że pacjent jest dobrze nawodniony (patrz powyżej) przed zabiegiem chirurgicznym. Wazopresory mogą być potrzebne, jeśli ciśnienie krwi nie reaguje na płyny.
- Hiperglikemia : katecholaminy zapobiegają wydzielaniu insuliny – hormonu odpowiedzialnego za obniżenie poziomu glukozy we krwi (cukru). Stężenie glukozy we krwi należy często sprawdzać w okresie okołooperacyjnym, a insulinę należy podawać w razie potrzeby, jeśli poziom jest podwyższony. Po resekcji hiperglikemia związana z nowotworem prawdopodobnie ustąpi.
- Hipoglikemia : po usunięciu guza insulina nie jest już hamowana, co może spowodować niebezpiecznie niski poziom glukozy we krwi. Objawy obejmują drżenie , niepokój , kołatanie serca , pocenie się , zaburzenia stanu psychicznego ( splątanie ) , zawroty głowy i niewyraźne widzenie . Retrospektywna analiza beta-blokerów wykazała, że niektóre stosowanie beta-blokerów może powodować, że ludzie są bardziej podatni na hipoglikemię i nie doświadczają tych objawów, co może opóźnić diagnozę.
-
Niewydolność nadnerczy: Po obustronnej adrenalektomii (po lewej i prawej stronie) pacjent nie jest już w stanie wydzielać hormonów niezbędnych do utrzymania prawidłowego funkcjonowania organizmu. Doustna suplementacja sterydów ( hydrokortyzonu i fludrokortyzonu ) przez całe życie może być wymagana, aby upewnić się, że nie rozwinie się niewydolność nadnerczy. Kiedy ciało jest zestresowane (podczas operacji), nadnercza naturalnie wytwarzają więcej sterydów; jeśli jednak gruczoły zostały usunięte, nie są w stanie tego zrobić. Dlatego konieczne jest „dawkowanie stresowe” sterydów, które należy rozpocząć śródoperacyjnie, aby naśladować naturalną fizjologię nadnerczy. Typowy schemat postępowania, w którym przypuszcza się, że pooperacyjna niewydolność nadnerczy jest prawdopodobna:
- 50 miligramów (mg) hydrokortyzonu dożylnie na sali operacyjnej przed znieczuleniem
- Powtarzać podawanie dożylnie 25-50 mg hydrokortyzonu co 8 godzin przez maksymalnie 72 godziny (3 dni) po operacji. Przejdź na doustną terapię zastępczą, gdy tylko pacjent będzie w stanie przyjmować leki doustnie
- Przed wypisaniem ze szpitala pacjenci powinni przejść do normalnej podtrzymującej (regularnej, dziennej) dawki steroidów i skierowani do endokrynologii w celu odpowiedniego dostosowania dawki i leczenia. W zależności od całkowitej powierzchni ciała pacjenta , całkowita typowa dawka dobowa hydrokortyzonu wynosi od 15 do 25 mg na dobę (podzielona na tabletki poranne i popołudniowe).
- Osoby, które utraciły oba nadnercza, będą również wymagały innego sterydu ( zastąpienie mineralokortykoidów ). Typowa dawka dobowa wynosi od 50 do 200 mikrogramów fludrokortyzonu
Odnotowano wiele innych powikłań ( niewydolność nerek , niewydolność serca , rzekoma niedrożność jelit ) po resekcji guza. Jednak powyższe są bardziej prawdopodobne, dlatego ich zarządzanie zostało szczegółowo opisane w tym artykule.
Choroba przerzutowa
Diagnoza i lokalizacja
Guz chromochłonny z przerzutami definiuje się jako obecność komórek nowotworowych ( tkanki chromochłonnej ), w których normalnie nie występują. Pacjenci z przyzwojakiem częściej rozwijają przerzuty niż pacjenci z guzem chromochłonnym. Najczęstszymi miejscami przerzutów pozanadnerczowych są węzły chłonne , płuca , wątroba i kości . Przebadano kilka czynników ryzyka związanych z rozwojem choroby przerzutowej – podczas gdy podłoże genetyczne pacjenta odgrywa ważną rolę, początkowy wiek wystąpienia i wielkość guza prowadzą do negatywnych wyników. Spośród wszystkich wariantów genetycznych mutacje podjednostki B dehydrogenazy bursztynianowej (SDHB) mają najwyższy wskaźnik rozwoju choroby przerzutowej. Inne badanie wykazało zwiększoną śmiertelność związaną z płcią męską i przerzutami synchronicznymi. Przerzuty dzielą się na synchroniczne i metachroniczne; te, które są synchroniczne, rozwinęły się w ciągu kilku miesięcy od pierwotnego guza, podczas gdy przerzuty metachroniczne nie pojawiają się przez znaczny okres czasu.
Laparoskopowe podejście do pierwotnej choroby, zwłaszcza w przypadku dużych guzów, zostało uznane za ważny czynnik ryzyka rozsiewu guza.
Pomimo wszystkich poniższych potencjalnych opcji leczenia, ostatnia literatura podkreśla, że (u większości pacjentów) przerzutowy guz chromochłonny rozwija się powoli. U pacjentów z minimalnym obciążeniem chorobą korzystne jest podejście „ obserwuj i czekaj ” z częstym obrazowaniem w celu monitorowania choroby, wstrzymując leczenie do czasu uwidocznienia objawów progresji.
Leczenie
Guz chromochłonny z przerzutami najlepiej radzi sobie z multidyscyplinarnym zespołem złożonym z onkologów , chirurgów , radiologów , lekarzy medycyny nuklearnej i endokrynologów . Istnieje kilka opcji leczenia dostępnych dla pacjentów w zależności od nasilenia i lokalizacji choroby:
Chirurgia - Zwykle celem operacji jest całkowita operacja cytoredukcyjna ; nie pozostawiaj żadnych resztek choroby. Jednak w przypadku rozległej choroby przerzutowej nie zawsze jest to możliwe. W związku z tym przeprowadza się zabieg chirurgicznej debulkacji (usunięcie jak największej ilości tkanki nowotworowej) w celu zmniejszenia objawów pacjenta poprzez usunięcie źródła katecholamin, poprawy odpowiedzi na chemioterapię lub terapię radionuklidową lub po prostu zmniejszenie rozmiaru guza. Niestety zamierzona ulga po zabiegu jest często krótkotrwała, zwłaszcza jeśli pacjent ma chorobę pozabrzuszną. Badanie przeprowadzone w 2013 r. przez National Institutes of Health wykazało, że większość pacjentów cierpiała na nawracające biochemiczne objawy choroby w ciągu jednego roku od operacji, a mniej niż 30% nadal było biochemicznie wolnych od choroby po pięciu latach.
W przeciwieństwie do operacji w przypadku choroby bez przerzutów, otwarta procedura może być preferowana w celu uniknięcia potencjalnego rozprzestrzeniania się guza niż minimalnie inwazyjna technika. Pomaga to również w wizualizacji chirurgicznej i oferuje najlepszą możliwość identyfikacji i usunięcia przerzutowych węzłów chłonnych. Doniesienia wskazują również na użyteczność podawania środka radionuklidowego, takiego jak meta-jodobenzyloguanadyna jodo-123 ( 123 I-MIBG) przed zabiegiem chirurgicznym, a następnie śródoperacyjnego skanowania pacjenta sondą w celu wykrycia choroby, która może zostać przeoczona gołym okiem.
Radioterapia - W odniesieniu do guza chromochłonnego, techniki naświetlania są stosowane przede wszystkim do kontroli bólu, szczególnie w odniesieniu do przerzutów do kości , miejscowej kontroli choroby oraz ograniczenia ucisku na rdzeń kręgowy . Wielodyscyplinarny zespół z Mayo Clinic retrospektywnie przeanalizował wszystkich swoich pacjentów, którzy przeszli radioterapię wiązką zewnętrzną w latach 1973-2015 i stwierdził, że 94% pacjentów potwierdziło poprawę objawową, a ponad 80% pacjentów nie wykazało objawów nawrotu choroby 5 lat po zabiegu. terapia. W innym doniesieniu z tej samej instytucji przeanalizowano prawie dwie dekady pacjentów poddanych ablacji o częstotliwości radiowej , krioablacji lub przezskórnym wstrzyknięciu etanolu z powodu przerzutowego guza chromochłonnego i stwierdzono , że osiągnięto miejscową kontrolę w ponad 85% docelowych zmian , a 92% zabiegów było związanych z zmniejszenie bólu i/lub objawów nadmiaru katecholamin .
Chemioterapia – najczęstszym schematem chemioterapii w przypadku przerzutowego guza chromochłonnego jest cyklofosfamid , winkrystyna i dakarbazyna , zwane łącznie CVD. Odpowiedź na terapię mierzy się zmniejszeniem całkowitej objętości guza oraz złagodzeniem objawów zgłaszanych przez pacjenta. Przegląd systematyczny i metaanaliza niestratyfikowanych pacjentów z guzem chromochłonnym, którzy przeszli terapię CVD, wykazały, że 37% pacjentów miało znaczące zmniejszenie objętości guza, podczas gdy 40% pacjentów doświadczyło mniejszego obciążenia katecholaminami. Chociaż nie było różnicy w całkowitym przeżyciu między pacjentami, u których guz się zmniejszył, a pacjentami bez odpowiedzi (brak zmniejszenia masy guza za pomocą obrazowania), nawet u pacjentów nieodpowiadających na leczenie, pacjenci zgłaszali lepsze samopoczucie, ciśnienie krwi było niższe, a niektórzy pacjenci byli nawet w stanie do poddania się operacji po stabilizacji choroby za pomocą CVD. Gdy pacjenci są badani według różnych kategorii, badania sugerują, że kobiety mają mniejsze prawdopodobieństwo wydłużenia przeżycia po chemioterapii CVD w porównaniu z mężczyznami. Wykazano, że status genetyczny ma duży wpływ na odpowiedź na CVD. Zespół naukowców z National Institutes of Health poinformował, że pacjenci z mutacjami podjednostki B dehydrogenazy bursztynianowej (SDHB) nie tylko częściej reagują na CVD, ale także doświadczają ponad 30 miesięcy przeżycia bez progresji (czas do powrotu guza ) przy ciągłym administrowaniu.
CVD nie jest jednak jedynym sprawdzonym schematem chemioterapii u pacjenta z guzem chromochłonnym. Raport z 2018 r. wykazał niezwykłą odpowiedź dwóch pacjentów z SDHB, u których nie powiodła się chemioterapia CVD (choroba postępowała pomimo przyjmowania leków), ale byli następnie leczeni temozolomidem (TMZ) i mieli czas przeżycia bez progresji wynoszący 13 i 27 miesięcy, co wskazuje, że TMZ można uznać za alternatywny schemat leczenia u osób, u których wystąpiła progresja CVD. Od tego czasu kilka badań donosiło o skutecznych odpowiedziach na TMZ, szczególnie w subpopulacji SDHB .
Terapia radionuklidowa
- Jod-131 meta-jodobenzyloguanadyna (MIBG)
- Jak wspomniano w części dotyczącej obrazowania czynnościowego powyżej, MIBG jest przydatne nie tylko w lokalizowaniu obecności choroby przerzutowej, ale także jako dostępna metoda leczenia. W 2019 r. w wieloośrodkowym badaniu fazy 2 oceniano bezpieczeństwo i skuteczność terapii MIBG u pacjentów z przerzutowym lub nieoperacyjnym (niesprzyjającym operacji) guzem chromochłonnym nadnerczy, a wyniki były obiecujące. Mediana przeżycia całkowitego wyniosła 36,7 miesiąca, a 92% pacjentów miało przynajmniej częściową pozytywną odpowiedź (zmniejszenie się guza) lub stabilizację choroby bez progresji w ciągu pierwszego roku badania. Co więcej, ponad jedna czwarta pacjentów była w stanie zmniejszyć przyjmowane leki przeciwnadciśnieniowe i zgłosiła poprawę objawową. Istnieje kilka pacjentów, którzy nie kwalifikują się do leczenia MIBG, w tym kobiety w ciąży (narażenie na promieniowanie jest szkodliwe dla płodu ), kobiety aktywnie karmiące piersią , pacjenci z niewydolnością nerek oraz osoby, u których nie przewiduje się życia dłuższego niż 3 lata. miesiące. Ponieważ terapia MIBG może zniszczyć tarczycę , leki ochronne ( jodek potasu ) są rozpoczynane przed rozpoczęciem leczenia i muszą być kontynuowane przez co najmniej 3 tygodnie po zakończeniu terapii. Powiązane skutki uboczne ( osłabienie mięśni , nudności , wymioty i toksyczność hematologiczna (krwi) są powszechne, ale często minimalne i można je złagodzić przez powolne, stałe dawkowanie.
-
Terapia radionuklidami z użyciem receptorów peptydowych (PRRT)
- Najnowsza z opcji leczenia, PRRT, wykorzystuje analogi 68-Ga DOTA wymienione powyżej w sekcji obrazowania funkcjonalnego. Leczenie 177 Lu-DOTATATE najpierw przyniosło sukces u pacjentów z niezróżnicowanymi guzami neuroendokrynnymi, a następnie rozpoczęto badania u pacjentów z przerzutowym guzem chromochłonnym. W 2019 r. Vyakaranam i wsp. opublikowali korzystne wyniki dla 22 pacjentów poddanych PRRT, z częściową odpowiedzią u 2 pacjentów i stabilną chorobą (brak progresji) u pozostałych 20 pacjentów. Ogólna toksyczność była niska, nie zgłoszono żadnego poważnego uszkodzenia hematologicznego (krwi) ani nerek. Pod koniec tego samego roku w przeglądzie systemowym przeanalizowano wszystkie opublikowane artykuły (12), w których pacjenci z przerzutowym guzem chromochłonnym przeszli PRRT, i stwierdzono, że działania niepożądane związane z leczeniem są minimalne, a tylko 5 ze 102 pacjentów zdecydowało się dobrowolnie rozpocząć leczenie. Nowsze raporty szczegółowo opisują użyteczność połączenia 90 Y- DOTATATE z tradycyjnie badanym analogiem 177 Lu oraz różne możliwości i nowe opcje leczenia, które te kombinacje przyniosą w terenie. Chociaż ogólnie zgłoszone skutki uboczne były obiecujące, ważne jest to Chociaż ogólnie zgłoszone skutki uboczne są obiecujące, należy zauważyć, że wspólny wysiłek między Narodowymi Instytutami Zdrowia i Radboud University Medical Center zgłosił dwa niefortunne przypadki szybka progresja choroby po niezwykłej, prawie całkowitej odpowiedzi na PRRT. Chociaż etiologia ich nawrotu jest nieznana, zespół spekulował, że podwyższony marker nowotworowy ( Ki-67 ) może wskazywać na słabą odpowiedź na PRRT i wezwał do oceny przed PRRT, aby uwzględnić wartości Ki-67, aby pomóc zindywidualizować leczenie pacjenta plany.
Rokowanie
Według National Cancer Institute , rokowanie jest definiowana jako prawdopodobnego wyniku choroby lub, możliwość odzysku lub nawrotu. To niezwykle trudne pytanie w przypadku guza chromochłonnego, a odpowiedź zależy od statusu genetycznego pacjenta, obecności choroby przerzutowej oraz lokalizacji guza pierwotnego. W artykule o rokowaniu opublikowanym w 2000 r. odnotowano 91% 5-letnie przeżycie w ich populacji pacjentów; należy jednak zauważyć, że ponad 86% ich pacjentów miało sporadyczne guzy (brak znanej mutacji genetycznej), które zwykle mają niski potencjał złośliwości. W 2019 roku konsorcjum prawie dwudziestu europejskich ośrodków medycznych przyjrzało się rokowaniu złośliwego guza chromochłonnego, a dane wyraźnie różnią się od doniesień o sporadycznych, pojedynczych guzach, z medianą przeżycia 6,7 roku. Całkowite przeżycie uległo poprawie, jeśli pacjent miał (1) chorobę głowy i szyi w porównaniu z brzuchem, (2) miał mniej niż 40 lat, (3) i jego biochemia była mniejsza niż pięciokrotnie górna granica normy.
W najnowszej literaturze wyszczególniono kilka czynników, które przewidują przyspieszoną progresję choroby i wyższe wskaźniki śmiertelności, w tym pacjentów, którzy zrezygnowali z chirurgicznej resekcji guza pierwotnego, większych guzów w początkowej prezentacji, starszego wieku w momencie początkowego rozpoznania oraz skróconego czasu od guza pierwotnego do obecność przerzutów. Faktyczna lokalizacja przerzutów może również wskazywać na rokowanie, przy czym zmiany kostne (kości) mają się lepiej niż ich odpowiedniki w tkankach miękkich ( płuca , wątroba ).
Epidemiologia
Według North American Neuroendocrine Tumor Society częstość występowania guza chromochłonnego wynosi od 1:2500 do 1:6500, co oznacza, że na każde 2500–6500 osób przypada (średnio) jedna osoba z guzem chromochłonnym. W Stanach Zjednoczonych odpowiada to rocznej zachorowalności (nowe przypadki rocznie) od 500 do 1600 przypadków. Jednak przybliżenia z początku XXI wieku wykazały, że ponad 50% diagnoz guza chromochłonnego ma miejsce podczas autopsji ; dlatego powyższe szacunki mogą być niższe niż oczekiwano. W 50-letniej serii autopsji klinika Mayo przeanalizowała 54 przypadki guza chromochłonnego w latach 1928-1977 i odkryła, że tylko 24% pacjentów zostało prawidłowo zdiagnozowanych przed śmiercią. Poza Stanami Zjednoczonymi kilka krajów udokumentowało własne badania epidemiologiczne i porównało je z tym, co jest znane w Ameryce Północnej . W pierwszym krajowym, epidemiologicznym badaniu populacyjnym w Azji, wykorzystującym dane Koreańskiej Narodowej Służby Ubezpieczeń Zdrowotnych, częstość występowania guza chromochłonnego nadnerczy wynosiła 2,13 na 100 000 osób, a częstość występowania wynosiła 0,18 na 100 000 osobolat. Jest to mniej niż liczba odnotowana w Rochester w stanie Minnesota (0,8 na 100 000 osobolat) w badaniu przeprowadzonym w latach 1950-1979. Jednak Holandia przeprowadziła również badanie z wykorzystaniem ogólnokrajowego rejestru i odnotowała wyniki zachorowalności na poziomie 0,57 na 100 000 osobolat w latach 2011-2015, co stanowiło znaczny wzrost w porównaniu z 0,37 przypadków na 100 000 osobolat odnotowanych w latach 1995-1999. Aktualne hipotezy wyjaśniające, dlaczego częstość występowania guza chromochłonnego wzrasta w populacji holenderskiej, wskazują na pojawienie się nowoczesnej oceny obrazowania i możliwości wykrywania tych guzów przed śmiercią. Chociaż w każdym z powyższych badań odnotowano różne wartości zapadalności i chorobowości, wszystkie wykazały, że średni wiek w momencie początkowego rozpoznania mieści się w przedziale od trzeciej do piątej dekady życia. Gdy u młodszych pacjentów zostanie zdiagnozowany guz chromochłonny, należy podejrzewać chorobę dziedziczną, ponieważ przewidywanie genetyczne (wcześniejsze wystąpienie choroby w każdym pokoleniu) jest związane z niektórymi mutacjami.
Klasycznie nauczano „zasady 10” guza chromochłonnego, szczególnie studentom medycyny:
- 10% pacjentów ma nowotwór złośliwy
- 10% pacjentów ma obustronną (zarówno lewego, jak i prawego nadnercza) chorobę
- 10% pacjentów ma chorobę nadnerczy (paraganglioma)
- 10% pacjentów odziedziczyło (choroba rodzinna)
Pomimo znaczenia w wielu szanowanych podręcznikach, wytyczne te zostały uznane za niedokładne i nie są wykorzystywane w bieżących dyskusjach epidemiologicznych.
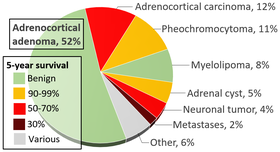
Jak sugerowano powyżej, obrazowanie incydentalne stało się głównym czynnikiem w diagnostyce pacjentów z guzem chromochłonnym, przy czym obecnie szacuje się, że 10–49% wszystkich przypadków zdiagnozowanych po obrazowaniu uzyskano z innego powodu. Gdy guzek nadnercza (potencjalny guz) zostanie wykryty w tomografii komputerowej lub rezonansie magnetycznym, istnieje od 5 do 10% szans, że zmiana jest guzem chromochłonnym. Częstość występowania guzów nadnerczy przedstawiono na powyższej infografice, z guzem chromochłonnym nadnerczy zaznaczonym na żółto w prawym górnym rogu.
Historia
W 1800 roku irlandzki lekarz (Charles Sugrue) napisał opis przypadku do London Medical and Physical Journal, opisując szczególny przypadek 8-letniego pacjenta płci męskiej, który cierpiał na pozornie przypadkowe napady bólu skoncentrowane w jamie brzusznej, którym towarzyszył gorączkowy rumieniec wyraźnie zaznaczony na każdym policzku” z „ciągłym obfitym i powszechnym poceniem ”. Po jego śmierci grupa lekarzy przeprowadziła sekcję zwłok w celu ustalenia przyczyny zgonu i odkryła sześciocalowy podłużny guz złożony z nieznanej „substancji o żółtawym zabarwieniu” pochodzącej z torebki nerkowej (obecnie znanej jako nadnercz). . Byłby to pierwszy znany kliniczny opis guza chromochłonnego, ale ponieważ nie opisano żadnych cech samego guza, w pełni zasługuje na to Niemiec Felix Fraenkel, który przedstawił kliniczny i morfologiczny obraz tego guza. Podczas gdy różni lekarze rozpoznawali objawy i leczyli pacjentów, czeski biolog Alfred Kohn doniósł o swoim odkryciu systemu paraganglia , który później stał się kluczowy dla diagnozy tych guzów. Co więcej, wprowadził również termin „ chromafina ”, umożliwiając patologom rozpoznawanie guzów wywodzących się z nadnerczy .
W 1908 roku dwaj patolodzy , Henri Alezais i Felix Peyron, przedstawili społeczności naukowej „ przyzwojaka ” po odkryciu tkanki pozanadnerczowej, która reagowała na sole chromu, co naśladowało reakcję rdzenia nadnerczy. Zaledwie cztery lata później niemiecki patolog Ludwig Pick ukuł termin „guz chromochłonny” po tym, jak zaobserwował stałą zmianę koloru w guzach związanych z rdzeniem nadnerczy . Wielu chirurgów próbowało usunąć te guzy w ciągu następnej dekady, ale ich pacjenci zmarli śródoperacyjnie z powodu wstrząsu. W 1926 r. Charles Mayo (założyciel Kliniki Mayo ) został pierwszym lekarzem, który z powodzeniem wyciął guz chromochłonny. Jednak Mayo prawdopodobnie nie wiedział o diagnozie przed operacją. Dopiero w 1929 r. rozpoznano przedoperacyjnie guza chromochłonnego. Na początku XX wieku śmiertelność operacyjna z powodu guza chromochłonnego wahała się od 30-45%. W serii retrospektywnej postulowano, że te niepokojąco wysokie śmiertelności były spowodowane brakiem przedoperacyjnej blokady z antagonistami receptorów alfa i beta-adrenergicznych oraz potrzebą nowoczesnych praktyk anestezjologicznych. Od tego momentu lekarze-naukowcy rozpoznają wzorce u pacjentów z guzem chromochłonnym i identyfikują powiązania genetyczne i różne zespoły.
Społeczeństwo i kultura
Chociaż jest to choroba rzadka, w kulturze popularnej i mediach pojawiło się kilka odniesień do guza chromochłonnego, zwłaszcza w medycznych serialach telewizyjnych . Dodatkowo, istnieje silna internetowa społeczność rzeczników pacjentów, która działa na rzecz łączenia pacjentów z rzadkimi chorobami i pozwala im spotkać się z innymi osobami, które doświadczają podobnych diagnoz i strategii leczenia.
Kultura zebry
W środowisku medycznym studenci często uczą się „kiedy słyszysz bicie kopyt w Teksasie, myśl o koniach, a nie zebrach”. Innymi słowy, powszechne diagnozy są powszechne, więc pracownicy służby zdrowia powinni najpierw wykluczyć to, czego najbardziej się oczekuje (konie), zanim zagłębią się w rzadką etiologię, która jest znacznie mniej prawdopodobna (zebry). Jednak symbol zebry stał się coraz silniejszy w społeczności zajmującej się rzadkimi chorobami i zaowocował kilkoma organizacjami, stowarzyszeniami i wydarzeniami specjalnymi ( Dzień Chorób Rzadkich ), aby zwrócić uwagę na najmniej powszechną opcję, czasami będącą prawidłową diagnozą.
Narodowa Organizacja rzadkimi zaburzeniami to Stany Zjednoczone oparte rzecznictwo organizacja rodzic, którego celem jest promowanie świadomości i możliwości badawczych do wyleczenia chorób rzadkich. Takie grupy zachęcają pacjentów do zostania własnymi rzecznikami i zmieniania agentów w procesach podejmowania decyzji dotyczących opieki zdrowotnej.
Głoska bezdźwięczna
W lipcu 2012 r. rzeczywisty pacjent z guzem chromochłonnym, Tannis Brown, były wiceprezes PheoPara Troopers, pojawił się w programie Discovery Fit & Health Network Diagnosis: Dead or Alive. Program podkreślił jej osobistą walkę z błędnie zdiagnozowaną chorobą, ponieważ wielu lekarzy uważało, że jej epizodyczne bóle głowy i nadciśnienie (wysokie ciśnienie krwi) są związane ze stresem.
W siódmym i ósmym pór Grays Anatomy , seria regularnych Henry ma Von Hippel-Lindau (VHL) mutację, która doprowadziła do guza chromochłonnego. Story arc spotkała się z mieszanymi opiniami z rzadkimi chorobami. Następnie dyrektor wykonawczy VHL Alliance była zadowolona z przedstawienia pacjenta z VHL w mediach głównego nurtu, ale zwróciła uwagę, że z czterech znanych jej scenariuszy dotyczących pacjenta z VHL trzy dotyczyły guza chromochłonnego, który w rzeczywistości występuje w mniej niż jednej piątej wszyscy pacjenci z VHL.
Bibliografia
Zewnętrzne linki
- „ Ogólne informacje o guzie chromochłonnym i przyzwojaku ” z National Cancer Institute
- Pheochromocytoma i paraganglioma z American Society of Clinical Oncology
- guz chromochłonny ; Baza danych chorób rzadkich z Krajowej Organizacji ds. Rzadkich Zaburzeń
- Co należy wiedzieć o guzie chromochłonnym z Medical News Today
- MedlinePlus Przegląd guza chromochłonnego
- Wpis GeneReviews na temat „ Dziedzicznych zespołów paraganglioma-pheochromocytoma ”
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |