Rotawirus -Rotavirus
| Rotawirus | |
|---|---|

|
|
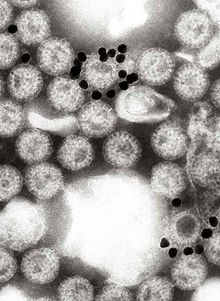
| Wspomagana komputerowo rekonstrukcja rotawirusa na podstawie kilku zdjęć z mikroskopu elektronowego | |
|
Klasyfikacja wirusów |
|
| (bez rankingu): | Wirus |
| Królestwo : | Rybowiria |
| Królestwo: | Orthornavirae |
| Gromada: | Duplornaviricota |
| Klasa: | Resentoviricetes |
| Zamówienie: | Reovirales |
| Rodzina: | Reoviridae |
| Podrodzina: | Sedoreovirinae |
| Rodzaj: | Rotawirus |
| Gatunek | |
|
|
Rotawirus to rodzaj wirusów z dwuniciowym RNA z rodziny Reoviridae . Rotawirusy są najczęstszą przyczyną biegunki u niemowląt i małych dzieci. Prawie każde dziecko na świecie jest przynajmniej raz zarażone rotawirusem przed ukończeniem piątego roku życia. Odporność rozwija się z każdą infekcją, więc kolejne infekcje są mniej poważne. Dorośli są rzadko dotknięci. Istnieje dziewięć gatunków tego rodzaju, określanych jako A, B, C, D, F, G, H, I i J. Rotawirus A , najpowszechniejszy gatunek, powoduje ponad 90% zakażeń rotawirusem u ludzi.
Wirus jest przenoszony drogą fekalno-oralną . Infekuje i uszkadza komórki wyściełające jelito cienkie i powoduje zapalenie żołądka i jelit (często nazywane „grypą żołądkową”, mimo że nie ma związku z grypą ). Chociaż rotawirus został odkryty w 1973 r. przez Ruth Bishop i jej współpracowników za pomocą zdjęć z mikroskopu elektronowego i odpowiada za około jedną trzecią hospitalizacji z powodu ciężkiej biegunki u niemowląt i dzieci, jego znaczenie było historycznie niedoceniane w środowisku zdrowia publicznego , szczególnie w krajach rozwijających się . Oprócz wpływu na zdrowie człowieka rotawirus zaraża również inne zwierzęta i jest patogenem zwierząt gospodarskich.
Rotawirusowe zapalenie jelit jest zwykle łatwą do opanowania chorobą wieku dziecięcego, ale wśród dzieci poniżej 5 roku życia rotawirus spowodował około 151 714 zgonów z powodu biegunki w 2019 roku. W Stanach Zjednoczonych, przed rozpoczęciem programu szczepień przeciwko rotawirusom w 2000 roku, rotawirus spowodował około 2,7 milionów przypadków ciężkiego zapalenia żołądka i jelit u dzieci, prawie 60 000 hospitalizacji i około 37 zgonów rocznie. Po wprowadzeniu szczepionki rotawirusowej w Stanach Zjednoczonych odsetek hospitalizacji znacznie spadł. Kampanie zdrowia publicznego mające na celu zwalczanie rotawirusa koncentrują się na zapewnieniu doustnej terapii nawadniającej dla zakażonych dzieci oraz szczepieniach zapobiegających chorobie. Częstość występowania i ciężkość infekcji rotawirusowych znacznie spadła w krajach, które dodały szczepionkę przeciwko rotawirusom do swojej rutynowej polityki szczepień dziecięcych .
Wirusologia
Rodzaje rotawirusów
Istnieje dziewięć gatunków rotawirusa, określanych jako A, B, C, D, F, G, H, I i J. Ludzie są głównie zakażeni gatunkiem rotawirusa A . Gatunki A–I powodują choroby u innych zwierząt, gatunek H u świń, D, F i G u ptaków, I u kotów i J u nietoperzy.
W obrębie rotawirusa A istnieją różne szczepy, zwane serotypami . Podobnie jak w przypadku wirusa grypy , stosuje się podwójny system klasyfikacji oparty na dwóch białkach na powierzchni wirusa. Glikoproteina VP7 definiuje serotypy G, a białko wrażliwe na proteazy VP4 określa serotypy P. Ponieważ dwa geny, które determinują typy G i typy P, mogą być przekazywane oddzielnie wirusom potomnym, znaleziono różne kombinacje. Dla rotawirusa A opracowano system genotypowania całego genomu , który został wykorzystany do określenia pochodzenia szczepów atypowych. Częstość występowania poszczególnych typów G i P jest różna w poszczególnych krajach i latach. Istnieje co najmniej 36 typów G i 51 typów P, ale w zakażeniach ludzi dominuje tylko kilka kombinacji typów G i P. Są to G1P[8], G2P[4], G3P[8], G4P[8], G9P[8] i G12P[8].
Struktura
Genom rotawirusów składa się z 11 unikalnych cząsteczek podwójnej helisy RNA (dsRNA) o łącznej długości 18 555 nukleotydów. Każda helisa lub segment to gen , ponumerowany od 1 do 11 według malejącego rozmiaru. Każdy gen koduje jedno białko , z wyjątkiem genów 9, które kodują dwa. RNA jest otoczony trójwarstwowym ikozaedrycznym kapsydem białkowym . Cząsteczki wirusowe mają średnicę do 76,5 nm i nie są otoczone .
Białka
Istnieje sześć białek wirusowych (VP), które tworzą cząsteczkę wirusa ( wirion ). Te białka strukturalne są nazywane VP1, VP2, VP3, VP4, VP6 i VP7. Oprócz VP istnieje sześć białek niestrukturalnych (NSP), które są produkowane tylko w komórkach zakażonych rotawirusem. Są to tak zwane NSP1 , NSP2 , NSP3 , NSP4 , NSP5 i NSP6 .
Co najmniej sześć z dwunastu białek kodowanych przez genom rotawirusa wiąże RNA . Rola tych białek w replikacji rotawirusa nie jest do końca poznana; uważa się, że ich funkcje są związane z syntezą i pakowaniem RNA w wirionie, transportem mRNA do miejsca replikacji genomu oraz translacją mRNA i regulacją ekspresji genów.
Białka strukturalne
VP1 znajduje się w rdzeniu cząsteczki wirusa i jest enzymem polimerazy RNA zależnej od RNA . W zakażonej komórce enzym ten wytwarza transkrypty mRNA do syntezy białek wirusowych i wytwarza kopie segmentów RNA genomu rotawirusa dla nowo wytworzonych cząstek wirusa.
VP2 tworzy warstwę rdzeniową wirionu i wiąże genom RNA.
VP3 jest częścią wewnętrznego rdzenia wirionu i jest enzymem zwanym transferazą guanylylową . Jest to enzym blokujący , który katalizuje tworzenie czapeczki 5' w potranskrypcyjnej modyfikacji mRNA. Kapturek stabilizuje wirusowe mRNA, chroniąc je przed enzymami degradującymi kwas nukleinowy zwanymi nukleazami .
VP4 znajduje się na powierzchni wirionu, który wystaje jak kolec. Wiąże się z cząsteczkami na powierzchni komórek zwanych receptorami i napędza wnikanie wirusa do komórki. VP4 musi zostać zmodyfikowane przez enzym proteazy trypsynę , który znajduje się w jelitach, w VP5* i VP8*, zanim wirus stanie się zakaźny. VP4 określa stopień zjadliwości wirusa i określa typ P wirusa. U ludzi istnieje związek między grupą krwi ( układ antygenów Lewisa , układ grup krwi AB0 i status wydzielniczy ) a podatnością na infekcje. Niewydzielnicze wydają się odporne na zakażenie typami P[4] i P[8], co wskazuje, że antygeny grup krwi są receptorami dla tych genotypów. Ta oporność zależy od genotypu rotawirusa.
VP6 tworzy większość kapsydu. Jest wysoce antygenowy i może być stosowany do identyfikacji gatunków rotawirusów. Białko to jest wykorzystywane w testach laboratoryjnych na infekcje rotawirusem A.
VP7 to glikoproteina , która tworzy zewnętrzną powierzchnię wirionu. Oprócz funkcji strukturalnych warunkuje typ G szczepu i wraz z VP4 bierze udział w odporności na infekcje.
Niestrukturalne białka wirusowe
NSP1, produkt genu 5, jest niestrukturalnym białkiem wiążącym RNA. NSP1 blokuje również odpowiedź interferonową , część wrodzonego układu odpornościowego, która chroni komórki przed infekcją wirusową. NSP1 powoduje, że proteosom degraduje kluczowe komponenty sygnałowe wymagane do stymulacji produkcji interferonu w zakażonej komórce i odpowiedzi na interferon wydzielany przez sąsiednie komórki.
Cele degradacji obejmują kilka czynników transkrypcyjnych IRF wymaganych do transkrypcji genu interferonu.
NSP2 jest białkiem wiążącym RNA, które gromadzi się w cytoplazmatycznych inkluzjach ( wiroplazmach ) i jest wymagane do replikacji genomu.
NSP3 wiąże się z wirusowymi mRNA w zakażonych komórkach i odpowiada za zatrzymanie syntezy białek komórkowych. NSP3 inaktywuje dwa czynniki inicjacji translacji niezbędne do syntezy białek z mRNA gospodarza.
Po pierwsze, NSP3 wyrzuca białko wiążące poli(A) (PABP) z czynnika inicjacji translacji eIF4F . PABP jest wymagane do wydajnej translacji transkryptów z ogonem 3' poli(A) , który znajduje się w większości transkryptów komórek gospodarza. Po drugie, NSP3 inaktywuje eIF2 poprzez stymulowanie jego fosforylacji. Wydajna translacja mRNA rotawirusa pozbawionego ogona poli(A) 3' nie wymaga żadnego z tych czynników.
NSP4 to wirusowa enterotoksyna wywołująca biegunkę i była pierwszą odkrytą wirusową enterotoksyną. Jest to wiroporyna , która podnosi poziom cytozolowego Ca2+ w komórkach ssaków.
NSP5 jest kodowany przez segment genomu 11 rotawirusa A. W komórkach zakażonych wirusem NSP5 gromadzi się w wiroplazmie.
NSP6 jest białkiem wiążącym kwas nukleinowy i jest kodowany przez gen 11 z otwartej ramki odczytu poza fazą .
| Segment RNA (gen) | Rozmiar ( pary bazowe ) | Białko | UniProt | Masa cząsteczkowa kDa | Lokalizacja | Kopie na cząstkę | Funkcjonować |
|---|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | P22678 | 125 | Na wierzchołkach rdzenia | 12 | Zależna od RNA polimeraza RNA |
| 2 | 2690 | VP2 | A2T3R5 | 102 | Tworzy wewnętrzną powłokę rdzenia | 120 | Wiązanie RNA |
| 3 | 2591 | VP3 | A2T3S5 | 88 | Na wierzchołkach rdzenia | 12 | enzym blokujący mRNA metylotransferazy |
| 4 | 2362 | VP4 | A2T3T2 | 87 | Kolec powierzchniowy | 180 | Przyczepienie komórek, zjadliwość |
| 5 | 1611 | NSP1 | Q99FX5 | 59 | Nie strukturalny | 0 | Wiązanie 5'RNA, antagonista interferonu |
| 6 | 1356 | VP6 | Q6LE89 | 45 | Wewnętrzny kapsyd | 780 | Antygen strukturalny i gatunkowy |
| 7 | 1104 | NSP3 | P03536 | 37 | Nie strukturalny | 0 | Zwiększa aktywność wirusowego mRNA i odcina syntezę białek komórkowych |
| 8 | 1059 | NSP2 | A2T3P0 | 35 | Nie strukturalny | 0 | NTPaza zaangażowana w pakowanie RNA |
| 9 | 1062 | VP7 1 VP7 2 | P03533 | 38 i 34 | Powierzchnia | 780 | Antygen strukturalny i neutralizujący |
| 10 | 751 | NSP4 | P04512 | 20 | Nie strukturalny | 0 | Viroporin ( enterotoksyna ) |
| 11 | 667 | NSP5 NSP6 | A2T3Q9 P11203 | 22 | Nie strukturalny | 0 | Modulator wiązania ssRNA i dsRNA NSP2 , fosfoproteiny |
Ta tabela jest oparta na małpim szczepie rotawirusa SA11. Przypisania kodowania białka RNA różnią się w niektórych szczepach.
Replikacja

- Przyczepienie się wirusa do komórek gospodarza, w którym pośredniczą VP4 i VP7
- Wnikanie wirusa do komórki i odsłanianie kapsydu wirusa
- Synteza nici plus ssRNA (działa jako mRNA), w której pośredniczą VP1, VP3 i VP2
- Tworzenie wiroplazmy, pakowanie wirusowego RNA i synteza ujemnej nici RNA oraz tworzenie dwuwarstwowych cząstek wirusa
- Dojrzewanie cząstek wirusa i uwalnianie potomnych wirionów
Przyłączanie wirusa do komórki gospodarza jest inicjowane przez VP4, który przyłącza się do cząsteczek zwanych glikanami na powierzchni komórki. Wirus wnika do komórek przez endocytozę za pośrednictwem receptora i tworzy pęcherzyk zwany endosomem . Białka w trzeciej warstwie (VP7 i szpic VP4) rozrywają błonę endosomu, powodując różnicę w stężeniu wapnia . Powoduje to rozpad trimerów VP7 na pojedyncze podjednostki białkowe, pozostawiając otoczki białkowe VP2 i VP6 wokół wirusowego dsRNA, tworząc dwuwarstwową cząstkę (DLP).
Jedenaście nici dsRNA pozostaje w zasięgu ochrony dwóch otoczek białkowych, a wirusowa polimeraza RNA zależna od RNA tworzy transkrypty mRNA dwuniciowego genomu wirusa. Pozostając w rdzeniu, wirusowy RNA unika wrodzonych odpowiedzi immunologicznych gospodarza, w tym interferencji RNA , które są wyzwalane przez obecność dwuniciowego RNA.
Podczas infekcji rotawirusy wytwarzają mRNA zarówno do biosyntezy białek, jak i replikacji genów. Większość białek rotawirusa gromadzi się w wiroplazmie, gdzie RNA ulega replikacji i składa się DLP. W wiroplazmie dodatnio sensowne wirusowe RNA, które są stosowane jako matryce do syntezy wirusowego genomowego dsRNA, są chronione przed degradacją RNazy indukowaną przez siRNA . Wiroplazma powstaje wokół jądra komórkowego już dwie godziny po zakażeniu wirusem i składa się z fabryk wirusów, które, jak się uważa, tworzą dwa wirusowe białka niestrukturalne: NSP5 i NSP2. Hamowanie NSP5 przez interferencję RNA in vitro powoduje gwałtowny spadek replikacji rotawirusa. DLP migrują do retikulum endoplazmatycznego , gdzie uzyskują trzecią, zewnętrzną warstwę (tworzoną przez VP7 i VP4). Wirusy potomne są uwalniane z komórki w wyniku lizy .
Przenoszenie

Rotawirusy przenoszone są drogą fekalno-oralną , poprzez kontakt ze skażonymi rękami, powierzchniami i przedmiotami oraz ewentualnie drogą oddechową. Biegunka wirusowa jest wysoce zaraźliwa. Kał zarażonej osoby może zawierać ponad 10 bilionów zakaźnych cząstek na gram; mniej niż 100 z nich jest wymaganych do przeniesienia infekcji na inną osobę.
Rotawirusy są stabilne w środowisku i zostały znalezione w próbkach z ujścia rzeki na poziomie do 1-5 zakaźnych cząstek na galon US. Wirusy przeżywają od 9 do 19 dni. Środki sanitarne odpowiednie do eliminacji bakterii i pasożytów wydają się nieskuteczne w kontroli rotawirusa, ponieważ częstość występowania infekcji rotawirusem w krajach o wysokich i niskich standardach zdrowotnych jest podobna.
objawy i symptomy
Rotawirusowe zapalenie jelit jest chorobą o nasileniu łagodnym do ciężkiego , charakteryzującą się nudnościami , wymiotami , wodnistą biegunką i stanem podgorączkowym . Gdy dziecko zostanie zarażone wirusem, okres inkubacji trwa około dwóch dni, zanim pojawią się objawy. Okres choroby jest ostry. Objawy często zaczynają się od wymiotów, po których następują cztery do ośmiu dni obfitej biegunki. Odwodnienie jest częstsze w zakażeniu rotawirusem niż w większości przypadków wywołanych przez patogeny bakteryjne i jest najczęstszą przyczyną zgonów związanych z zakażeniem rotawirusem.
Zakażenia rotawirusem A mogą występować przez całe życie: pierwsza zwykle daje objawy , ale kolejne infekcje są zazwyczaj łagodne lub bezobjawowe , ponieważ układ odpornościowy zapewnia pewną ochronę. W konsekwencji częstość występowania objawowych infekcji jest najwyższa u dzieci poniżej drugiego roku życia i stopniowo maleje do 45 roku życia. Najpoważniejsze objawy występują zwykle u dzieci w wieku od sześciu miesięcy do dwóch lat, osób starszych i osób z niedoborem odporności . Ze względu na odporność nabytą w dzieciństwie większość dorosłych nie jest podatna na rotawirusa; zapalenie żołądka i jelit u dorosłych zwykle ma inną przyczynę niż rotawirus, ale bezobjawowe infekcje u dorosłych mogą podtrzymywać przenoszenie zakażenia w społeczności. Istnieją dowody sugerujące, że grupa krwi może wpływać na podatność na zakażenie rotawirusami.
Mechanizmy chorobowe
Rotawirusy replikują się głównie w jelicie i infekują enterocyty kosmków jelita cienkiego , prowadząc do strukturalnych i funkcjonalnych zmian nabłonka . Istnieją dowody u ludzi, a zwłaszcza w modelach zwierzęcych, na pozajelitowe rozprzestrzenianie się wirusa zakaźnego do innych narządów i makrofagów.
Biegunka jest spowodowana wielokrotną aktywnością wirusa. Złe wchłanianie występuje z powodu zniszczenia komórek jelitowych zwanych enterocytami . Toksyczne białko rotawirusa NSP4 indukuje zależne od wieku i jonów wapnia wydzielanie chlorków, zakłóca reabsorpcję wody za pośrednictwem transportera SGLT1 (kotransporter sodu/glukozy 2) , najwyraźniej zmniejsza aktywność disacharydaz błony rąbka szczoteczkowego i aktywuje sekrecję zależną od jonów wapnia odruchy jelitowego układu nerwowego . Podwyższone stężenie jonów wapnia w cytozolu (niezbędnych do tworzenia wirusów potomnych) uzyskuje się dzięki działaniu NSP4 jako wiroporyny . Ten wzrost jonów wapnia prowadzi do autofagii (samozniszczenia) zakażonych enterocytów.
NSP4 jest również wydzielany. Ta zewnątrzkomórkowa forma, która jest modyfikowana przez enzymy proteazy w jelitach, jest enterotoksyną, która działa na niezainfekowane komórki poprzez receptory integrynowe , co z kolei powoduje i zwiększa wewnątrzkomórkowe stężenie jonów wapnia, biegunkę sekrecyjną i autofagię.
Wymioty, które są charakterystyczne dla rotawirusowego zapalenia jelit, są powodowane przez wirusa infekującego komórki enterochromafinowe wyściółki przewodu pokarmowego. Infekcja stymuluje produkcję 5' hydroksytryptaminy ( serotoniny ). To aktywuje nerwy błędne, które z kolei aktywują komórki pnia mózgu, które kontrolują odruch wymiotny.
Zdrowe enterocyty wydzielają laktazę do jelita cienkiego; nietolerancja mleka spowodowana niedoborem laktazy jest objawem infekcji rotawirusem, która może utrzymywać się tygodniami. Nawrót łagodnej biegunki często następuje po ponownym wprowadzeniu mleka do diety dziecka, z powodu bakteryjnej fermentacji disacharydowej laktozy w jelitach.
Odpowiedzi immunologiczne
Konkretne odpowiedzi
Rotawirusy wywołują odpowiedź immunologiczną zarówno komórek B, jak i T. Przeciwciała przeciw białkom rotawirusa VP4 i VP7 neutralizują zakaźność wirusa in vitro i in vivo . Wytwarzane są specyficzne przeciwciała klas IgM, IgA i IgG, które, jak wykazano, chronią przed zakażeniem rotawirusem poprzez bierne przeniesienie przeciwciał na inne zwierzęta. Matczyna przezłożyskowa IgG może odgrywać rolę w ochronie noworodków przed zakażeniami rotawirusem, ale z drugiej strony może zmniejszać skuteczność szczepionki.
Wrodzone reakcje
Po zakażeniu przez rotawirusy następuje szybka wrodzona odpowiedź immunologiczna obejmująca interferony typu I i III oraz inne cytokiny (zwłaszcza Th1 i Th2), które hamują replikację wirusa i rekrutują makrofagi i komórki NK do zakażonych rotawirusem komórek. dsRNA rotawirusa aktywuje receptory rozpoznające wzorce, takie jak receptory Toll-like, które stymulują produkcję interferonów. Białko rotawirusa NSP1 przeciwdziała skutkom interferonów typu 1 poprzez tłumienie aktywności białek regulatorowych interferonu IRF3, IRF5 i IRF7.
Markery ochrony
Poziomy IgG i IgA we krwi oraz IgA w jelitach korelują z ochroną przed infekcją. Stwierdzono, że IgG i IgA specyficzne dla rotawirusa w surowicy w wysokich mianach (np. >1:200) mają działanie ochronne i istnieje znacząca korelacja między mianami IgA a skutecznością szczepionki rotawirusowej.
Diagnoza i wykrywanie
Rozpoznanie zakażenia rotawirusem zwykle następuje po rozpoznaniu zapalenia żołądka i jelit jako przyczyny ciężkiej biegunki. Większość dzieci przyjmowanych do szpitala z zapaleniem żołądka i jelit jest poddawana testom na obecność rotawirusa A .
Specyficzną diagnozę zakażenia rotawirusem A stawia się poprzez znalezienie wirusa w kale dziecka za pomocą enzymatycznego testu immunologicznego . Na rynku dostępnych jest kilka licencjonowanych zestawów testowych, które są czułe, specyficzne i wykrywają wszystkie serotypy rotawirusa A . Inne metody, takie jak mikroskopia elektronowa i PCR (łańcuchowa reakcja polimerazy), są wykorzystywane w laboratoriach badawczych. Reakcja łańcuchowa polimerazy z odwrotną transkrypcją ( RT-PCR ) może wykryć i zidentyfikować wszystkie gatunki i serotypy ludzkich rotawirusów.
Leczenie i rokowanie
Leczenie ostrego zakażenia rotawirusem jest niespecyficzne i obejmuje leczenie objawów oraz, co najważniejsze, leczenie odwodnienia . Nieleczone dzieci mogą umrzeć z powodu ciężkiego odwodnienia. W zależności od nasilenia biegunki, leczenie polega na doustnej terapii nawadniającej , podczas której dziecko otrzymuje do picia dodatkową wodę zawierającą określone ilości soli i cukru. W 2004 roku Światowa Organizacja Zdrowia (WHO) i UNICEF zaleciły stosowanie doustnych płynów nawadniających o niskiej osmolarności oraz suplementację cynkiem jako dwutorowe leczenie ostrej biegunki. Niektóre infekcje są na tyle poważne, że uzasadniają hospitalizację, w której płyny podaje się drogą dożylną lub intubacją nosowo-żołądkową , a elektrolity i poziom cukru we krwi dziecka są monitorowane. Infekcje rotawirusowe rzadko powodują inne powikłania, a dla dobrze prowadzonego dziecka rokowanie jest doskonałe. Wykazano, że probiotyki skracają czas trwania biegunki wywołanej przez rotawirusy, a według Europejskiego Towarzystwa Gastroenterologii Dziecięcej „skuteczne interwencje obejmują podawanie określonych probiotyków, takich jak Lactobacillus rhamnosus lub Saccharomyces boulardii , diosmectite lub racecadotril ”.
Zapobieganie
Rotawirusy są wysoce zaraźliwe i nie można ich leczyć antybiotykami ani innymi lekami. Ponieważ poprawa warunków sanitarnych nie zmniejsza częstości występowania choroby rotawirusowej, a odsetek hospitalizacji pozostaje wysoki pomimo stosowania doustnych leków nawadniających, podstawową interwencją w zakresie zdrowia publicznego są szczepienia. W 1998 roku szczepionka rotawirusowa została dopuszczona do użytku w Stanach Zjednoczonych. Badania kliniczne w Stanach Zjednoczonych, Finlandii i Wenezueli wykazały, że jest od 80 do 100% skuteczny w zapobieganiu ciężkiej biegunce wywołanej przez rotawirus A , a naukowcy nie wykryli żadnych statystycznie istotnych poważnych skutków ubocznych . Producent wycofał ją jednak z rynku w 1999 roku, po tym jak odkryto, że szczepionka mogła przyczynić się do zwiększonego ryzyka wystąpienia wgłobienia , rodzaju niedrożności jelit , u jednego na 12 000 zaszczepionych niemowląt. Doświadczenie wywołało intensywną debatę na temat względnego ryzyka i korzyści szczepionki rotawirusowej.
W 2006 roku dwie nowe szczepionki przeciwko zakażeniu rotawirusem A okazały się bezpieczne i skuteczne u dzieci, aw 2009 roku WHO zaleciła włączenie szczepionki rotawirusowej do wszystkich krajowych programów szczepień.
Częstość występowania i ciężkość zakażeń rotawirusem znacznie spadła w krajach, które zastosowały się do tego zalecenia. Przegląd dostępnych danych z badań klinicznych z 2014 r. z krajów rutynowo stosujących szczepionki rotawirusowe w krajowych programach szczepień wykazał, że szczepionki rotawirusowe zmniejszyły liczbę hospitalizacji związanych z rotawirusem o 49–92 procent, a wszystkie powodują hospitalizacje z biegunką o 17–55 procent. W Meksyku, który w 2006 roku był jednym z pierwszych krajów na świecie, które wprowadziły szczepionkę przeciwko rotawirusom, śmiertelność z powodu biegunki spadła w sezonie 2009 o ponad 65 procent wśród dzieci w wieku do 2 lat. W Nikaragui, która w 2006 r. stała się pierwszym krajem rozwijającym się, który wprowadził szczepionkę przeciwko rotawirusowi, liczba ciężkich zakażeń rotawirusem została zmniejszona o 40 procent, a wizyty w izbie przyjęć o połowę. W Stanach Zjednoczonych szczepienia przeciwko rotawirusom od 2006 roku doprowadziły do spadku liczby hospitalizacji związanych z rotawirusem aż o 86 procent. Szczepionki mogły również zapobiegać chorobom u niezaszczepionych dzieci poprzez ograniczenie liczby infekcji krążących. W krajach rozwijających się w Afryce i Azji, gdzie występuje większość zgonów rotawirusa, duża liczba badań dotyczących bezpieczeństwa i skuteczności, a także niedawne badania wpływu i skuteczności po wprowadzeniu Rotarix i RotaTeq wykazały, że szczepionki radykalnie zmniejszają ciężką chorobę wśród niemowląt. We wrześniu 2013 r. szczepionka została zaoferowana wszystkim dzieciom w Wielkiej Brytanii w wieku od dwóch do trzech miesięcy i oczekuje się, że zmniejszy o połowę liczbę przypadków ciężkiej infekcji i zmniejszy liczbę dzieci przyjmowanych do szpitala z powodu infekcji o 70 procent. W Europie wskaźniki hospitalizacji po zakażeniu rotawirusami spadły o 65% do 84% po wprowadzeniu szczepionki. Na całym świecie szczepienia zmniejszyły liczbę przyjęć do szpitala i wizyt na oddziałach ratunkowych średnio o 67%.
Szczepionki przeciwko rotawirusom są licencjonowane w ponad 100 krajach, a ponad 80 krajów wprowadziło rutynowe szczepienia przeciwko rotawirusom, z czego prawie połowa przy wsparciu sojuszu szczepionkowego GAVI . Aby szczepionki rotawirusowe były dostępne, dostępne i przystępne cenowo we wszystkich krajach — szczególnie w krajach o niskich i średnich dochodach w Afryce i Azji, gdzie występuje większość zgonów rotawirusów, PATH (dawniej Program for Appropriate Technology in Health), WHO, USA Centra Kontroli i Zapobiegania Chorobom oraz GAVI nawiązały współpracę z instytucjami badawczymi i rządami w celu generowania i rozpowszechniania dowodów, obniżania cen i przyspieszania wprowadzania.
Szczepionka może zapobiegać cukrzycy typu 1 .
Epidemiologia
Rotawirus A , który odpowiada za ponad 90% rotawirusowego zapalenia żołądka i jelit u ludzi, jest endemiczny na całym świecie. Każdego roku rotawirusy powodują miliony przypadków biegunki w krajach rozwijających się, z czego prawie 2 miliony skutkują hospitalizacją. Szacuje się, że w 2019 r. z powodu infekcji rotawirusem zmarło 151 714 dzieci poniżej piątego roku życia, z których 90 procent znajdowało się w krajach rozwijających się. Prawie każde dziecko zostało zarażone rotawirusami przed ukończeniem piątego roku życia. Rotawirusy są główną pojedynczą przyczyną ciężkiej biegunki u niemowląt i dzieci, odpowiadają za około jedną trzecią przypadków wymagających hospitalizacji i są przyczyną 37% zgonów związanych z biegunką i 5% wszystkich zgonów dzieci poniżej piątego roku życia. Chłopcy dwukrotnie częściej niż dziewczęta trafiają do szpitala z powodu infekcji rotawirusem. W erze przed szczepieniem infekcje rotawirusowe występowały głównie w chłodnych, suchych porach roku. Liczba przypisywana skażeniu żywności jest nieznana.
Epidemie rotawirusa Biegunka jest powszechna wśród hospitalizowanych niemowląt, małych dzieci uczęszczających do żłobków i osób starszych w domach opieki. Wybuch epidemii spowodowany skażoną wodą komunalną miał miejsce w Kolorado w 1981 r. W 2005 r. największa odnotowana epidemia biegunki miała miejsce w Nikaragui. Ta niezwykle duża i poważna epidemia była związana z mutacjami w genomie rotawirusa A , prawdopodobnie pomagając wirusowi uciec przed dominującą odpornością w populacji. Podobna duża epidemia miała miejsce w Brazylii w 1977 roku.
Rotawirus B , zwany także rotawirusem biegunki dorosłych lub ADRV, spowodował poważną epidemię ciężkiej biegunki, która dotyka tysiące ludzi w każdym wieku w Chinach. Epidemie te wystąpiły w wyniku zanieczyszczenia ściekami wody pitnej. Infekcje rotawirusem B wystąpiły również w Indiach w 1998 roku; szczep sprawczy nazwano CAL. W przeciwieństwie do ADRV, szczep CAL jest endemiczny. Do tej pory epidemie wywołane przez rotawirusa B ograniczały się do Chin kontynentalnych , a badania wskazują na brak odporności na ten gatunek w Stanach Zjednoczonych. Rotawirus C jest powiązany z rzadkimi i sporadycznymi przypadkami biegunki u dzieci, a małe ogniska choroby zdarzają się w rodzinach.
Inne zwierzęta
Rotawirusy infekują młode wielu gatunków zwierząt i są główną przyczyną biegunki u dzikich i hodowanych zwierząt na całym świecie. Jako patogen zwierząt gospodarskich, zwłaszcza młodych cieląt i prosiąt, rotawirusy powodują straty ekonomiczne dla rolników ze względu na koszty leczenia związane z wysoką zachorowalnością i śmiertelnością. Te rotawirusy są potencjalnym rezerwuarem wymiany genetycznej z ludzkimi rotawirusami. Istnieją dowody na to, że zwierzęce rotawirusy mogą zarażać ludzi albo przez bezpośrednie przenoszenie wirusa, albo przez dostarczanie jednego lub kilku segmentów RNA do reasortantów z ludzkimi szczepami.
Historia
W 1943 r. Jacob Light i Horace Hodes udowodnili, że filtrowalny czynnik w kale dzieci z biegunką zakaźną powoduje również biegunkę u bydła. Trzy dekady później, zakonserwowane próbki czynnika okazały się być rotawirusem. W międzyczasie wykazano, że wirus u myszy jest spokrewniony z wirusem powodującym podrażnienia. W 1973 Ruth Bishop i współpracownicy opisali pokrewne wirusy występujące u dzieci z zapaleniem żołądka i jelit.
W 1974 r. Thomas Henry Flewett zasugerował nazwę rotawirus po tym, jak zauważył, że cząsteczka rotawirusa oglądana pod mikroskopem elektronowym wygląda jak koło ( po łacinie rota ), nazwa została oficjalnie uznana przez Międzynarodowy Komitet Taksonomii Wirusów cztery lata później. W 1976 r. pokrewne wirusy zostały opisane u kilku innych gatunków zwierząt. Wirusy te, wszystkie powodujące ostre zapalenie żołądka i jelit, zostały uznane za zbiorowy patogen dotykający ludzi i inne zwierzęta na całym świecie. Serotypy rotawirusa zostały po raz pierwszy opisane w 1980 roku, a w następnym roku rotawirusy pochodzące od ludzi po raz pierwszy hodowano w kulturach komórkowych pochodzących z nerek małpy, dodając trypsynę (enzym znajdujący się w dwunastnicy ssaków , który obecnie jest niezbędny do replikacji rotawirusa ). ) do pożywki hodowlanej. Możliwość hodowania rotawirusów w kulturach przyspieszyła tempo badań i w połowie lat 80. oceniano pierwsze szczepionki kandydujące.
Bibliografia
Zewnętrzne linki
-
 Portal medyczny
Portal medyczny
-
 Portal wirusów
Portal wirusów
-
 Multimedia związane z Rotawirusem na Wikimedia Commons
Multimedia związane z Rotawirusem na Wikimedia Commons



![Sezonowa zmienność zakażeń rotawirusem A w Anglii: szczyt liczby infekcji przypada na miesiące zimowe.[141]](https://upload.wikimedia.org/wikipedia/commons/thumb/4/4e/Rotavirus_seasonal_distribution.png/650px-Rotavirus_seasonal_distribution.png)
![Zgony dzieci, którym można było zapobiec w wyniku szczepienia przeciwko rotawirusowi, 2016. Roczna liczba zgonów dzieci w wieku poniżej pięciu lat z powodu rotawirusa, którym można było zapobiec, jeśli osiągnięto pełne pokrycie szczepionką przeciwko rotawirusowi.[142]](https://upload.wikimedia.org/wikipedia/commons/thumb/8/81/Avertable-deaths-from-rotavirus-with-full-vaccine-coverage.png/650px-Avertable-deaths-from-rotavirus-with-full-vaccine-coverage.png)
