Zespół Sjögrena - Sjögren syndrome
| Zespół Sjögrena | |
|---|---|
| Inne nazwy | Zespół Sjögrena, zespół sicca |
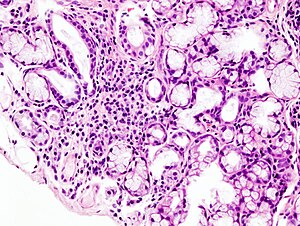 | |
| Obraz z mikroskopu ogniskowego nacieku limfoidalnego w małym gruczole ślinowym związanym z zespołem Sjögrena. | |
| Wymowa | |
| Specjalność |
Immunologia , reumatologia |
| Objawy | Suchość w ustach , suchość oczu , inne obszary suchości |
| Komplikacje | Chłoniak |
| Zwykły początek | Średni wiek |
| Czas trwania | Długoterminowy |
| Powoduje | Choroba autoimmunologiczna (nieznana przyczyna) |
| Metoda diagnostyczna | Biopsja tkanek , badania krwi |
| Diagnostyka różnicowa | Efekt uboczny leków, lęk , sarkoidoza , amyloidoza |
| Leczenie | Sztuczne łzy , leki zmniejszające stan zapalny, zabieg chirurgiczny |
| Rokowanie | Normalna długość życia |
| Częstotliwość | ~0,7% |
Zespół Sjögrena ( SjS , SS ) to długotrwała choroba autoimmunologiczna, która atakuje gruczoły wydzielające wilgoć (łzowe i ślinowe) i często poważnie wpływa na inne układy narządów, takie jak płuca, nerki i układ nerwowy. Podstawowymi objawami są suchość ( suchość w ustach i oczach ), ból i zmęczenie . Inne objawy mogą obejmować suchość skóry , suchość pochwy, przewlekły kaszel, drętwienie rąk i nóg, uczucie zmęczenia , bóle mięśni i stawów oraz problemy z tarczycą . Osoby dotknięte chorobą są również narażone na zwiększone ryzyko wystąpienia chłoniaka (15%) .
Chociaż dokładna przyczyna jest niejasna, uważa się, że wiąże się ona z kombinacją genetyki i czynnika środowiskowego, takiego jak ekspozycja na wirusa lub bakterię . Może wystąpić niezależnie od innych problemów zdrowotnych (pierwotny zespół Sjögrena) lub w wyniku innej choroby tkanki łącznej (wtórny zespół Sjögrena). Zespół Sjögrena może być związany z innymi chorobami autoimmunologicznymi, w tym reumatoidalnym zapaleniem stawów (RZS), toczniem rumieniowatym układowym (SLE) lub twardziną układową. Powstający stan zapalny stopniowo uszkadza gruczoły. Diagnozę przeprowadza się na podstawie biopsji gruczołów wytwarzających wilgoć i badań krwi pod kątem określonych przeciwciał . Podczas biopsji w gruczołach zwykle znajdują się limfocyty .
Chociaż zespół Sjögrena jest jedną z najczęstszych chorób autoimmunologicznych, nie ma swoistych i nieinwazyjnych testów diagnostycznych, a leczenie jest ukierunkowane na opanowanie objawów danej osoby . W przypadku suchego oka można wypróbować sztuczne łzy , leki zmniejszające stan zapalny, zatyczki punktowe lub operację zamknięcia kanalików łzowych . W przypadku suchości w ustach można użyć gumy do żucia (najlepiej bez cukru), wody do popijania lub substytutu śliny . U osób z bólem stawów lub mięśni można zastosować ibuprofen . Leki, które mogą powodować suchość, takie jak leki przeciwhistaminowe , również mogą zostać odstawione. Najbardziej specyficzny istniejący test diagnostyczny wymaga biopsji wargi.
Choroba została opisana w 1933 roku przez Henrika Sjögrena , od którego pochodzi nazwa; istnieje jednak szereg wcześniejszych opisów osób z objawami. Dotyczy to od 0,2 do 1,2% populacji, z czego połowa ma formę pierwotną, a połowa formę wtórną. Kobiety chorują około 10 razy częściej niż mężczyźni. Chociaż choroba zwykle zaczyna się w średnim wieku , może na nią zaatakować każdy. Wśród osób bez innych zaburzeń autoimmunologicznych oczekiwana długość życia pozostaje niezmieniona.
Symptomy i objawy
Charakterystycznym objawem zespołu Sjögrena jest suchość w ustach i suche zapalenie rogówki i spojówki (suche oczy). Może również wystąpić suchość pochwy , suchość skóry i suchość nosa . Zaatakowane mogą być również inne narządy ciała, w tym nerki, naczynia krwionośne, płuca, wątroba, trzustka i mózg.
Suchość skóry u niektórych osób z SS może być wynikiem naciekania limfocytów do gruczołów skórnych . Objawy mogą rozwijać się podstępnie, a diagnoza często nie jest brana pod uwagę przez kilka lat, ponieważ suchość może być spowodowana lekami, suchym środowiskiem lub starzeniem się, lub może być uważana za nieciężką, która uzasadnia poziom badania niezbędny do ustalenia obecności podstawowe zaburzenie autoimmunologiczne.
Zespół Sjögrena może uszkadzać ważne narządy , z objawami, które mogą się stabilizować, pogarszać lub przechodzić w remisję , tak jak w przypadku innych chorób autoimmunologicznych. Niektórzy ludzie mogą odczuwać tylko łagodne objawy suchości oczu i ust, podczas gdy inni mają objawy ciężkiej choroby. Wielu pacjentów może leczyć problemy objawowo . Inni odczuwają niewyraźne widzenie , stały dyskomfort w oku, nawracające infekcje jamy ustnej , obrzęk ślinianek przyusznych , dysfonię ( zaburzenia głosu, w tym chrypkę) oraz trudności w połykaniu i jedzeniu. Wyniszczające zmęczenie i ból stawów mogą poważnie pogorszyć jakość życia. U niektórych pacjentów może rozwinąć się zajęcie nerek (autoimmunologiczne cewkowo-śródmiąższowe zapalenie nerek ), prowadzące do białkomoczu (nadmiar białka w moczu), zaburzenia koncentracji moczu i kwasicy dystalnych kanalików nerkowych .
Komplikacje
Wśród omówionych powyżej powikłań, u kobiet z przeciwciałami anty-Ro/SS-A i anty-La/SS-B, które zajdą w ciążę, częściej występuje toczeń rumieniowaty u noworodków z wrodzonym blokiem serca wymagającym stymulatora . Krioglobulinemia typu I jest znanym powikłaniem zespołu Sjögrena.
Zespół Sjögrena może wpływać na takie narządy, jak wątroba, trzustka, nerki, płuca i ośrodkowy układ nerwowy.
Powiązane warunki
Zespół Sjögrena jest związany z wieloma innymi schorzeniami, z których wiele jest chorobami autoimmunologicznymi lub reumatycznymi , takimi jak celiakia , fibromialgia , SLE (toczeń) , autoimmunologiczne zapalenie tarczycy , stwardnienie rozsiane i spondyloartropatia oraz kilka nowotworów złośliwych , głównie chłoniaka nieziarniczego .
Powoduje
Przyczyna zespołu Sjögrena jest nieznana, ale może to być wpływ kombinacji czynników genetycznych, środowiskowych i innych, tak jak w przypadku wielu innych zaburzeń autoimmunologicznych. W grę może wchodzić około 20 autoprzeciwciał.
Genetyka
Obserwacja wysokiego odsetka zaburzeń autoimmunologicznych w rodzinach z zespołem Sjögrena w wywiadzie wiąże się z genetyczną predyspozycją do tego zespołu. Badania dotyczące polimorfizmów w antygen ludzkich leukocytów (HLA) -DR i HLA-DQ genowe regionów pacjentów Sjogrena pokazują różnicę podatność zespołu, jako wynik różnych typów otrzymanego autoprzeciwciał produkcji.
Hormony
Ponieważ zespół Sjögrena jest związany z dużą częstością występowania u kobiet, uważa się, że hormony płciowe , zwłaszcza estrogeny , wpływają na humoralną i komórkową odpowiedź immunologiczną, wpływając na podatność na zespół. Uważa się, że androgeny zapobiegają autoimmunizacji. Badania na modelach myszy sugerują, że niedobór estrogenów stymuluje prezentację autoantygenów , wywołując objawy podobne do Sjögrena.
Mikrochimeryzm
Mikrochimeryzm komórek płodowych (potomstwo komórek limfoidalnych w krążeniu matczynym ) może generować autoimmunizację u kobiet, które były wcześniej w ciąży . Wytwarzanie potencjału autoimmunologicznego poprzez mikrochimeryzm może prowadzić do przejścia z cichej formy autoimmunizacji z zależnym od wieku spadkiem tolerancji na siebie .
Środowisko
Białka wirusowe , pochłonięte cząsteczki lub zdegradowane struktury własne mogą inicjować autoimmunizację poprzez mimikę molekularną i zwiększać szanse rozwoju zespołu Sjögrena. Wirus Epsteina-Barra , wirusa zapalenia wątroby typu C i ludzkiej białaczki komórek T, wirusa 1 należą do najczęściej badanych czynników infekcyjnych w zespół Sjogrena. Jak dotąd nie zidentyfikowano bezpośredniego związku przyczynowo-skutkowego między tymi patogenami a rozwojem zespołu Sjögrena. Uszkodzone struktury wewnętrzne nakierowane na apoptozę mogą być błędnie wystawione na działanie układu odpornościowego, wywołując autoimmunizację w gruczołach zewnątrzwydzielniczych , które często są podatne na reakcje autoimmunologiczne.
Patogeneza
W patogenetyczne mechanizmy zespołem Sjögrena nie zostały w pełni wyjaśnione, co skutkuje brakiem patofizjologii wiedzy o zarządzaniu tym autoimmunologicznego exocrinopathy . Chociaż liczne czynniki przyczyniające się do postępu tej choroby utrudniły odkrycie dokładnego pochodzenia i przyczyny, główne postępy w ciągu ostatniej dekady przyczyniły się do zaproponowanego zestawu zdarzeń patogennych, które wystąpiły przed rozpoznaniem zespołu Sjögrena.
Zespół Sjögrena został pierwotnie zaproponowany jako specyficzna, samonapędzająca się utrata gruczołów zewnątrzwydzielniczych, w szczególności komórek groniastych i przewodowych, za pośrednictwem układu odpornościowego . Chociaż wyjaśnia to bardziej oczywiste objawy (takie jak brak śliny i płynu łzowego ), nie wyjaśnia bardziej rozpowszechnionych efektów ogólnoustrojowych obserwowanych w postępie choroby.
W obecności podatnego na tło genetyczne , zarówno dla środowiska i hormonalne czynników, które może wywołać przenikanie limfocytów, szczególnie limfocytów T CD4 + , limfocytów B i komórek plazmatycznych , co powoduje zaburzenia w gruczołów ślinowych i w gruczołach łzowych.
Zespół Sjögrena jest związany ze zwiększonymi poziomami w płynie mózgowo-rdzeniowym (CSF) IL-1RA , antagonisty interleukiny 1 . Sugeruje to, że choroba zaczyna się od zwiększonej aktywności układu interleukiny 1, po której następuje autoregulacja w górę IL-1RA w celu zmniejszenia skutecznego wiązania interleukiny 1 z jej receptorami. Interleukina 1 prawdopodobne jest markerem na zmęczenie, ale zwiększona IL-1RA występuje w płynie mózgowo-rdzeniowym i wiąże się ze zwiększonym zmęczenia przez cytokiny indukowane problem chorobowy . Jednak zespół Sjögrena charakteryzuje się obniżonym poziomem IL-1ra w ślinie, która może być odpowiedzialna za stan zapalny i suchość jamy ustnej. Pacjenci z wtórnym zespołem Sjögrena również często wykazują oznaki i objawy pierwotnych zaburzeń reumatycznych, takich jak toczeń rumieniowaty układowy , reumatoidalne zapalenie stawów lub twardzina układowa .
Genetyczne predyspozycje
Locus najsilniej powiązane z pierwotnym SS jest główny układ zgodności tkankowej / ludzki antygen leukocytów (MHC / HLA) obszar, jak wykazano we wstępnym wyników pierwszego badania asocjacji genomu . Badanie to obejmowało dane z odkrytej kohorty 395 pacjentów europejskiego pochodzenia z pierwotnym zespołem Sjögrena i 1975 zdrowych osób z grupy kontrolnej oraz z badania replikacji obejmującego 1234 przypadki i 4779 zdrowych osób z grupy kontrolnej. Wykryto również asocjacje z polimorfizmami zlokalizowanymi w sześciu niezależnych loci; IRF5 , Stat4 , BLK , IL12A , TNIP1 , a CXCR5 . Sugerowało to również aktywację wrodzonego układu odpornościowego , w szczególności przez układ IFN, aktywację komórek B poprzez kierowaną przez CXCR5 rekrutację do pęcherzyków limfatycznych i aktywację receptora komórek B (BCR) z udziałem BLK oraz aktywację komórek T dzięki podatności na HLA i oś IL-12-IFN-y.
Pacjenci o różnym pochodzeniu etnicznym są nosicielami różnych alleli podatności na HLA , z których HLA-DR i HLA-DQ są zaangażowane w patogenezę zespołu Sjögrena. Na przykład pacjenci z Europy Północnej i Zachodniej oraz z Ameryki Północnej wykazują wysoką częstość występowania genów B8, DRw52 i DR3 . Allele HLA klasy II są związane raczej z obecnością określonych podzbiorów autoprzeciwciał niż z samą chorobą. Autoprzeciwciała odnoszą się do utraty tolerancji limfocytów B prowadzącej do wytwarzania przeciwciał skierowanych przeciwko różnym antygenom narządowo-specyficznym i niespecyficznym narządowo. Związek między HLA i SS jest ograniczony do pacjentów z przeciwciałami anty-SSA/Ro lub anty-SSB/La. Seropozytywność dla przeciwciał anty-Ro i anty-La jest związana z większym nasileniem i dłuższym czasem trwania choroby, a odkrycia dotyczące ich dużej obfitości w gruczołach ślinowych pacjentów Sjögrena sugerują ich niezbędną rolę w patogenezie SS.
Poza genetyką, nieprawidłowości epigenetyczne związane z metylacją DNA , acetylacją histonów lub ekspresją mikroRNA prawdopodobnie odgrywają kluczową rolę w patogenezie chorób autoimmunologicznych, w tym zespołu Sjögrena, chociaż badania w tym zakresie są bardzo ograniczone.
Wyzwalacze środowiskowe
Czynniki środowiskowe, takie jak wirusowa infekcja gruczołów , mogą pobudzać komórki nabłonka do aktywacji wrodzonego układu odpornościowego niezależnego od HLA poprzez receptory Toll-like . Chociaż w patogenezie zespołu Sjögrena bierze udział wiele zakaźnych, egzogennych czynników, takich jak wirus Epsteina-Barra (EBV), ludzki wirus T-limfotropowy 1 i wirus zapalenia wątroby typu C , ich związek z zespołem Sjögrena wydaje się słaby. Chociaż wirus EBV jest obecny w gruczołach ślinowych zdrowych osób, donoszono o wysokiej częstości reaktywacji wirusa EBV u pacjentów z chorobą Sjögrena przy podwyższonych poziomach DNA wirusa EBV . Wskazuje to na reaktywację wirusa i niezdolność nacieków limfoidalnych do kontrolowania replikacji EBV w zespole Sjögrena, co prowadzi do zainicjowania lub utrwalenia odpowiedzi immunologicznej w narządach docelowych. Nie wyjaśniono jednak dokładnie, w jaki sposób indukowana jest reaktywacja wirusa EBV w zmianach chorobowych pacjentów z zespołem Sjögrena oraz jakie specyficzne mechanizmy molekularne są zaangażowane w proces reaktywacji wirusa.
Zapalenie
Komórki nabłonkowe w zmianach chorobowych zespołu Sjögrena są aktywnymi uczestnikami indukcji i utrwalania procesu zapalnego. Uważa się, że czynniki środowiskowe i hormonalne, w połączeniu z odpowiednim podłożem genetycznym, wywołują zespół Sjögrena, który rozregulowuje komórki nabłonka i umożliwia nieprawidłowe zasiedlanie i aktywację komórek dendrytycznych (DC), limfocytów T i limfocytów B. Komórki dendrytyczne to komórki prezentujące antygen, które przetwarzają materiał antygenowy i prezentują go innym limfocytom T. Po migracji limfocytów do gruczołów w odpowiedzi na chemokiny i specyficzne cząsteczki adhezyjne limfocyty T wchodzą w interakcję z komórkami nabłonka. Komórki nabłonkowe są dalej aktywowane przez prozapalne cytokiny (IL-1β, IFN-γ i TNF), które są wytwarzane przez sąsiadujące komórki T. Ważna wydaje się wczesna akumulacja plazmacytoidalnych komórek dendrytycznych w tkankach docelowych, które wytwarzają wysoki poziom IFN typu 1, ponieważ komórki te mogą dalej rozregulować odpowiedź immunologiczną poprzez nieprawidłowe zatrzymywanie limfocytów w tkankach i ich późniejszą aktywację. IFN-α stymuluje wytwarzanie czynnika aktywującego komórki B (BAFF) przez komórki nabłonkowe, DC i limfocyty T. BAFF stymuluje nieprawidłowe dojrzewanie limfocytów B, prowadząc do pojawienia się samoreaktywnych limfocytów B, które lokalnie wytwarzają autoprzeciwciała, w strukturze przypominającej centrum rozmnażania ( podobne do GC), które jest również miejscem limfogenezy (pochodzenia chłoniaka ).
Zaprogramowana śmierć komórki
Uważa się, że dysregulacja apoptozy (programowana śmierć komórki) odgrywa rolę w patogenezie różnych chorób autoimmunologicznych, chociaż jej rola w zespole Sjögrena jest kontrowersyjna. Zarówno białka ligandu Fas, jak i Fas ulegają nadekspresji u pierwotnych pacjentów z chorobą Sjögrena, podczas gdy ekspresja BCL-1 , o której wiadomo, że zmniejsza apoptozę, została znacznie zmniejszona w komórkach nabłonka groniastych i przewodowych pacjentów z chorobą Sjögrena w porównaniu z osobami zdrowymi. Badania in situ nie wykazały zwiększonej apoptozy wśród gruczołowych komórek nabłonka, ale wykazały zmniejszoną apoptozę wśród naciekających komórek jednojądrzastych. Zmniejszona apoptoza była również powiązana z akumulacją autoreaktywnych komórek B znajdujących się w gruczołach. Związek autoprzeciwciał wyrażanych w zespole Sjögrena z apoptozą jest wciąż badany.
Czynniki hormonalne
Hormony płciowe wydają się wpływać na humoralną i komórkową odpowiedź immunologiczną, a estrogen uważany jest za jeden z największych czynników odpowiedzialnych za dymorfizm immunologiczny płci . Wydaje się, że niedobór estrogenów odgrywa rolę w rozwoju zespołu Sjögrena. Postawiono hipotezę, że podawanie androgenów na powierzchnię oka może służyć jako skuteczna terapia suchego oka.
Diagnoza
Diagnozowanie zespołu Sjögrena (SS) jest skomplikowane ze względu na zakres objawów, jakie może przejawiać pacjent, oraz podobieństwo objawów zespołu Sjögrena i innych schorzeń. Ponadto pacjenci z objawami SS podchodzą do różnych specjalności leczenia, co może utrudniać diagnozę. Ponieważ suchość oczu i suchość w ustach są bardzo częstymi objawami i często występują u osób powyżej 40 roku życia, osoby dotknięte chorobą mogą wierzyć, że objawy są związane z wiekiem, więc zignoruj je. Niektóre leki mogą powodować objawy podobne do objawów zespołu Sjögrena. Połączenie kilku testów, które można wykonać w serii, może ostatecznie zdiagnozować zespół Sjögrena.
Badania krwi można wykonać w celu ustalenia, czy pacjent ma wysoki poziom przeciwciał wskazujących na stan, takich jak przeciwciało przeciwjądrowe (ANA) i czynnik reumatoidalny (ponieważ zespół Sjögrena często występuje wtórnie do reumatoidalnego zapalenia stawów), które są związane z chorobami autoimmunologicznymi . Typowe wzorce SS ANA to SSA/Ro i SSB/La , z których anty-SSB/La jest znacznie bardziej specyficzne; anty-SSA/Ro jest związane z wieloma innymi chorobami autoimmunologicznymi, ale często występuje w SS, ale testy anty-SSA i anty-SSB często nie są pozytywne w SS.
Rose Bengal w teście stosuje się plamę środki przedstawienia i funkcji gruczołów łzowych . Ten test polega na nałożeniu na oczy nietoksycznego barwnika róż bengalski. Charakterystyczny kolor barwnika pomaga w określeniu stanu i funkcjonowania filmu łzowego oraz szybkości parowania łez. Każda charakterystyczna zmiana koloru może wskazywać na SS, ale potwierdzenie stanu wymaga wielu powiązanych narzędzi diagnostycznych .
Test Schirmera mierzy wytwarzanie łez: pasek bibuły filtracyjnej trzyma się wewnątrz dolnej powieki przez pięć minut, a następnie mierzy się jego wilgotność za pomocą linijki. Wytwarzanie mniej niż 5 mm (0,20 cala) cieczy zwykle wskazuje na SS. Ta analiza pomiarowa różni się wśród osób w zależności od innych schorzeń związanych z oczami i leków stosowanych podczas wykonywania testu. Badanie w lampie szczelinowej może ujawnić suchość na powierzchni oka.
Objawy suchości w jamie ustnej i jamie ustnej są spowodowane zmniejszoną produkcją śliny z gruczołów ślinowych ( ślinianki przyusznej , podżuchwowej i podjęzykowej ). Aby sprawdzić stan gruczołów ślinowych i produkcję śliny, wykonuje się test szybkości wypływu śliny, w którym osoba jest proszona o wyplucie jak najwięcej do kubka, a uzyskana próbka śliny jest pobierana i ważona. Wyniki tego testu mogą określić, czy gruczoły ślinowe funkcjonują prawidłowo. Niewystarczająca ilość wyprodukowanej śliny może oznaczać, że osoba ma SS. Alternatywnym testem jest niestymulowane pobieranie wypływu całej śliny, w którym osoba pluje do probówki co minutę przez 15 minut. Wynikowy zbiór mniej niż 1,5 ml (0,053 imp fl oz; 0,051 US fl oz) jest uważany za wynik pozytywny.
Biopsja wargi/gruczołu ślinowego pobiera próbkę tkanki, która może ujawnić limfocyty skupione wokół gruczołów ślinowych oraz uszkodzenia tych gruczołów spowodowane stanem zapalnym. Ten test polega na pobraniu próbki tkanki z wewnętrznej wargi/gruczołu ślinowego osoby i zbadaniu jej pod mikroskopem . Ponadto wykonywany jest sialogram , specjalny test rentgenowski , aby sprawdzić, czy w przewodach ślinowych (tj. ślinianki przyusznej ) nie ma niedrożności i ile śliny wpływa do jamy ustnej.
Procedury radiologiczne są dostępne jako wiarygodne i dokładne badanie zespołu Sjögrena. Środek kontrastowy wstrzykuje się do przewodu przyusznego, który otwiera się od policzka do przedsionka jamy ustnej naprzeciwko szyjki drugiego zęba trzonowego górnego . Badania histopatologiczne powinny wykazać ogniskowe limfocytarne zapalenie sialadenitis . Obiektywne dowody na zajęcie gruczołów ślinowych są testowane za pomocą badań ultrasonograficznych , poziomu niestymulowanego wypływu całej śliny, sialografii lub scyntygrafii ślinianek oraz autoprzeciwciał przeciwko antygenom Ro (SSA) i/lub La (SSB).
Zespół Sjögrena można wykluczyć u osób po przebytej radioterapii głowy i szyi , zespole nabytego niedoboru odporności , wcześniej istniejącym chłoniaku , sarkoidozie , chorobie przeszczep przeciwko gospodarzowi oraz stosującym leki antycholinergiczne .
Zapobieganie
Nie istnieje żaden mechanizm zapobiegania zespołowi Sjögrena (SS) ze względu na jego złożoność jako zaburzenie autoimmunologiczne, ale zmiany stylu życia mogą zmniejszyć czynniki ryzyka związane z rozwojem SS lub zmniejszyć nasilenie stanu u pacjentów, którzy zostali już zdiagnozowani. Dieta jest silnie związana z zapaleniem obserwowanym w wielu chorobach autoimmunologicznych, w tym SS. W badaniu eksperymentalnym stwierdzono, że pacjenci z SS często wykazują wysoką wrażliwość na gluten, co bezpośrednio wiąże się ze stanem zapalnym. Umiarkowana aktywność fizyczna jest również pomocna u pacjentów z SS, głównie zmniejszając efekt zapalenia płuc.
Leczenie
Nie jest znane ani lekarstwo, ani specyficzne leczenie zespołu Sjögrena, które trwale przywraca wydzielanie gruczołów . Zamiast tego leczenie jest na ogół objawowe i podtrzymujące.
Opieka oka
Terapie zastępujące wilgoć, takie jak sztuczne łzy, mogą złagodzić objawy suchego oka. Niektórzy pacjenci z cięższymi problemami używają gogli, aby zwiększyć lokalną wilgotność lub zakładają zatyczki punktowe, aby pomóc zatrzymać łzy na powierzchni oka przez dłuższy czas.
Dodatkowo cyklosporyna (Restaza) jest dostępna na receptę w leczeniu przewlekłego suchego oka poprzez tłumienie stanu zapalnego, który zakłóca wydzielanie łez. Dostępne są również leki na receptę, które pomagają stymulować wydzielanie śliny, takie jak cewimelina ( Evoxac ) i pilokarpina. Salagen , wytworzona forma pilokarpiny , może być stosowany do wspomagania wytwarzania łez, a także śliny w jamie ustnej i jelitach. Pochodzi z rośliny jaborandi .
Suchość pochwy
U kobiet z zespołem Sjögrena często zgłaszane są suchość pochwy, wulwodynia i dyspareunia (bolesny stosunek płciowy ); Zalecane są osobiste lubrykanty, aby zmniejszyć podrażnienie lub ból, który może wynikać z suchości w okolicy pochwy i sromu .
Układ mięśniowo-szkieletowy
Niesteroidowe leki przeciwzapalne (NLPZ) mogą być stosowane w leczeniu objawów mięśniowo-szkieletowych. Dla osób z ciężkimi powikłaniami , kortykosteroidy lub leki immunosupresyjne mogą być wymagane, a czasem immunoglobulin dożylnych . Pomocne mogą być również leki przeciwreumatyczne modyfikujące przebieg choroby, takie jak metotreksat . Hydroksychlorochina (Plaquenil) to inna opcja i jest ogólnie uważana za bezpieczniejszą niż metotreksat. Jednak te przepisane leki mają szereg skutków ubocznych, takich jak nudności , utrata apetytu , zawroty głowy , wypadanie włosów , bóle brzucha/skurcze , ból głowy , toksyczność wątroby i zwiększone ryzyko infekcji . Ponadto ci, którzy przyjmują leki hamujące układ odpornościowy, są bardziej narażeni na późniejsze zachorowanie na raka .
Systemowe
W przypadku objawów ogólnoustrojowych, w tym zmęczenia, bólu stawów, zapalenia mięśni i neuropatii , często stosuje się biologiczne leki immunosupresyjne , takie jak rytuksymab i belimumab, które działają poprzez patologię limfocytów B i mają mniej toksyczny profil niż tradycyjne schematy immunosupresyjne.
Opieka dentystyczna
Konieczne jest również profilaktyczne leczenie stomatologiczne (i często pomijane przez pacjenta), ponieważ brak śliny związany z kserostomią stwarza idealne środowisko do namnażania się bakterii powodujących próchnicę . Zabiegi obejmują miejscowe stosowanie fluoru w domu w celu wzmocnienia szkliwa zębów oraz częste mycie zębów przez higienistkę stomatologiczną. Istniejące ubytki również muszą być leczone, ponieważ ubytki sięgające do zęba nie mogą być skutecznie leczone samym czyszczeniem zębów i są narażone na wysokie ryzyko rozprzestrzenienia się do miazgi zęba , co prowadzi do utraty witalności i konieczności ekstrakcji lub korzenia terapia kanałowa . Ten schemat leczenia jest taki sam jak dla wszystkich pacjentów z suchością jamy ustnej, na przykład dla osób poddawanych radioterapii głowy i szyi, która często uszkadza gruczoły ślinowe; gruczoły te są bardziej podatne na promieniowanie niż inne tkanki ciała.
Rokowanie
Opublikowane badania dotyczące przeżycia pacjentów z zespołem Sjögrena są pod różnymi względami ograniczone, być może ze względu na stosunkowo małą liczebność próby oraz fakt, że wtórny zespół Sjögrena jest powiązany z innymi chorobami autoimmunologicznymi. Wyniki wielu badań wskazują, że w porównaniu z innymi chorobami autoimmunologicznymi, zespół Sjögrena wiąże się ze szczególnie wysoką częstością występowania złośliwego chłoniaka nieziarniczego , nowotworu białych krwinek. Około 5% pacjentów z SS rozwija jakąś formę złośliwego nowotworu limfoidalnego . Pacjenci z ciężkimi przypadkami są znacznie bardziej narażeni na rozwój chłoniaków niż pacjenci z łagodnymi lub umiarkowanymi przypadkami. Najczęstszym chłoniaki śliny pozawęzłowy chłoniak komórek B strefy brzeżnej ( chłoniak MALT w gruczołach ślinowych) i rozlany chłoniak z dużych komórek B .
Limfogeneza u pacjentów z pierwotnym zespołem Sjögrena jest uważana za proces wieloetapowy, przy czym pierwszym etapem jest przewlekła stymulacja autoimmunologicznych limfocytów B, zwłaszcza limfocytów B, które wytwarzają czynnik reumatoidalny w miejscach docelowych choroby. Zwiększa to częstość mutacji onkogennych , prowadząc do dysfunkcji w punktach kontrolnych autoimmunologicznej aktywacji limfocytów B w celu przekształcenia się w nowotwór złośliwy. Wyniki badań wskazują, że ciągła stymulacja autoimmunologicznych komórek B, prowadząca do subtelnych nieprawidłowości germinalnych w genach, mających określone konsekwencje w komórkach B, co leży u podstaw podatności na chłoniaka.
Poza tym wyraźnie częstszym występowaniem złośliwego NHL, pacjenci Sjögrena wykazują jedynie niewielkie lub klinicznie nieistotne pogorszenie funkcji związanych z określonymi narządami, co wyjaśnia jedyny niewielki wzrost śmiertelności pacjentów Sjögrena w porównaniu z pozostałą częścią populacji.
Zespół Sjögrena wiąże się z dużym obciążeniem chorobą i wykazano, że znacząco obniża jakość życia (QoL), co ma istotny wpływ na zdolność do pracy wynikający ze zwiększonego wskaźnika niepełnosprawności. Zmniejszenie QoL jest podobne do obserwowanego w innych przewlekłych chorobach, takich jak reumatoidalne zapalenie stawów , toczeń i fibromialgia .
Epidemiologia
Zespół Sjögrena (SS) jest drugim co do częstości reumatycznym zaburzeniem autoimmunologicznym, po reumatoidalnym zapaleniu stawów i toczniu rumieniowatym układowym . Nie ma różnic geograficznych w stawkach SS. Zespół Sjögrena odnotowano we wszystkich częściach świata, chociaż wskaźniki regionalne nie zostały dobrze zbadane. W zależności od kryteriów określania częstości występowania, badania szacują częstość występowania SS na od 500 000 do dwóch milionów ludzi w Stanach Zjednoczonych. Szersze badania dotyczące częstości występowania SS obejmują szeroki zakres, z niektórymi doniesieniami o częstości występowania do 3% populacji. Kilka badań wykazało, że częstość występowania tego zespołu waha się od trzech do sześciu na 100 000 rocznie.
Dziewięć na 10 pacjentów SS to kobiety. Oprócz częstości występowania u kobiet, posiadanie krewnego pierwszego stopnia z chorobą autoimmunologiczną i wcześniejsze ciąże zostały zidentyfikowane jako epidemiologiczne czynniki ryzyka. Pomimo mniejszego ryzyka dla mężczyzn, pierwotne SS u mężczyzn ma tendencję do przedstawiania cięższej postaci choroby. Rola rasy i pochodzenia etnicznego w występowaniu choroby jest nieznana.
Chociaż zespół Sjögrena występuje we wszystkich grupach wiekowych, średni wiek zachorowania wynosi od 40 do 60 lat, chociaż aż połowa wszystkich przypadków może pozostać niezdiagnozowana lub niezgłoszona. Częstość występowania SS na ogół wzrasta wraz z wiekiem.
Zespół Sjögrena występuje u 30-50% osób z reumatoidalnym zapaleniem stawów iu 10-25% z toczniem rumieniowatym układowym.
Historia
Jan Mikulicz-Radecki (1850-1905) jest powszechnie uznawany za pierwszym opisie SS. W 1892 roku opisał 42-letniego mężczyznę z powiększeniem ślinianek przyusznych i łzowych związanym z naciekiem okrągłokomórkowym i atrofią groniastych . Jednak kryteria, które Mikulicz ustalił dla diagnozy, często prowadziły do błędnej diagnozy zespołu Mikulicza . Wiele schorzeń, takich jak gruźlica , infekcje, sarkoidoza i chłoniak, przebiega podobnie jak w zespole Mikulicza. Niemniej jednak termin „zespół Mikulicza” jest wciąż używany sporadycznie do opisania nacieków limfocytarnych w biopsjach ślinianek.
W 1930 Henrik Sjógrena (1899/86) okulisty w Jönköping , Szwecja , obserwuje się pacjenta z niskimi wydzieliny łzowe gruczołów ślinowych. Sjögren wprowadził termin suche zapalenie rogówki i spojówki dla objawu suchego oka ( zapalenie rogówki i spojówki ). W 1933 r. opublikował pracę doktorską opisującą 19 kobiet, z których większość była po menopauzie i miała zapalenie stawów, wykazując kliniczne i patologiczne objawy zespołu. Sjögren wyjaśnił, że suche zapalenie rogówki i spojówki, wynikające z niedoboru wody, nie ma związku z kseroftalmią wynikającą z niedoboru witaminy A. Teza Sjögrena nie została dobrze przyjęta, ponieważ Rada Egzaminatorów skrytykowała niektóre aspekty kliniczne.
Po przeprowadzeniu szeroko zakrojonych badań i zebraniu danych, Sjögren opublikował w 1951 r. istotny artykuł, w którym opisano 80 pacjentów z suchym zapaleniem rogówki i spojówki , z których 50 miało również zapalenie stawów. Jego kolejne wyjazdy konferencyjne związane z jego artykułem doprowadziły do międzynarodowego zainteresowania zespołem Sjögrena. Termin „sycące zapalenie rogówki i spojówki” został wymyślony przez samego Sjögrena i zaczął być identyfikowany jako zespół Sjögrena w literaturze, chociaż obecnie może mieć bardziej ogólne zastosowanie.
Badania

Badania nad wieloczynnikowymi chorobami autoimmunologicznymi, takimi jak SS, koncentrują się na poszerzaniu wiedzy na temat choroby, ulepszaniu narzędzi diagnostycznych i znajdowaniu sposobów zapobiegania, leczenia i leczenia choroby. W Wielka Brytania Podstawowej zespół Sjogrena rejestru, tkanka biobank próbek pobranych do badań, wspierane przez Medical Research Council w Wielkiej Brytanii została założona w 2010 roku wspiera badania kliniczne i badania genetyczne zespołem Sjögrena i jest otwarte dla tych, którzy chcą uczestniczyć w badań naukowych i badaczy badających chorobę.
Podobnie jak w przypadku innych chorób autoimmunologicznych, na podatność na zespół Sjögrena duży wpływ ma ludzki antygen leukocytowy. Allele DQA1*05:01, DQB1*02:01 i DRB1*03:01 zidentyfikowano jako czynniki ryzyka , podczas gdy allele DQA1*02:01, DQA1*03:01 i DQB1*05:01 uznano za czynniki ochronne na chorobę. Ustalono również związek między allelami a konkretną rasą. HLA-DQ2 i HLA-B8 generalnie występują u pacjentów rasy kaukaskiej , podczas gdy HLA-DR5 jest spokrewniony z pacjentami z Grecji i Izraela . W przyszłości można przeprowadzić wiele skanów asocjacyjnych całego genomu, aby zidentyfikować kluczowe warianty ryzyka.
Wirusy związane z zespołem Sjögrena obejmują ludzki wirus T-limfotropowy typu 1 ( HTLV-1 ), wirus Epsteina-Barra (EBV), ludzki wirus niedoboru odporności (HIV), wirus zapalenia wątroby typu delta (HDV) i wirus zapalenia wątroby typu C (HCV). .
Niektóre badania wykazały, że brak witaminy A i witaminy D jest związany z chorobą. Stwierdzono, że niedobór witaminy D jest związany z objawami neurologicznymi i obecnością chłoniaka u pacjentów, ale poziomy witaminy A były odwrotnie związane z pozagruczołowymi objawami choroby.
Ślina jest potencjalnym narzędziem diagnostycznym zespołu Sjögrena, ponieważ składnik śliny zmienia się po wystąpieniu choroby. Dzięki nowej technologii miniaturyzacji , zwanej laboratorium na chipie , diagnoza może być wygodniejsza.
Pod względem terapeutycznym w 2007 roku badano liczne przeciwciała monoklonalne . Najbardziej obiecujące okazały się rytuksymab anty- CD20 i epratuzumab anty- CD22 , podczas gdy anty -TNF-α i IFN-α wydawały się mniej skuteczne.
W 2014 r. Fundacja Syndromu Sjögrena ogłosiła pięcioletni cel polegający na skróceniu o połowę średniego czasu do rozpoznania choroby.
Wybitne przypadki
- Shannon Boxx ( amerykański piłkarz olimpijski ) ma zarówno zespół Sjögrena, jak i toczeń .
- Carrie Ann Inaba (piosenkarka-aktorka) jest ambasadorką świadomości narodowej i rzecznikiem Fundacji Syndromu Sjögrena.
- Wenus Williams (mistrzyni świata w tenisie ) została zdiagnozowana na zespół Sjögrena i powiedziała, że od lat boryka się ze zmęczeniem .
- Stephen McPhail (zawodowy piłkarz Irlandii, Leeds i Cardiff City) zdiagnozowano chłoniaka i zespół Sjögrena w wieku 29 lat.
Bibliografia
- Część oryginalnego tekstu tego artykułu została uzyskana z zasobów domeny publicznej w NIH
Zewnętrzne linki
- Zespół Sjögrena w NHS Choices
- Zespół Sjögrena – Amerykański Narodowy Instytut Zapalenia Stawów oraz Chorób Mięśniowo-Szkieletowych i Skóry
- Fundacja US Sjögrena
- Cena, EJ; Rauz, S; Tappuni, AR; Sutcliffe, N; Hacketta, KL; Barone, F; Granata, G; Ng, WF; Fisher, licencjat; Bombardieri, M; Astorri, E; Empson, B; Larkin, G; Crampton, B; Bowman SJ; British Society for Rheumatology Standards, Guideline and Audit Working, Group. (1 października 2017). „Wytyczne Brytyjskiego Towarzystwa Reumatologicznego dotyczące postępowania z osobami dorosłymi z pierwotnym zespołem Sjögrena” . Reumatologia . 56 (10): e24–e48. doi : 10.1093/reumatologia/kex166 . PMID 28957550 .
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |


