Stria terminalis - Stria terminalis
| Stria terminalis | |
|---|---|
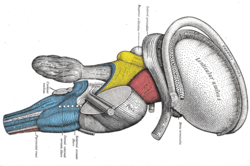 Wycięcie pnia mózgu. Widok z boku. (Stria terminalis oznaczone w prawym górnym rogu.)
| |
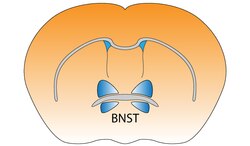 Jądro łożyskowe prążkowia końcowego mózgu myszy
| |
| Detale | |
| Identyfikatory | |
| łacina | stria terminalis |
| NeuroNames | 286 |
| NeuroLex ID | birnlex_937 |
| TA98 | A14.1.09.275 |
| TA2 | 5592 |
| FMA | 61974 |
| Anatomiczne warunki neuroanatomii | |
Terminalis prążek (lub zacisk prążek ) jest konstrukcją w mózgu, składający się z zespołu włókien biegnących wzdłuż brzegu bocznego komory powierzchni wzgórza . Służy jako główna droga wyjściowa ciała migdałowatego , prążek końcowy biegnie od jej środkowo-przyśrodkowego podziału do brzuszno - przyśrodkowego jądra podwzgórza .
Anatomia
Stria terminalis pokrywa górną żyłę wzgórzową wzgórza , wyznaczając linię oddzielenia między wzgórzem a jądrem ogoniastym, jak widać po rozcięciu dużych komór mózgu, patrząc od strony górnej.
Prążek krańcowy rozciąga się od obszaru międzykomorowej czaszkowych do czasowego klaksonu do komory bocznej , przenoszenia włókien z jądra migdałowatego na przegrody jąder , podwzgórze i wzgórzowym obszarach mózgu. Przenosi również włókna wystające z tych obszarów z powrotem do ciała migdałowatego.
Jądro łożysko prążkowia końcowego (BNST)
Aktywność jądra łożyskowego stria terminalis koreluje z lękiem w odpowiedzi na monitorowanie zagrożenia. Uważa się, że działa jako punkt przekaźnikowy w obrębie osi podwzgórze-przysadka-nadnercza i reguluje jej aktywność w odpowiedzi na ostry stres . Jednak reakcja na stres jest zależna od czasu, a BNST nie aktywuje się w przypadku strachu kontekstualnego. Oznacza to, że nagła przerażająca sytuacja, która trwa krócej niż dziesięć minut, nie aktywuje BNST. Uważa się również, że promuje hamowanie behawioralne w odpowiedzi na nieznane osoby, poprzez dane wejściowe z kory oczodołowo-czołowej . Wykazano, że obustronne zakłócenie tego szlaku osłabia nawrót zachowań związanych z poszukiwaniem narkotyków u gryzoni.
Wiadomo, że jądro to wysyła włókna hamujące do bocznego podwzgórza i uczestniczy w kontrolowaniu żerowania gryzoni. Optogenetyczna aktywacja tego hamującego szlaku szybko spowodowała żarłoczne zachowania żywieniowe u dobrze odżywionych myszy, a optogenetyczne zahamowanie tego szlaku zmniejsza spożycie pokarmu nawet u głodnych zwierząt.
Dymorfizm płciowy
Centralny podział jądra łożyskowego prążkowia końcowego (BSTc) jest dymorficzny płciowo . Średnio BSTc jest dwukrotnie większy u mężczyzn niż u kobiet i zawiera dwa razy więcej neuronów somatostatyny . Próbkę sześć sekcji zwłok, długotrwałe hormonalnej terapii zastępczej (HTZ), leczonych kobiet trans (mężczyzna-żeńskie) okazały się mieć żeńską typowe liczby komórek w BSTC, podczas gdy trans człowieka (żeńskie do -meńskie) miało typową dla mężczyzny liczbę. Autorzy (Jiang-Ning Zhou, Frank PM Kruijver, Dick Swaab ) również zbadali osoby z zaburzeniami hormonalnymi i nie znaleźli żadnego wzorca między tymi zaburzeniami a BSTc, podczas gdy pojedynczy nieleczony transseksualista mężczyzna do kobiety miał typową dla kobiet liczbę komórki. Doszli do wniosku, że BSTc dostarcza dowodów na neurobiologiczne podstawy tożsamości płciowej i zaproponowali, że została ona określona przed urodzeniem.
Wykazano, że hormonalna terapia zastępcza wpływa na rozmiar podwzgórza, mimo że badanie próbowało to zrobić, włączając nietransseksualną grupę kontrolną mężczyzn i kobiet, u których z różnych powodów medycznych wystąpiło odwrócenie hormonów. Stwierdzenie o neurobiologicznych podstawach od urodzenia zostało później zakwestionowane, choć nie zostało odrzucone, przez dalsze badanie tej samej grupy, które wykazało, że dymorfizm płciowy BSTc nie występuje przed osiągnięciem dorosłości (około 22 lat) nawet chociaż transseksualiści twierdzą, że są świadomi swojej tożsamości płciowej od dzieciństwa.
Ponieważ neurony wykazujące ekspresję somatostatyny zazwyczaj blokują dendrytyczne sygnały wejściowe do neuronu postsynaptycznego, hamując w ten sposób sygnały przemieszczające się przez powiązane struktury, uważa się, że większe jądro łoża prążkowia końcowego występujące u mężczyzn (w tym u mężczyzn transpłciowych) zmniejsza reakcję przestrachu u mężczyzn i może być odpowiedzialnym za częstsze występowanie fobii specyficznych u kobiet i być może źródłem stereotypu, że kobiety boją się myszy.
Aktywność receptora oksytocyny w BNST jest ważna dla społecznego rozpoznania u szczurów. Zarówno samce, jak i samice szczurów, które otrzymały mikroiniekcję antagonisty receptora oksytocyny, miały niższe wyniki społecznego uznania niż szczury, które otrzymały zastrzyk nośnika, a mikroiniekcje oksytocyny do BNST zwiększały pamięć społeczną u samców, ale nie samic szczurów.
Zmniejszenie rozmiaru jądra łożyskowego prążkowia końcowego zaobserwowano u sprawców pedofilów płci męskiej, oprócz zmniejszenia prawego ciała migdałowatego, podwzgórza i nieprawidłowości w strukturach pokrewnych. Autorzy sugerują, że dziecięcy deficyt BNST i ciała migdałowatego przyśrodkowego może powodować zahamowanie dojrzałości płciowej.
Bibliografia
- ^ Somerville L, Whalen P, Kelley W (2010). „Jądro łoża ludzkiego w Stria Terminalis indeksuje monitorowanie hiperwigilnych zagrożeń” . Biol Psychiatry . 68 (5): 416–424. doi : 10.1016 / j.biopsych.2010.04.002 . PMC 2921460 . PMID 20497902 .
- ^ Choi D, Furay A, Evanson N, Ostrander M, Ulrich-Lai Y, Herman J (2007). „Jądro łoża podregionów Stria Terminalis w różny sposób reguluje aktywność osi podwzgórze-przysadka-nadnercza: implikacje dla integracji wejść limbicznych” . J Neurosci . 27 (8): 2025–34. doi : 10.1523 / JNEUROSCI.4301-06.2007 . PMC 6673539 . PMID 17314298 .
- ^ Hammack SE, Todd TP, Kocho-Schellenberg M, Bouton ME (2015). „Rola jądra łóżka Stria Terminalis w nabywaniu kontekstowego strachu w długich lub krótkich odstępach czasu między kontekstem i szokiem” . Behawioralna neuronauka . 129 (5): 673–678. doi : 10.1037 / bne0000088 . PMC 4586907 . PMID 26348716 .
- ^ Fox A, Shelton S, Oakes T, Converse A, DavidsonR, Kalin N (2010). „Uszkodzenia kory oczodołowo-czołowej zmieniają aktywność związaną z lękiem w jądrze łóżka naczelnych Stria Terminalis” . J Neurosci . 30 (20): 7023–27. doi : 10.1523 / JNEUROSCI.5952-09.2010 . PMC 2915894 . PMID 20484644 . CS1 maint: wiele nazw: lista autorów ( link )
- ^ Suzanne Erb · Natalina Salmaso · Demetra Rodaros Jane Stewart (2001). „Rola szlaku zawierającego CRF od centralnego jądra ciała migdałowatego do jądra łożyskowego prążkowia końcowego w wywołanym stresem przywróceniu poszukiwań kokainy u szczurów”. Psychofarmakologia . 158 (4): 360–65. doi : 10.1007 / s002130000642 . PMID 11797056 . S2CID 23284158 .
- ^ Jennings, Joshua H .; Rizzi, Giorgio; Stamatakis, Alice M .; Ung, Randall L .; Stuber, Garret D. (27.09.2013). „Architektura hamująca obwodu podwzgórza bocznego organizuje karmienie” . Science . 341 (6153): 1517–1521. doi : 10.1126 / science.1241812 . ISSN 0036-8075 . PMC 4131546 . PMID 24072922 .
- ^ Swaab D (2007). „Zróżnicowanie płciowe mózgu i zachowania”. Best Practice Res Clin Endocrinol Metab . 21 (3): 431–44. doi : 10.1016 / j.beem.2007.04.003 . PMID 17875490 .
- ^ a b Zhou J, Hofman M, Gooren L, Swaab D (1995). „Różnica płci w ludzkim mózgu i jej związek z transseksualnością” . Natura . 378 (6552): 68–70. Bibcode : 1995Natur.378 ... 68Z . doi : 10.1038 / 378068a0 . hdl : 20.500.11755 / 9da6a0a1-f622-44f3-ac4f-fec297a7c6c2 . PMID 7477289 . S2CID 4344570 .
- ^ Kruijver F, Zhou J, grupa C, Hofman M, Gooren L, Swaab D (2000). „Transseksualiści płci męskiej i żeńskiej mają liczbę żeńskich neuronów w jądrze limbicznym” . J. Clin. Endocrinol. Metab . 85 (5): 2034–41. doi : 10.1210 / jcem.85.5.6564 . PMID 10843193 .
- ^ Hulshoff Pol HE, Cohen-Kettenis PT, Van Haren NE, Peper JS, Brans RG, Cahn W i wsp. (2006). „Zmiana płci zmienia mózg: wpływ testosteronu i estrogenu na strukturę mózgu dorosłego człowieka” . European Journal of Endocrinology . 155 (Dodatek 1): S107 – S114. doi : 10.1530 / eje.1.02248 .
- ^ Chung W, De Vries G, Swaab D (2002). „Różnicowanie płciowe jądra łożyskowego prążkowia końcowego u ludzi może sięgać wieku dorosłego” . J Neurosci . 22 (3): 1027–33. doi : 10.1523 / JNEUROSCI.22-03-01027.2002 . PMC 6758506 . PMID 11826131 .
- ^ Cameron, Alasdair (2004). Crash Course Psychiatry . ISBN Elsevier Ltd. 978-0-7234-3340-8 .
- ^ Dumais, KM; Alonso, AG; Immormino, MA; Bredewold, R; Veenema, AH (luty 2016). „Zaangażowanie układu oksytocyny w jądrze łożyskowym prążkowia końcowego w regulację rozpoznawania społecznego specyficzną dla płci” . Psychoneuroendokrynologia . 64 : 79–88. doi : 10.1016 / j.psyneuen.2015.11.007 . PMC 4698213 . PMID 26630388 .
- ^ Schiltz K, Witzel J, Northoff G, Zierhut K, Gubka U, Fellman H, Kaufmann J, Tempelmann C, Wiebking C, Bogerts B (2007). „Patologia mózgu u przestępców pedofilskich: Dowody na zmniejszenie objętości prawego ciała migdałowatego i powiązanych struktur międzymózgowych” . Archiwa Psychiatrii Ogólnej . 64 (6): 737–746. doi : 10.1001 / archpsyc.64.6.737 . PMID 17548755 .
