Plamica trombocytopeniczna zakrzepowa - Thrombotic thrombocytopenic purpura
| Plamica trombocytopeniczna zakrzepowa | |
|---|---|
| Inne nazwy | zespół Moschcowitza, idiopatyczna zakrzepowa plamica małopłytkowa |
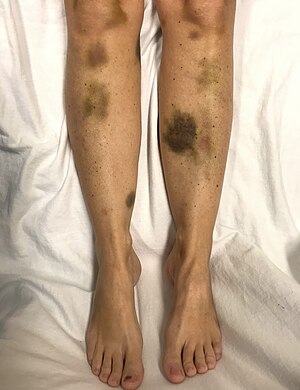 | |
| Spontaniczne siniaki u kobiety z krytycznie niskimi płytkami krwi | |
| Specjalność | Hematologia |
| Objawy | Duże siniaki , gorączka , osłabienie, duszność , splątanie, ból głowy |
| Zwykły początek | Wiek dojrzały |
| Powoduje | Nieznane, infekcje bakteryjne , niektóre leki, choroby autoimmunologiczne , ciąża |
| Metoda diagnostyczna | Na podstawie objawów i badań krwi |
| Diagnostyka różnicowa | Zespół hemolityczno-mocznicowy (HUS), atypowy zespół hemolityczno-mocznicowy (aHUS) |
| Leczenie | Wymiana osocza , leki immunosupresyjne |
| Rokowanie | < 20% ryzyko śmierci |
| Częstotliwość | 1 na 100 000 osób |
Zakrzepowa plamica małopłytkowa ( TTP ) to zaburzenie krwi, które powoduje powstawanie zakrzepów krwi w małych naczyniach krwionośnych w całym ciele. Skutkuje to niską liczbą płytek krwi , niską liczbą czerwonych krwinek z powodu ich rozpadu , a często także dysfunkcją nerek , serca i mózgu . Objawy mogą obejmować duże siniaki , gorączkę , osłabienie, duszność , splątanie i ból głowy . Mogą wystąpić powtarzające się epizody.
W około połowie przypadków zidentyfikowano wyzwalacz, podczas gdy w pozostałych przyczyna pozostaje nieznana. Znane wyzwalacze obejmują infekcje bakteryjne , niektóre leki, choroby autoimmunologiczne, takie jak toczeń i ciąża . Podstawowy mechanizm zazwyczaj obejmuje przeciwciała hamujące enzym ADAMTS13 . To powoduje przerwy zmniejszona dużych multimerów z czynnikiem von Willebranda (vWF) na mniejsze jednostki. Rzadziej TTP jest dziedziczone od rodziców danej osoby , znane jako zespół Upshawa-Schulmana , tak że dysfunkcja ADAMTS13 jest obecna od urodzenia. Diagnoza jest zazwyczaj oparta na objawach i badaniach krwi. Może być wspierany przez pomiar aktywności lub przeciwciał przeciwko ADAMTS13.
Dzięki wymianie osocza ryzyko śmierci spadło z ponad 90% do mniej niż 20%. Można również stosować leki immunosupresyjne , takie jak glikokortykoidy i rytuksymab . Zasadniczo nie zaleca się transfuzji płytek krwi .
Około 1 na 100 000 osób jest dotkniętych. Początek występuje zwykle w wieku dorosłym, a kobiety są częściej dotknięte. Około 10% przypadków zaczyna się w dzieciństwie. Stan ten po raz pierwszy opisał Eli Moschcowitz w 1924 roku. Mechanizm leżący u jego podstaw został określony w latach 80. i 90. XX wieku.
Symptomy i objawy
Oznaki i objawy TTP mogą początkowo być subtelne i niespecyficzne. Wielu ludzi doświadczenie grypopodobne lub biegunki choroby Przed opracowaniem TTP. Objawy neurologiczne są bardzo częste i mają bardzo zróżnicowane nasilenie. Często zgłaszane objawy to uczucie dużego zmęczenia , dezorientacja i bóle głowy . Widoczne są również napady i objawy podobne do udaru . Inne objawy obejmują między innymi żółtaczkę lub bladość skóry, przyspieszone tętno lub duszność lub bardzo małe fioletowe lub czerwonawe kropki na skórze znane jako wybroczyny.
W miarę postępu TTP w małych naczyniach krwionośnych (mikronaczynie) tworzą się skrzepy krwi, a płytki krwi (komórki krzepnące) są zużywane. W rezultacie mogą wystąpić siniaki, a rzadko krwawienie. Siniaki często przybierają postać plamicy , podczas gdy najczęstszym miejscem krwawienia, jeśli występuje, jest nos lub dziąsła. Mogą również pojawić się większe siniaki ( wybroczyny ). Klasyczna prezentacja TTP, która występuje u mniej niż 10% osób, obejmuje pięć objawów medycznych. To są:
- Gorączka
- Zmiany w stanie psychicznym
- Małopłytkowość
- Zmniejszona czynność nerek
- Niedokrwistość hemolityczna ( mikroangiopatyczna niedokrwistość hemolityczna ).
Podczas badania można stwierdzić wysokie ciśnienie krwi ( nadciśnienie ).
Powoduje
TTP, podobnie jak w przypadku innych mikroangiopatycznych niedokrwistości hemolitycznych (MAHA), jest spowodowane samoistną agregacją płytek krwi i aktywacją krzepnięcia w małych naczyniach krwionośnych. Płytki krwi są zużywane w procesie agregacji i wiążą vWF. Te kompleksy płytkowe-vWF tworzą małe skrzepy krwi, które krążą w naczyniach krwionośnych i powodują ścinanie czerwonych krwinek, co prowadzi do ich pęknięcia i powstania schistocytów . Dwie najlepiej poznane przyczyny TTP to autoimmunizacja i dziedziczny niedobór ADAMTS13 (znany jako zespół Upshawa-Schülmana). Większość pozostałych przypadków jest drugorzędna w stosunku do innego czynnika.
Autoimmunologiczny
TTP o nieznanej przyczynie było od dawna znane jako idiopatyczne TTP, ale w 1998 roku wykazano, że większość przypadków była spowodowana hamowaniem enzymu ADAMTS13 przez przeciwciała . Związek zredukowanego ADAMTS13 z patogenezą TTP jest znany jako hipoteza Furlana-Tsai, po dwóch niezależnych grupach badaczy, którzy opublikowali swoje badania w tym samym wydaniu New England Journal of Medicine . Przypadki te są obecnie klasyfikowane jako choroba autoimmunologiczna i są znane jako autoimmunologiczna TTP (nie mylić z immunologiczną/idiopatyczną plamicą małopłytkową ).
ADAMTS13 to metaloproteinaza odpowiedzialna za rozkład czynnika von Willebranda (vWF), białka łączącego płytki krwi, skrzepy krwi i ściany naczyń krwionośnych w procesie krzepnięcia krwi. Bardzo duże multimery vWF są bardziej podatne na koagulację. W związku z tym, bez odpowiedniego rozszczepienia vWF przez ADAMTS13, koagulacja zachodzi z większą szybkością, zwłaszcza w mikronaczyniach, części układu naczyń krwionośnych, gdzie vWF jest najbardziej aktywny z powodu wysokiego naprężenia ścinającego . W idiopatycznym TTP silnie obniżoną (<5% normy) aktywność ADAMTS13 można wykryć u większości (80%) osób, a inhibitory często występują w tej podgrupie (44–56%).
Genetyczny
Ten stan może być również wrodzony. Takie przypadki mogą być spowodowane mutacjami w genie ADAMTS13. Ta dziedziczna forma TTP nazywana jest zespołem Upshawa-Schulmana . Osoby z tym dziedzicznym niedoborem ADAMTS13 mają zaskakująco łagodny fenotyp, ale rozwijają TTP w sytuacjach klinicznych ze zwiększonym poziomem czynnika von Willebranda, np. w przypadku infekcji. Podobno mniej niż 1% wszystkich przypadków TTP jest spowodowanych zespołem Upshawa-Schulmana. Osoby z tym zespołem na ogół mają 5-10% normalnej aktywności ADAMTS-13.
Wtórny
Wtórne TTP diagnozuje się, gdy historia osoby wspomina o jednej ze znanych cech związanych z TTP. Stanowi około 40% wszystkich przypadków TTP. Czynnikami predysponującymi są:
- Nowotwór
- Przeszczep szpiku kostnego
- Ciąża
-
Stosowanie leków :
- Leki przeciwwirusowe ( acyklowir )
- Niektóre leki stosowane w chemioterapii, takie jak gemcytabina i mitomycyna C
- Chinina
- Oksymorfon
- Kwetiapina
- Bewacyzumab
- Sunitynib
- Inhibitory agregacji płytek krwi ( tyklopidyna , klopidogrel i prasugrel )
- Leki immunosupresyjne ( cyklosporyna , mitomycyna , takrolimus / FK506 , interferon- α )
- Leki zmieniające hormony (estrogeny, środki antykoncepcyjne, hormonalna terapia zastępcza)
- HIV-1 infekcja
Mechanizm wtórnego TTP jest słabo poznany, ponieważ aktywność ADAMTS13 na ogół nie jest tak obniżona jak w idiopatycznym TTP, a inhibitorów nie można wykryć. Prawdopodobna etiologia może obejmować, przynajmniej w niektórych przypadkach, uszkodzenie śródbłonka, chociaż tworzenie skrzeplin skutkujące niedrożnością naczyń może nie mieć zasadniczego znaczenia w patogenezie wtórnej TTP. Czynniki te można również uznać za formę wtórnego aHUS; osoby z tymi cechami są zatem potencjalnymi kandydatami do terapii antydopełniającej.
Patofizjologia
Podstawowy mechanizm zazwyczaj obejmuje hamowanie za pośrednictwem autoprzeciwciał enzymu ADAMTS13 , metaloproteazy odpowiedzialnej za rozszczepianie dużych multimerów czynnika von Willebranda (vWF) na mniejsze jednostki. Wzrost krążących multimerów vWF zwiększa adhezję płytek krwi do obszarów uszkodzenia śródbłonka , szczególnie w miejscach , w których spotykają się tętniczki i naczynia włosowate , co z kolei powoduje powstawanie małych skrzepów płytek zwanych skrzepliną. Ponieważ płytki krwi są zużywane do tworzenia skrzepów, prowadzi to do zmniejszenia ogólnej liczby krążących płytek krwi, co z kolei może powodować zagrażające życiu krwawienia. Czerwone krwinki przechodzące przez mikroskopijne skrzepy poddawane są naprężeniom ścinającym , które uszkadzają ich błony, prowadząc do pęknięcia czerwonych krwinek w obrębie naczyń krwionośnych, co z kolei prowadzi do anemii i powstawania schistocytów . Obecność tych skrzepów krwi w małych naczyniach krwionośnych zmniejsza przepływ krwi do narządów, powodując uszkodzenie komórek i końcowe uszkodzenie narządu .
Diagnoza
Diagnostyka różnicowa
TTP charakteryzuje się mikroangiopatią zakrzepową (TMA), tworzeniem skrzepów krwi w małych naczyniach krwionośnych w całym ciele, co może prowadzić do mikroangiopatycznej niedokrwistości hemolitycznej i małopłytkowości. Ta cecha jest wspólna dla dwóch powiązanych zespołów, zespołu hemolityczno-mocznicowego (HUS) i atypowego zespołu hemolityczno-mocznicowego (aHUS). W związku z tym niezbędna jest diagnostyka różnicowa tych chorób wywołujących TMA. Oprócz TMA w każdej z tych chorób może występować jeden lub więcej z następujących objawów: objawy neurologiczne (np. splątanie, drgawki mózgowe, napady); zaburzenia czynności nerek (np. podwyższony poziom kreatyniny , obniżony szacowany współczynnik filtracji kłębuszkowej [eGFR], nieprawidłowe badanie moczu); oraz objawy żołądkowo-jelitowe (np. biegunka nudności/wymioty, ból brzucha, zapalenie żołądka i jelit. Wiadomo, że w przeciwieństwie do HUS i aHUS, TTP jest spowodowane nabytym defektem białka ADAMTS13, więc badanie laboratoryjne wykazało ≤5% normalnego poziomu ADAMTS13 poziom ADAMTS13 powyżej 5% w połączeniu z dodatnim wynikiem testu na obecność toksyny shiga/ E. coli jelitowo- krwotocznej (EHEC) jest bardziej prawdopodobnym wskaźnikiem HUS, natomiast brak toksyny shiga/EHEC może potwierdzić diagnozę aHUS .
Leczenie
Ze względu na wysoką śmiertelność nieleczonego TTP, wstępne rozpoznanie TTP jest stawiane nawet wtedy, gdy obserwowana jest tylko mikroangiopatyczna niedokrwistość hemolityczna i małopłytkowość i rozpoczyna się leczenie. Transfuzja jest przeciwwskazana w zakrzepowej TTP, ponieważ napędza koagulopatię. Od wczesnych lat 90. plazmafereza stała się leczeniem z wyboru w przypadku TTP. Jest to transfuzja wymienna polegająca na usunięciu osocza krwi przez aferezę i zastąpieniu osoczem dawcy ( świeżo mrożone osocze lub kriosupernatant ); procedurę należy powtarzać codziennie, aby wyeliminować inhibitor i złagodzić objawy. Jeśli afereza nie jest dostępna, można podać świeżo mrożone osocze, ale objętość, którą można bezpiecznie podać, jest ograniczona ze względu na niebezpieczeństwo przeciążenia płynami. Sama infuzja osocza nie jest tak korzystna jak wymiana osocza. Zazwyczaj podaje się kortykosteroidy ( prednizon lub prednizolon ). Rytuksymab , przeciwciało monoklonalne skierowane przeciwko cząsteczce CD20 na limfocytach B , może być użyte w diagnostyce; uważa się, że zabija to komórki B, a tym samym zmniejsza wytwarzanie inhibitora. Silniejsze zalecenie dla rytuksymabu istnieje, gdy TTP nie reaguje na kortykosteroidy i plazmaferezę.
Kaplacizumab jest alternatywną opcją w leczeniu TTP, ponieważ wykazano, że powoduje szybsze ustępowanie choroby w porównaniu z osobami, które otrzymywały placebo. Jednak stosowanie kaplacyzumabu wiązało się z nasileniem skłonności do krwawień u badanych osób.
Osoby z opornym na leczenie lub nawracającym TTP mogą otrzymać dodatkową terapię immunosupresyjną , np. winkrystynę , cyklofosfamid , cyklosporynę A lub splenektomię .
Dzieci z zespołem Upshawa-Schülmana otrzymują profilaktycznie osocze co dwa do trzech tygodni; utrzymuje to odpowiedni poziom funkcjonowania ADAMTS13. Niektórzy tolerują dłuższe przerwy między infuzjami osocza. Dodatkowe infuzje osocza mogą być konieczne do wyzwalania zdarzeń, takich jak zabieg chirurgiczny; alternatywnie, liczbę płytek krwi można ściśle monitorować wokół tych zdarzeń, podając osocze, jeśli liczba ta spada.
Pomiary poziomu dehydrogenazy mleczanowej we krwi, płytek krwi i schistocytów są wykorzystywane do monitorowania postępu choroby lub remisji. Aktywność ADAMTS13 i poziom inhibitorów można mierzyć podczas obserwacji, ale u osób bez objawów nie zaleca się stosowania rytuksymabu.
Rokowanie
Śmiertelność wynosi około 95% w przypadku nieleczonych przypadków, ale rokowanie jest dość korzystne (80–90% przeżycia) dla osób z idiopatycznym TTP zdiagnozowanym i leczonym wcześnie za pomocą plazmaferezy .
Epidemiologia
Częstość występowania TTP wynosi około 4-5 przypadków na milion osób rocznie. Idiopatyczna TTP występuje częściej u kobiet i osób pochodzenia afrykańskiego, a TTP wtórna do zaburzeń autoimmunologicznych, takich jak toczeń rumieniowaty układowy, występuje częściej u osób pochodzenia afrykańskiego, chociaż inne formy wtórne nie wykazują tego rozkładu. W niektórych badaniach znaczną część (12–31%) przypadków stanowiły kobiety w ciąży i kobiety w okresie poporodowym ; TTP dotyka około jednej na 25 000 ciąż.
Historia
TTP został początkowo opisany przez Eli Moschcowitza w Beth Israel Hospital w Nowym Jorku w 1925 roku. Moschcowitz przypisał chorobę (niepoprawnie, jak obecnie wiadomo) toksycznej przyczynie. Moschcowitz zauważył, że jego pacjentka, 16-letnia dziewczynka, miała anemię, małe i duże siniaki, mikroskopijny krwiomocz , a podczas autopsji rozsiane skrzepliny mikronaczyniowe. W 1966 roku przegląd 16 nowych przypadków i 255 wcześniej zgłoszonych przypadków doprowadził do sformułowania klasycznej pentady objawów i ustaleń (tj. małopłytkowości, mikroangiopatycznej niedokrwistości hemolitycznej, objawów neurologicznych, niewydolności nerek, gorączki); w tej serii śmiertelność okazała się bardzo wysoka (90%).
Chociaż odpowiedź na transfuzję krwi była już wcześniej zauważona, raport z 1978 r. i późniejsze badania wykazały, że osocze krwi było wysoce skuteczne w poprawie procesu chorobowego. W 1991 roku doniesiono, że wymiana osocza zapewnia lepsze wskaźniki odpowiedzi w porównaniu z infuzją osocza. W 1982 roku choroba została powiązana z nienormalnie dużymi multimerami czynnika von Willebranda. Identyfikacji niedoboru proteazy u osób z TTP dokonano w 1998 roku. Lokalizacja ADAMTS13 w ludzkim genomie została zidentyfikowana w 2001 roku.
Bibliografia
Zewnętrzne linki
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |

