Biokompatybilność tytanu - Titanium biocompatibility
Tytan został po raz pierwszy wprowadzony do gabinetów lekarskich w latach pięćdziesiątych XX wieku, po tym, jak był używany w stomatologii przez dziesięć lat wcześniej. Obecnie jest to metal z wyboru do protetyki, wewnętrznego mocowania, wewnętrznych elementów ciała i oprzyrządowania. Tytan jest używany od stóp do głów w implantach biomedycznych. Tytan można znaleźć w neurochirurgii, aparatach słuchowych na przewodnictwo kostne, implantach sztucznych oczu, klatkach zespolonych kręgosłupa , rozrusznikach serca , implantach palców u nóg, protezach barku / łokcia / biodra / kolana oraz wielu innych. Głównym powodem, dla którego tytan jest często stosowany w organizmie, jest biokompatybilność tytanu oraz, po modyfikacjach powierzchni, bioaktywna powierzchnia. Właściwości powierzchni, które wpływają na biokompatybilność to tekstura powierzchni , zawada przestrzenna, miejsca wiązania i hydrofobowość (zwilżanie). Te cechy są zoptymalizowane, aby stworzyć idealną odpowiedź komórkową. Niektóre implanty medyczne, a także części narzędzi chirurgicznych są pokryte azotkiem tytanu (TiN).
Biokompatybilność
Tytan jest uważany za najbardziej biokompatybilny metal ze względu na jego odporność na korozję powodowaną przez płyny ustrojowe, bioobojętność, zdolność do osteointegracji i wysoką granicę zmęczenia. Zdolność tytanu do wytrzymywania surowego środowiska ciała jest wynikiem ochronnej warstwy tlenku, która tworzy się naturalnie w obecności tlenu. Warstwa tlenku jest silnie przylegająca, nierozpuszczalna i nieprzepuszczalna chemicznie, co zapobiega reakcjom między metalem a otaczającym środowiskiem.
Interakcja i proliferacja w wyniku osteointegracji
Powierzchnie o wysokiej energii wywołują angiogenezę podczas osteointegracji
Sugerowano, że zdolność tytanu do osteointegracji wynika z wysokiej stałej dielektrycznej jego powierzchniowego tlenku, który nie powoduje denaturacji białek (jak tantal i stopy kobaltu ). Jego zdolność do fizycznego wiązania się z kością daje tytanowi przewagę nad innymi materiałami, które wymagają użycia kleju, aby pozostać przyczepionym. Implanty tytanowe wytrzymują dłużej, a do zerwania wiązań łączących je z ciałem potrzebne są znacznie większe siły w porównaniu z ich alternatywami.
Właściwości powierzchni determinują osteointegrację
Właściwości powierzchni biomateriału odgrywają ważną rolę w określaniu odpowiedzi komórkowej (adhezji i proliferacji komórek) na materiał. Mikrostruktura tytanu i wysoka energia powierzchniowa sprawiają, że indukuje on angiogenezę, która wspomaga proces osteointegracji.
Energia powierzchniowa
Potencjał redoks
Tytan może mieć wiele różnych potencjałów standardowych elektrod w zależności od stopnia utlenienia. Stały tytan ma standardowy potencjał elektrody -1,63 V. Materiały o większym potencjale elektrody standardowej są łatwiej redukowane, co czyni je lepszymi środkami utleniającymi. Jak widać w poniższej tabeli, tytan w stanie stałym preferuje się utlenianie, co czyni go lepszym środkiem redukującym.
| Połowa reakcji | Potencjał elektrody standardowej (V) |
|---|---|
| Ti 2+ + 2 e - → Ti (s) | -1,63 |
| Ti 3+ + 3 e - → Ti (s) | -1,21 |
| TiO 2 + + 2 H + + 4 e - → Ti (s) + H 2 O | -0,86 |
| 2 TiO 2 (s) + 2 H + + 2 e - → Ti 2 O 3 (s) + H 2 O | -0,56 |
| Ti 2+ (aq) / M 3+ (aq) | -0,36 |
Powłoka pokrywająca powierzchnię
Tytan ulega naturalnej pasywacji, tworząc warstwę tlenku, która staje się niejednorodna i spolaryzowana w funkcji czasu ekspozycji na środowisko ciała. Prowadzi to z czasem do zwiększonej adsorpcji grup hydroksylowych, lipoprotein i glikolipidów. Adsorpcja tych związków zmienia sposób interakcji materiału z organizmem i może poprawić biokompatybilność. W stopach tytanu, takich jak Ti-Zr i Ti-Nb, jony cyrkonu i niobu, które są uwalniane w wyniku korozji, nie są uwalniane do ciała pacjenta, ale raczej dodawane do warstwy pasywacyjnej. Pierwiastki stopowe w warstwie pasywnej zwiększają stopień biokompatybilności i odporności na korozję w zależności od pierwotnego składu stopu metalu luzem przed korozją.
Stężenie powierzchniowe białka ( ) jest określone równaniem
gdzie Q ADS to gęstość ładunku powierzchniowego w C cm- 2 , M to masa molowa białka wg mol- 1 , n to liczba przeniesionych elektronów (w tym przypadku jeden elektron na każdą protonowaną grupę aminową w białku ), a F jest stałą Faradaya w C mol -1 .
Równanie częstotliwości zderzeń jest następujące:
gdzie D = 8,83 × 10 −7 cm 2 s −1 to współczynnik dyfuzji cząsteczki BSA w 310 K, d = 7,2 nm to „średnica” białka, co odpowiada dwukrotności promienia Stokesa, NA = 6,023 × 10 23 mol −1 to liczba Avogadro, a c * = 0,23 g L −1 (3,3 μM) to krytyczne stężenie przesycenia w masie.
Zwilżająca i trwała powierzchnia
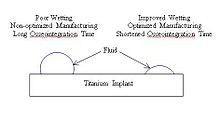
Zwilżanie zachodzi jako funkcja dwóch parametrów: chropowatości powierzchni i frakcji powierzchniowej. Zwiększając zwilżanie, implanty mogą skrócić czas wymagany do osteointegracji, umożliwiając komórkom łatwiejsze wiązanie się z powierzchnią implantu. Zwilżanie tytanu można modyfikować, optymalizując parametry procesu, takie jak temperatura, czas i ciśnienie (przedstawione w tabeli poniżej). Tytan ze stabilnymi warstwami tlenków, składającymi się głównie z TiO2, skutkuje poprawą zwilżania implantu w kontakcie z płynem fizjologicznym.
| Powierzchnia | Kąt zwilżania (stopnie) | Ciśnienie (mbar) podczas przetwarzania | Temperatura (stopnie C) podczas przetwarzania | Inna obróbka powierzchni |
|---|---|---|---|---|
| Bare Ti | ~ 50 | - | - | Żaden |
| TiO 2 TiO Ti 4 O 7 TiO 4 (planarne) | ~ 33 | 2.2 | 700 | Utlenianie |
| TiO 2 TiO Ti 4 O 7 (planarne) | ~ 45 | 4 | 700 | Utlenianie |
| TiO 2 TiO Ti 4 O 7 TiO 4 (pusty) | ~ 32 | 2.2 | 400 | Utlenianie |
| TiO 2 TiO Ti 4 O 7 (pusty) | ~ 25 | 2.6 | 500 | Utlenianie |
| TiO 2 TiO Ti 4 O 7 (pusty) | ~ 8 | 4 | 400 | Utlenianie |
| TiO 2 TiO Ti 4 O 7 (pusty) | ~ 20 | 4 | 500 | Utlenianie |
| Ti o chropowatej powierzchni | 79,5 ± 4,6 | - | - | Obrobiona powierzchnia |
| Ti z powierzchnią poddaną obróbce alkalicznej | 27,2 ± 6,9 | - | - | Biopowierzchnia |
Adsorpcja
Korozja
Mechaniczne ścieranie warstwy tlenku tytanu prowadzi do zwiększonej szybkości korozji .
Tytan i jego stopy nie są odporne na korozję w ludzkim ciele. Stopy tytanu są podatne na absorpcję wodoru, co może powodować wytrącanie się wodorków i kruchość, prowadzącą do uszkodzenia materiału. „Kruchość wodorową obserwowano jako mechanizm degradacji in vivo w warunkach korozji fretting-szczelinowej, prowadzący do tworzenia się TiH, reakcji powierzchniowej i pękania wewnątrz zwężającego się korpusu modułowego Ti / Ti”. Badanie i testowanie zachowania tytanu w organizmie pozwala nam uniknąć błędów w sztuce, które spowodowałyby śmiertelne uszkodzenie implantu, np. Stosowanie produktów dentystycznych o wysokim stężeniu fluoru lub substancji mogących obniżyć pH środowiska wokół implantu.
Przyczepność
Komórki na styku implantu są bardzo wrażliwe na ciała obce. Po wszczepieniu implantów do organizmu komórki inicjują reakcję zapalną, która może prowadzić do otorbienia, upośledzając działanie wszczepionego urządzenia.
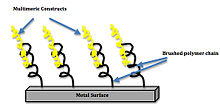
Idealną odpowiedź komórkową na bioaktywną powierzchnię charakteryzuje stabilizacja i integracja biomateriału, a także redukcja potencjalnych miejsc infekcji bakteryjnych na powierzchni. Jednym z przykładów integracji biomateriałów jest implant tytanowy z inżynieryjnym biointerfejsem pokrytym motywami biomimetycznymi . Okazało się, że powierzchnie z tymi motywami biomimetycznymi wzmacniają wiązanie integryny i sygnalizację oraz różnicowanie komórek macierzystych. Zwiększenie gęstości grupowania ligandów również zwiększyło wiązanie integryny. Powłoka składająca się z trymerów i pentamerów zwiększyła powierzchnię styku kości z implantem o 75% w porównaniu z obecnym standardem klinicznym niepowlekanego tytanu. Ten wzrost powierzchni umożliwia zwiększoną integrację komórkową i zmniejsza odrzucenie wszczepionego urządzenia. Langmuira izoterma :
,
gdzie c to stężenie adsorbatu to maksymalna ilość zaadsorbowanego białka, B ADS to powinowactwo cząsteczek adsorbatu do miejsc adsorpcji. Izotermę Langmuira można zlinearyzować, zmieniając równanie na,
Ta symulacja jest dobrym przybliżeniem adsorpcji na powierzchni w porównaniu z wartościami eksperymentalnymi. Izotermę Langmuira adsorpcji pierwiastków na powierzchni tytanu można wyznaczyć, wykreślając znane parametry. Doświadczenie adsorpcji fibrynogenu na powierzchni tytanu „potwierdziło przydatność izotermy Langmuira w opisie adsorpcji fibrynogenu na powierzchni Ti”.