Przejściowy potencjalny kanał receptora - Transient receptor potential channel
| Kanał jonowy przejściowego potencjału receptora (TRP) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||||
| Symbol | TRP | ||||||||
| Pfam | PF06011 | ||||||||
| InterPro | IPR013555 | ||||||||
| Nadrodzina OPM | 8 | ||||||||
| Białko OPM | 3j5p | ||||||||
| Membrana | 605 | ||||||||
| |||||||||
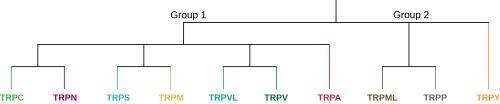
Kanały potencjału receptora przejściowego ( kanały TRP ) to grupa kanałów jonowych zlokalizowanych głównie na błonie komórkowej wielu typów komórek zwierzęcych. Większość z nich jest podzielona na dwie szerokie grupy: Grupa 1 obejmuje TRPC ("C" dla kanonicznego), TRPV ("V" dla waniloidu), TRPVL ("VL" dla waniloidowego), TRPM ("M" dla melostatyny) , TRPS („S” dla soromelastatyny), TRPN („N” dla braku potencjału mechanoreceptorowego C) i TRPA („A” dla ankyryny). Grupa 2 składa się z TRPP („P” dla policystycznych) i TRPML („ML” dla mukolipiny). Istnieją inne, gorzej sklasyfikowane kanały TRP, w tym kanały drożdżowe i szereg kanałów Grupy 1 i Grupy 2 obecnych u zwierząt. Wiele z tych kanałów pośredniczy w różnych doznaniach, takich jak ból, temperatura, różne rodzaje smaków, ucisk i wzrok. Uważa się, że w ciele niektóre kanały TRP zachowują się jak mikroskopijne termometry i są wykorzystywane u zwierząt do wykrywania ciepła lub zimna. Niektóre kanały TRP są aktywowane przez cząsteczki znajdujące się w przyprawach, takich jak czosnek ( allicyna ), papryczka chili ( kapsaicyna ), wasabi ( izotiocyjanian allilu ); inne są aktywowane przez mentol , kamforę , miętę pieprzową i środki chłodzące; jeszcze inne są aktywowane przez cząsteczki znajdujące się w konopiach (np. THC , CBD i CBN ) lub stewii . Niektóre działają jako czujniki ciśnienia osmotycznego, objętości, rozciągnięcia i wibracji. Większość kanałów jest aktywowana lub hamowana przez lipidy sygnałowe i przyczynia się do powstania rodziny kanałów jonowych bramkowanych lipidami .
Te kanały jonowe mają stosunkowo nieselektywną przepuszczalność kationów , w tym sodu , wapnia i magnezu .
Kanały TRP zostały początkowo odkryte w tak zwanym „potencjale receptora przejściowego” ( trp -mutant) szczepie muszki owocowej Drosophila , stąd ich nazwa (patrz Historia kanałów TRP Drosophila poniżej). Później kanały TRP odkryto u kręgowców, gdzie są wszechobecnie eksprymowane w wielu typach komórek i tkankach. Większość kanałów TRP składają się z 6 błoną helis wewnątrzkomórkowym N- i C-końcu . Kanały TRP ssaków są aktywowane i regulowane przez wiele różnych bodźców i ulegają ekspresji w całym ciele.
Rodziny
W nadrodzinie zwierzęcej TRP istnieje obecnie 9 proponowanych rodzin podzielonych na dwie grupy, z których każda zawiera kilka podrodzin. Grupa pierwsza składa się z TRPC, TRPV, TRPVL, TRPA, TRPM, TRPS i TRPN, natomiast grupa druga zawiera TRPP i TRPML. Istnieje dodatkowa rodzina oznaczona TRPY, która nie zawsze należy do żadnej z tych grup. Wszystkie te podrodziny są podobne pod tym względem, że są nieselektywnymi kanałami kationowymi wykrywającymi molekularnie, które mają sześć segmentów transbłonowych, jednak każda podrodzina jest bardzo wyjątkowa i wykazuje niewielką homologię strukturalną ze sobą. Ta wyjątkowość powoduje powstawanie różnych funkcji percepcji sensorycznej i regulacji, które kanały TRP pełnią w całym ciele. Grupa pierwsza i grupa druga różnią się tym, że zarówno TRPP, jak i TRPML z grupy drugiej mają znacznie dłuższą pętlę zewnątrzkomórkową między segmentami transbłonowymi S1 i S2. Inną cechą wyróżniającą jest to, że wszystkie podrodziny grupy pierwszej zawierają albo C-końcową, wewnątrzkomórkową sekwencję powtórzenia ankyrynowego, N-końcową sekwencję domeny TRP, albo obie, podczas gdy obie podrodziny grupy drugiej nie mają żadnej z nich. Poniżej znajdują się członkowie podrodzin i krótki opis każdej z nich:
TRPA
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPA | TRPA1 | Kręgowce , stawonogi i mięczaki |
| podobny do TRPA | Choanoflagellates , parzydełka , nicienie , stawonogi (tylko skorupiaki i myriapody), mięczaki i szkarłupnie | |
| TRPA5 | Stawonogi (tylko skorupiaki i owady) | |
| bezbolesny | ||
| gorączka | ||
| wodna wiedźma | ||
| HsTRPA | Specyficzne dla owadów błonkoskrzydłych |
TRPA, A od „ankyrinu”, pochodzi od dużej ilości powtórzeń ankyrynowych znalezionych w pobliżu N-końca. TRPA znajduje się przede wszystkim w doprowadzających włóknach nerwowych nocyceptywnych i jest związany ze wzmocnieniem sygnalizacji bólu oraz nadwrażliwością na ból zimny. Wykazano, że kanały te są zarówno mechanicznymi receptorami bólu, jak i chemosensorami aktywowanymi przez różne rodzaje substancji chemicznych, w tym izotiocyjaniany (ostre substancje chemiczne w substancjach takich jak olejek gorczycy i wasabi), kannabinoidy, ogólne i miejscowe środki przeciwbólowe oraz aldehyd cynamonowy.
Chociaż TRPA1 ulega ekspresji u wielu różnych zwierząt, wiele innych kanałów TRPA istnieje poza kręgowcami. TRPA5, bezbolesny, gorączka i wiedźma są odrębnymi gałęziami filogenetycznymi w obrębie kladu TRPA i wykazano, że ulegają ekspresji tylko u skorupiaków i owadów, podczas gdy HsTRPA powstało jako swoista duplikacja wiedźmy błonkoskrzydłej. Podobnie jak TRPA1 i inne kanały TRP, działają one jako kanały jonowe w wielu systemach sensorycznych. Kanały podobne do TRPA lub TRPA1 występują również w różnych gatunkach jako odrębny filogenetycznie klad, ale są one mniej dobrze poznane.
TRPC
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPC | TRPC1 | Kręgowce |
| TRPC2 | ||
| TRPC3 | ||
| TRPC4 | ||
| TRPC5 | ||
| TRPC6 | ||
| TRPC7 | ||
| TRP | Stawonogi | |
| TRPgamma | ||
| TRPL | ||
| Nieznany | Choanoflagellates, parzydełka , ksenakoelomorfy , lofotrochozoany i nicienie |
TRPC, C od „kanoniczny”, jest nazwany jako najbardziej spokrewniony z drozofilią TRP, imiennikiem kanałów TRP. Filogeneza kanałów TRPC nie została szczegółowo wyjaśniona, ale są one obecne w taksonach zwierząt. W rzeczywistości istnieje tylko sześć kanałów trpC ekspresji u ludzi, ponieważ TRPC2 okazuje się być wyrażane jedynie u myszy i jest uważana za pseudo genu u ludzi; częściowo wynika to z roli TRPC2 w wykrywaniu feromonów, które myszy mają zwiększoną zdolność w porównaniu z ludźmi. Mutacje w kanałach TRPC powiązano z chorobami układu oddechowego wraz z ogniskowym segmentowym stwardnieniem kłębuszków nerkowych . Wszystkie kanały TRPC są aktywowane przez fosfolipazę C (PLC) lub diacyglicerol (DAG).
TRPM
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPM | Alfa/α (w tym TRPM1, 3, 6 i 7) | Choanoflagellates i zwierzęta (z wyjątkiem niesporczaków ) |
| Beta/β (w tym TRPM2, 4, 5 i 8) |
TRPM, M jak „melastatynę”, stwierdzono podczas porównawczej analizy genetycznej między łagodnymi znamionami a złośliwymi znamionami (czerniak). Mutacje w obrębie kanałów TRPM powiązano z hipomagnezemią z wtórną hipokalcemią. Kanały TRPM stały się również znane ze swoich mechanizmów wykrywania zimna, tak jak w przypadku TRPM8. Badania porównawcze wykazały, że domeny funkcjonalne i kluczowe aminokwasy kanałów TRPM są wysoce konserwatywne u różnych gatunków.
Filogenetyka wykazała, że kanały TRPM są podzielone na dwa główne klady, αTRPM i βTRPM. αTRPM obejmują między innymi TRPM1, TRPM3 kręgowców oraz „chanzymy” TRPM6 i TRPM7, a także jedyny owadzi kanał TRPM. βTRPM obejmują między innymi TRPM2, TRPM4, TRPM5 i TRPM8 kręgowców (czujnik zimna i mentolu). Opisano dwa dodatkowe główne klady: TRPMc, który występuje tylko u różnych stawonogów, oraz klad podstawowy, który od tego czasu zaproponowano jako odrębną i odrębną rodzinę kanałów TRP (TRPS).
TRPML
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPML | Nieznany | parzydełka , podstawne kręgowce , osłonice , głowonogłowe , półstruny , szkarłupnie , stawonogi i nicienie |
| TRPML1 | Specyficzne dla kręgowców szczękowych | |
| TRPML2 | ||
| TRPML3 |
TRPML, ML dla "mukolipiny", bierze swoją nazwę od zaburzenia neurorozwojowego mukolipidozy IV . Mukolipidoza IV została po raz pierwszy odkryta w 1974 roku przez ER Bermana, który zauważył nieprawidłowości w oczach niemowlęcia. Nieprawidłowości te wkrótce powiązano z mutacjami genu MCOLN1, który koduje kanał jonowy TRPML1. TRPML wciąż nie jest dobrze scharakteryzowany. Trzy znane kopie kręgowców są ograniczone do kręgowców szczękowych, z pewnymi wyjątkami (np. Xenopus tropicalis ).
TRPN
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPN | TRPN/nompC | Placozoas, parzystokopytne, nicienie, stawonogi, mięczaki, pierścieniowate i kręgowce (z wyłączeniem owodniowców) |
TRPN został pierwotnie opisany u Drosophila melanogaster i Caenorhabditis elegans jako nompC, mechanicznie bramkowany kanał jonowy. Wiadomo, że tylko pojedynczy TRPN, N oznaczający „brak potencjału mechanoreceptorowego C” lub „nompC”, jest szeroko wyrażany u zwierząt (chociaż niektórzy parzydełko mają więcej), i jest to w szczególności tylko pseudogen u kręgowców owodniowych . Pomimo TRPA został nazwany dla powtórzeń ankyryny kanały TRPN Uważa się, że mają najbardziej jakiegokolwiek kanału TRP, zwykle około 28, które są wysoce konserwatywne całej taksonów Od jego odkrycia, Drosophila nompC został zamieszany w mechanosensation (w tym mechaniczną stymulację naskórka i wykrywanie dźwięku) i zimna nocycepcja .
TRPP
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPP | PKD1-podobny | Zwierzęta (z wyłączeniem stawonogów) |
| PKD2-podobny | Zwierząt | |
| Brividos | Owady |
TRPP , P od „ policystyny ”, jest nazwany od policystycznej choroby nerek , która jest związana z tymi kanałami. Kanały te są również określane jako kanały jonowe PKD (policystyczna choroba Kindey'a).
Geny podobne do PKD2 (przykłady obejmują TRPP2 , TRPP3 i TRPP5 ) kodują kanoniczne kanały TRP. Geny podobne do PKD1 kodują znacznie większe białka z 11 segmentami transbłonowymi, które nie posiadają wszystkich cech innych kanałów TRP. Jednak 6 z segmentów transbłonowych białek podobnych do PKD1 ma znaczną homologię sekwencji z kanałami TRP, co wskazuje, że mogą po prostu znacznie różnić się od innych blisko spokrewnionych białek.
Owady mają trzecią podrodzinę TRPP, zwaną brividos, która uczestniczy w wykrywaniu zimna.
TRPS
TRPS, S od Soromelastatyny, został nazwany, ponieważ tworzy grupę siostrzaną dla TRPM. TRPS jest szeroko obecny u zwierząt, ale w szczególności nieobecny u kręgowców i owadów (między innymi). TRPS nie został jeszcze dobrze opisany funkcjonalnie, chociaż wiadomo, że TRPS C. elegans , znany jako CED-11, jest kanałem wapniowym, który uczestniczy w apoptozie .
TRPV
| Rodzina | Podrodzina | Znane taksony |
|---|---|---|
| TRPV | Nanczung | Placozoans , parzystokopytne, nicienie, pierścienice, mięczaki i stawonogi (prawdopodobnie z wyłączeniem pajęczaków ) |
| Nieaktywny | ||
| TRPV1 | Specyficzne dla kręgowców | |
| TRPV2 | ||
| TRPV3 | ||
| TRPV4 | ||
| TRPV5 | ||
| TRPV6 |
TRPV, V od „vanilloid”, zostało pierwotnie odkryte w Caenorhabditis elegans , a nazwa pochodzi od waniloidowych substancji chemicznych, które aktywują niektóre z tych kanałów. Kanały te zasłynęły z ich powiązania z cząsteczkami, takimi jak kapsaicyna (agonista TRPV1). Oprócz 6 znanych paralogów kręgowców, poza deterostomami znane są 2 główne klady: nanchung i Iav. Badania mechanistyczne tych ostatnich kladów były w dużej mierze ograniczone do Drosophila , ale analizy filogenetyczne umieściły w nich szereg innych genów z Placozoa, Annelida, Cnidaria, Mollusca i innych stawonogów. Kanały TRPV zostały również opisane u protistów.
TRPVL
Zaproponowano, że TRPVL jest kladem siostrzanym TRPV i jest ograniczony do parzydełek Nematostella vectensis i Hydra magnipapillata oraz pierścienic Capitella teleta . Niewiele wiadomo na temat tych kanałów.
TRPY
TRPY, Y dla "drożdże", jest wysoce zlokalizowane w wakuoli drożdży, która jest funkcjonalnym odpowiednikiem lizosomu w komórce ssaka i działa jako mechanosensor ciśnienia osmotycznego w wakuoli. Techniki patch clamp i stymulacja hiperosmotyczna pokazały, że TRPY odgrywa rolę w wewnątrzkomórkowym uwalnianiu wapnia. Analiza filogenetyczna wykazała, że TRPY1 nie stanowi części z innymi grupami TRP śródstopia 1 i 2, i sugeruje się, że ewoluował po dywergencji śródstopia i grzybów. Inni wskazali, że TRPY są bliżej spokrewnione z TRPP.
Struktura
Kanały TRP składają się z 6 błony -spanning helis (S1-S6) z wewnątrzkomórkowego N- i C-końcu . Kanały TRP ssaków są aktywowane i regulowane przez wiele różnych bodźców, w tym wiele mechanizmów posttranskrypcyjnych, takich jak fosforylacja , sprzęganie receptora białka G , bramkowanie ligandów i ubikwitynacja . Receptory znajdują się w prawie wszystkich typach komórek i są w dużej mierze zlokalizowane w błonach komórkowych i organelli, modulując wnikanie jonów.
Większość kanałów TRP tworzy homo- lub heterotetramery, gdy są całkowicie funkcjonalne. Filtr jonoselektywny, por, jest utworzony przez złożoną kombinację pętli p w białku tetramerycznym, które znajdują się w domenie zewnątrzkomórkowej pomiędzy segmentami transbłonowymi S5 i S6. Podobnie jak w przypadku większości kanałów kationowych, kanały TRP mają ujemnie naładowane reszty w porach, które przyciągają dodatnio naładowane jony.
Charakterystyka grupy 1
Każdy kanał w tej grupie jest strukturalnie unikalny, co zwiększa różnorodność funkcji, jakie posiadają kanały TRP, jednak istnieją pewne cechy wspólne, które odróżniają tę grupę od innych. Począwszy od wewnątrzkomórkowego N-końca, występują różne długości powtórzeń ankryin (z wyjątkiem TRPM), które pomagają w kotwiczeniu w błonie i innych interakcjach białkowych. Krótko po S6 na końcu C znajduje się wysoce konserwatywna domena TRP (z wyjątkiem TRPA), która jest zaangażowana w modulację bramkowania i multimeryzację kanałów. W tej grupie zaobserwowano również inne modyfikacje C-końcowe, takie jak domeny alfa-kinazy w TRPM7 i M8.
Charakterystyka grupy 2
Najbardziej wyróżniającą się cechą grupy drugiej jest długa pozakomórkowa rozpiętość między segmentami transbłonowymi S1 i S2. Członkom grupy drugiej brakuje również powtórzeń ankryinowych i domeny TRP. Wykazano jednak, że posiadają sekwencje retikulum endoplazmatycznego (ER) w kierunku końca C, co ilustruje możliwe interakcje z ER.
Funkcjonować
Kanały TRP modulują siły napędowe wejścia jonów i maszynerii transportu Ca 2+ i Mg 2+ w błonie komórkowej, gdzie znajduje się większość z nich. TRP mają ważne interakcje z innymi białkami i często tworzą kompleksy sygnałowe, których dokładne szlaki są nieznane. Kanały TRP zostały początkowo odkryte w szczepie mutanta trp muszki owocowej Drosophila, który wykazywał przejściowy wzrost potencjału w odpowiedzi na bodźce świetlne i był tak zwanymi kanałami potencjału receptora przejściowego . Kanały TRPML działają jako wewnątrzkomórkowe kanały uwalniania wapnia i tym samym odgrywają ważną rolę w regulacji organelli. Co ważne, wiele z tych kanałów pośredniczy w różnych doznaniach, takich jak odczucia bólu, temperatury, różnego rodzaju smaki, nacisk i wzrok. Uważa się, że w ciele niektóre kanały TRP zachowują się jak mikroskopijne termometry i są wykorzystywane u zwierząt do wykrywania ciepła lub zimna. TRP działają jako czujniki ciśnienia osmotycznego , objętości , rozciągnięcia i wibracji . Zaobserwowano, że TRP odgrywają złożone, wielowymiarowe role w sygnalizacji sensorycznej. Wiele TRP działa jako wewnątrzkomórkowe kanały uwalniania wapnia.
Ból i uczucie temperatury
Kanały jonowe TRP przekształcają energię w potencjały czynnościowe w nocyceptorach somatosensorycznych. Kanały Thermo-TRP mają domenę C-końcową odpowiedzialną za termosensację i mają specyficzny wymienny region, który umożliwia im wyczuwanie bodźców temperaturowych związanych z procesami regulacji ligandów. Chociaż większość kanałów TRP jest modulowanych przez zmiany temperatury, niektóre odgrywają kluczową rolę w odczuwaniu temperatury. Istnieje co najmniej 6 różnych kanałów Thermo-TRP, a każdy z nich odgrywa inną rolę. Na przykład TRPM8 odnosi się do mechanizmów odczuwania zimna, TRPV1 i TRPM3 przyczyniają się do odczuwania ciepła i stanu zapalnego, a TRPA1 ułatwia wiele ścieżek sygnalizacyjnych, takich jak transdukcja czuciowa, nocycepcja , stan zapalny i stres oksydacyjny .
Smak
TRPM5 bierze udział w sygnalizacji smaków słodkich , gorzkich i umami poprzez modulowanie ścieżki sygnałowej w komórkach receptorów smakowych typu II . TRPM5 jest aktywowany przez słodkie glikozydy znajdujące się w roślinie stewii .
Kilka innych kanałów TRP odgrywa znaczącą rolę w chemosensacji poprzez zakończenia nerwów czuciowych w jamie ustnej, które są niezależne od kubków smakowych. TRPA1 reaguje na olej gorczyczny ( izotiocyjanian allilu ), wasabi i cynamon, TRPA1 i TRPV1 reaguje na czosnek ( allicyna ), TRPV1 reaguje na papryczkę chili ( kapsaicyna ), TRPM8 jest aktywowany przez mentol , kamforę , miętę pieprzową i środki chłodzące; TRPV2 jest aktywowany przez cząsteczki ( THC , CBD i CBN ) znajdujące się w marihuanie.
Kanały podobne do TRP w widzeniu owadów

W trp -mutant muszki owocowe, w których brakuje funkcjonalnej kopii genu trp, charakteryzują się przejściową odpowiedź na działanie światła, w przeciwieństwie do typu dzikiego much, które wykazują przedłużone fotoreceptory aktywność w odpowiedzi na światło. Odlegle spokrewnioną izoformę kanału TRP, kanał podobny do TRP (TRPL), zidentyfikowano później w fotoreceptorach Drosophila , gdzie ulega ekspresji na około 10- do 20-krotnie niższym poziomie niż białko TRP. Następnie wyizolowano zmutowaną muchę trpl . Poza różnicami strukturalnymi, kanały TRP i TRPL różnią się przepuszczalnością kationów i właściwościami farmakologicznymi.
Kanały TRP/TRPL są wyłącznie odpowiedzialne za depolaryzację błony plazmatycznej fotoreceptorów owadów w odpowiedzi na światło. Kiedy te kanały się otworzą, pozwalają sodowi i wapniu dostać się do komórki w dół gradientu stężenia, co depolaryzuje błonę. Zmiany natężenia światła wpływają na całkowitą liczbę otwartych kanałów TRP/TRPL, a tym samym na stopień depolaryzacji błony. Te stopniowane odpowiedzi napięciowe propagują się do synaps fotoreceptorów z neuronami drugiego rzędu siatkówki i dalej do mózgu.
Należy zauważyć, że mechanizm fotorecepcji owadów jest radykalnie inny niż u ssaków. Pobudzenie rodopsyny w fotoreceptorach ssaków prowadzi do hiperpolaryzacji błony receptora, ale nie do depolaryzacji, jak w oku owada. U Drosophila i przypuszczalnie innych owadów kaskada sygnalizacyjna, w której pośredniczy fosfolipaza C (PLC), łączy fotoekscytację rodopsyny z otwarciem kanałów TRP/TRPL. Mimo, że wiele z tych aktywatorów kanałów, takich jak fosfatydylo-4,5-bifosforanu PIP ( 2 ) i wielonienasyconych kwasów tłuszczowych (PUFA), były znane od lat kluczowym czynnikiem pośredniczenia sprzęgania chemicznego pomiędzy kanałami PLC TRP / trpl pozostała tajemnicy do niedawna. Stwierdzono, że rozkład lipidowego produktu kaskady PLC, diacyloglicerolu (DAG), przez enzym lipazę diacyloglicerolową , generuje PUFA, które mogą aktywować kanały TRP, inicjując w ten sposób depolaryzację błony w odpowiedzi na światło. Ten mechanizm aktywacji kanału TRP może być dobrze zachowany wśród innych typów komórek, w których kanały te pełnią różne funkcje.
Znaczenie kliniczne
Mutacje w TRP są powiązane z zaburzeniami neurodegeneracyjnymi , dysplazją szkieletową , zaburzeniami nerek i mogą odgrywać ważną rolę w raku. TRP mogą stanowić ważne cele terapeutyczne. Istotne znaczenie kliniczne ma rola TRPV1, TRPV2, TRPV3 i TRPM8 jako termoreceptorów oraz rola TRPV4 i TRPA1 jako mechanoreceptorów; zmniejszenie przewlekłego bólu może być możliwe poprzez celowanie w kanały jonowe zaangażowane w odczuwanie termiczne, chemiczne i mechaniczne w celu zmniejszenia ich wrażliwości na bodźce. Na przykład zastosowanie agonistów TRPV1 mogłoby potencjalnie hamować nocycepcję w TRPV1, szczególnie w tkance trzustki, gdzie TRPV1 jest silnie eksprymowany. Wykazano, że agonista TRPV1, kapsaicyna, występujący w papryczkach chili, łagodzi ból neuropatyczny. Agoniści TRPV1 hamują nocycepcję w TRPV1
Rola w raku
Zmieniona ekspresja białek TRP często prowadzi do nowotworzenia , jak opisano dla TRPV1, TRPV6, TRPC1, TRPC6, TRPM4, TRPM5 i TRPM8. TRPV1 i TRPV2 są związane z rakiem piersi. Ekspresja TRPV1 w agregatach znajdujących się w retikulum endoplazmatycznym lub aparacie Golgiego i/lub otaczających te struktury u chorych na raka piersi pogarsza przeżywalność. TRPV2 jest potencjalnym biomarkerem i celem terapeutycznym w potrójnie ujemnym raku piersi. Rodzina kanałów jonowych TRPM jest szczególnie związana z rakiem prostaty, gdzie TRPM2 (i jego długi niekodujący RNA TRPM2-AS ), TRPM4 i TRPM8 ulegają nadekspresji w raku prostaty, co wiąże się z bardziej agresywnymi wynikami. Wykazano, że TRPM3 promuje wzrost i autofagię w jasnokomórkowym raku nerkowokomórkowym, TRPM4 ulega nadekspresji w chłoniaku rozlanym z dużych komórek B, związanym z gorszym przeżyciem, podczas gdy TRPM5 ma właściwości onkogenne w czerniaku .
Rola w reakcjach zapalnych
Oprócz szlaków, w których pośredniczy TLR4 , niektórzy członkowie rodziny kanałów jonowych potencjału receptora przejściowego rozpoznają LPS . Aktywację TRPA1 za pośrednictwem LPS wykazano u myszy i muszek Drosophila melanogaster . W wyższych stężeniach LPS aktywuje również innych członków rodziny sensorycznych kanałów TRP, takich jak TRPV1, TRPM3 i do pewnego stopnia TRPM8. LPS jest rozpoznawany przez TRPV4 na komórkach nabłonka. Aktywacja TRPV4 przez LPS była konieczna i wystarczająca do wywołania produkcji tlenku azotu o działaniu bakteriobójczym.
Historia kanałów Drosophila TRP
Oryginalny mutant TRP u Drosophila został po raz pierwszy opisany przez Cosensa i Manninga w 1969 jako „zmutowany szczep D. melanogaster, który, choć zachowuje się fototaktycznie pozytywnie w labiryncie T przy słabym świetle otoczenia, jest słabo widzący i zachowuje się jak ślepy”. . Wykazał również nieprawidłową odpowiedź fotoreceptorów elektroretinogramu na światło, która była raczej przejściowa niż trwała, jak w przypadku „typu dzikiego”. Został on następnie zbadany przez Barucha Minke, postdoktora w grupie Williama Paka i nazwany TRP zgodnie z jego zachowaniem w ERG. Tożsamość zmutowanego białka była nieznana, dopóki nie zostało sklonowane przez Craiga Montell, badacza podoktoranckiego w grupie badawczej Geralda Rubina, w 1989 roku, który odnotował jego przewidywany związek strukturalny z kanałami znanymi w tym czasie oraz Roger Hardie i Baruch Minke, którzy dostarczyli dowody w 1992 r., że jest to kanał jonowy, który otwiera się w odpowiedzi na stymulację światłem. Kanał TRPL został sklonowany i scharakteryzowany w 1992 roku przez grupę badawczą Leonarda Kelly'ego.
Bibliografia
Dalsza lektura
Zewnętrzne linki
- Przejściowe+Receptor+Potencjał+Kanały w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- „Kanały potencjału receptorów przejściowych” . Baza danych receptorów i kanałów jonowych IUPHAR . Międzynarodowa Unia Farmakologii Podstawowej i Klinicznej.
- Clapham DE, DeCaen P, Carvacho I, Chaudhuri D, Doerner JF, Julius D, et al. "Kanały potencjału receptorów przejściowych" . IUPHAR/BPS Przewodnik po farmakologii.
- "Baza danych TRIP" . ręcznie wyselekcjonowana baza danych interakcji białko-białko dla kanałów TRP ssaków .