Sześciofluorek uranu - Uranium hexafluoride
|
|
|
|
|
|
| Nazwy | |
|---|---|
|
Nazwy IUPAC
Sześciofluorek uranu
Fluorek(VI) uranu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.029.116 |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 2978 (<1% 235 jedn. ) 2977 (>1% 235 jedn.) |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| UF 6 | |
| Masa cząsteczkowa | 352,02 g/mol |
| Wygląd zewnętrzny | Bezbarwne ciało stałe |
| Gęstość | 5,09 g / cm 3 , stałe |
| Temperatura wrzenia | 56,5°C (133,7°F; 329,6 K) (sublimuje, przy ciśnieniu atmosferycznym) |
| Hydrolizuje | |
| Rozpuszczalność | |
| Struktura | |
| rombowe , oP28 | |
| PNMA, nr 62 | |
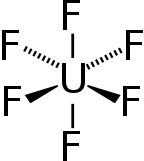
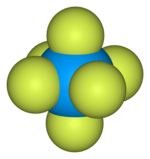
| Oktaedryczny ( O h ) | |
| 0 | |
| Termochemia | |
|
Standardowa
entropia molowa ( S |
|
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
|
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | ICSC 1250 |
|
Klasyfikacja UE (DSD) (nieaktualna)
|
|
| Zwroty R (nieaktualne) | R26/28 , R33 , R51/53 |
| Zwroty S (nieaktualne) | (S1/2) , S20/21 , S45 , S61 |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | Nie palne |
| Związki pokrewne | |
|
Inne aniony
|
Sześciochlorek uranu |
|
Inne kationy
|
Sześciofluorek Neptuna Sześciofluorek plutonu |
|
Powiązane fluorki uranu
|
Fluorek uranu(III) Fluorek uranu(IV) Fluorek uranu(V) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Sześciofluorku uranu ( U C 6 ), potocznie znane jako „ hex ” w przemyśle jądrowym, jest związkiem stosowanym w sposobie według uranu wzbogacania , który wytwarza paliwa dla reaktorów jądrowych i broni jądrowej .
Hex tworzy stałe szare kryształy w standardowej temperaturze i ciśnieniu , jest wysoce toksyczny, reaguje z wodą i powoduje korozję większości metali. Że związek reaguje słabo z aluminium , tworząc cienką warstwę powierzchniową alf 3 , która jest odporna na dalszej reakcji ze związkiem.
Przygotowanie
Zmielona ruda uranu — U 3 O 8 lub „ żółty placek ” — rozpuszcza się w kwasie azotowym , otrzymując roztwór azotanu uranylu UO 2 (NO 3 ) 2 . Czysty azotan uranylu otrzymuje się przez ekstrakcję rozpuszczalnikiem , a następnie potraktowano amoniakiem w celu wytworzenia diuranate amonu ( "ADU", (NH 4 ) 2 U 2 O 7 ). Redukcja wodorem daje UO 2 , który za pomocą kwasu fluorowodorowego (HF) przekształca się w tetrafluorek uranu UF 4 . Utlenianie fluorem daje UF 6 .
Podczas ponownego przetwarzania jądrowego uran poddaje się reakcji z trifluorkiem chloru w celu uzyskania UF 6 :
- U + 2 ClF 3 → UF 6 + Cl 2
Nieruchomości
Właściwości fizyczne
Przy ciśnieniu atmosferycznym , to sublimuje w temperaturze 56,5 ° C.

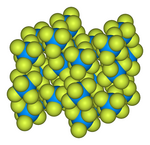
Strukturę ciała stałego określono metodą dyfrakcji neutronów w 77 K i 293 K.
Model kulowo-kijowy komórki elementarnej sześciofluorku uranu
Właściwości chemiczne
Wykazano, że sześciofluorek uranu jest utleniaczem i kwasem Lewisa zdolnym do wiązania się z fluorkiem ; Na przykład, reakcja z miedzi (II), fluorek z uranu w acetonitrylu ocenia się formy miedzi (II), heptafluorouranate (VI), Cu (UF 7 ) 2 .
Wyizolowano i scharakteryzowano metodą dyfrakcji rentgenowskiej polimeryczne fluorki uranu(VI) zawierające kationy organiczne.
Zastosowanie w jądrowym cyklu paliwowym
UF 6 jest stosowany w obu głównych metodach wzbogacania uranu — dyfuzji gazowej i metodzie wirowania gazowego — ponieważ jego punkt potrójny ma temperaturę 64,05 °C (147 °F, 337 K) i jest tylko nieznacznie wyższy niż normalne ciśnienie atmosferyczne. Fluor ma tylko jeden naturalnie występujący stabilny izotop, więc izotopologi UF 6 różnią się masą cząsteczkową w oparciu wyłącznie o obecny izotop uranu .
Wszystkie pozostałe fluorki uranu są nielotnymi ciałami stałymi, które są polimerami koordynacyjnymi .
Dyfuzja gazowa wymaga około 60 razy więcej energii niż proces wirowania gazowego: paliwo jądrowe wytwarzane w procesie dyfuzji gazowej wytwarza 25 razy więcej energii niż zużywa się w procesie dyfuzji, podczas gdy paliwo wytwarzane przez wirówkę wytwarza 1500 razy więcej energii niż jest używane w wirówce proces.
Oprócz zastosowania we wzbogacaniu, sześciofluorek uranu został wykorzystany w zaawansowanej metodzie przetwarzania ( lotność fluoru ), która została opracowana w Republice Czeskiej . W tym procesie zużyte paliwo jądrowe w postaci tlenków jest poddawane obróbce gazowym fluorem w celu wytworzenia mieszaniny fluorków. Ta mieszanina jest następnie destylowana w celu oddzielenia różnych klas materiałów.
Wzbogacanie uranu wytwarza duże ilości zubożonego sześciofluorku uranu lub DUF 6 , jako produkt odpadowy. Długoterminowe przechowywanie DUF 6 stanowi zagrożenie dla środowiska, zdrowia i bezpieczeństwa ze względu na jego niestabilność chemiczną. Gdy UF 6 jest wystawiony na działanie wilgotnego powietrza, reaguje z wodą w powietrzu, tworząc UO 2 F 2 ( fluorek uranylu ) i HF ( fluorowodór ), które są wysoce korozyjne i toksyczne. W 2005 roku 686 500 ton DUF 6 mieściło się w 57.122 butlach znajdujących się w pobliżu Portsmouth w stanie Ohio ; Oak Ridge, Tennessee ; i Paducah, Kentucky . Butle magazynowe należy regularnie sprawdzać pod kątem oznak korozji i wycieków. Szacunkowa żywotność butli stalowych mierzona jest w dziesięcioleciach.
W Stanach Zjednoczonych miało miejsce kilka wypadków związanych z sześciofluorkiem uranu, w tym wypadek napełniania butli i uwolnienia materiału w firmie Sequoyah Fuels Corporation w 1986 roku. Rząd Stanów Zjednoczonych konwertuje DUF 6 na tlenki uranu w postaci stałej do utylizacji. Takie usuwanie całego DUF 6 inwentaryzacji mógłby kosztować od $ 15 do $ 450 mln mln zł.
Bibliografia
Dalsza lektura
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Uran, Teil A, s. 121-123.
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Uran, Teil C 8, s. 71–163.
- R. DeWitt: Sześciofluorek uranu: Przegląd właściwości fizykochemicznych , Raport techniczny, GAT-280; Goodyear Atomic Corp., Portsmouth, Ohio; 12. sierpnia 1960; doi : 10.2172/4025868 .
- Ingmar Grenthe, Janusz Drożdżynński, Takeo Fujino, Edgar C. Buck, Thomas E. Albrecht-Schmitt , Stephen F. Wolf: Uran , w: Lester R. Morss, Norman M. Edelstein, Jean Fuger (hr.): The Chemistry of pierwiastki aktynowe i transaktynowe , Springer, Dordrecht 2006; ISBN 1-4020-3555-1 , s. 253-698; doi : 10.1007/1-4020-3598-5_5 (s. 530-531, 557-564).
- Patent USA 2535572: Wytwarzanie UF 6 ; 26. Grudzień 1950.
- Patent USA 5723837: Oczyszczanie sześciofluorku uranu ; 3. Marzec 1998.
Linki zewnętrzne
- Simon Cotton (Uppingham School, Rutland, Wielka Brytania): Heksafluorek uranu .
- Sześciofluorek uranu (UF 6 ) – Właściwości fizyczne i chemiczne UF 6 , oraz jego zastosowanie w przetwarzaniu uranu – Sześciofluorek uranu i jego właściwości
- Import z Zachodu sześciofluorku zubożonego uranu (ogonów uranu) do Rosji [martwy link 30 czerwca 2017 r.]
- Sześciofluorek uranu na stronie www.webelements.com






