Toksyna erytrogenna - Erythrogenic toxin
Toksyny erytrogenne, zwane również paciorkowcowymi pirogennymi egzotoksynami , są wydzielane przez szczepy bakterii Streptococcus pyogenes . SpeA i speC to superantygeny , które indukują stan zapalny poprzez niespecyficzną aktywację limfocytów T i stymulację produkcji zapalnych cytokin . SpeB, najliczniejsze zewnątrzkomórkowe białko paciorkowców, jest proteazą cysteinową . Egzotoksyny pirogenne są uważane za czynnik wywołujący szkarlatynę i paciorkowcowy zespół wstrząsu toksycznego . Nie ma zgody co do dokładnej liczby egzotoksyn pirogennych. Serotypy AC są najlepiej zbadane i rozpoznawane przez wszystkie źródła, ale inne odnotowują do trzynastu odrębnych typów, kategoryzując od speF do speM jako dodatkowe superantygeny.
Wiadomo, że toksyny erytrogenne uszkadzają błony plazmatyczne naczyń włosowatych krwi pod skórą i powodują czerwoną wysypkę skórną (charakterystyczną dla szkarlatyny). Wcześniejsze badania wykazały, że w zależności od danego szczepu S. pyogenes może być wytwarzanych wiele wariantów toksyn erytrogennych . Niektóre szczepy mogą w ogóle nie wytwarzać wykrywalnej toksyny. Zakażenie bakteriofagiem T12 S. pyogenes umożliwia produkcję speA i zwiększa zjadliwość.
Historia
Odkrycie i nazewnictwo
SpeB został zidentyfikowany w 1919 roku jako ektoenzym wydzielany przez niektóre szczepy paciorkowców. Pierwotnie był badany jako dwie oddzielne toksyny, paciorkowcowa pirogenna egzotoksyna B i paciorkowcowa proteinaza cysteinowa, dopóki nie wykazano, że oba białka były kodowane przez gen speB i że przypisana aktywność pirogenna była spowodowana zanieczyszczeniem przez SpeA i SpeC.
Pirogenny , w paciorkowcowej pirogennej egzotoksynie , oznacza „powoduje gorączkę”. Erytrogenne odnosi się do typowej czerwonej wysypki szkarlatyny. W starszej literaturze toksyny te są również określane jako toksyny szkarlatyny lub toksyny szkarlatyny ze względu na ich rolę jako czynników wywołujących chorobę.
SpeB jest znana jako paciorkowcowa pirogenna egzotoksyna B , streptopaina i paciorkowcowa proteinaza cysteinowa w wyniku jej pierwotnej błędnej identyfikacji jako dwóch oddzielnych toksyn i nie jest ani egzotoksyną, ani pirogenną.
Struktura
Lokalizacja genów
W speB i speJ geny znajdują się w podstawowej chromosomu bakteryjnego wszystkich szczepów S. pyogenes. Jednak pomimo jego obecności i wysokiego poziomu konserwatywności w sekwencji nukleotydowej, 25-40% tych szczepów nie wyraża toksyny SpeB w znaczących ilościach.
W przeciwieństwie do tego, speA , speC i speH-M są kodowane przez bakteriofagi .
Brak jest zgody co do lokalizacji genu speG , który przypisano zarówno chromosomowi rdzeniowemu, jak i fagom lizogennym.
Struktura białka
SpeB jest białkiem o masie 28 kDa z trzema głównymi formami, mSpeB1, mSpeB2 i mSpeB3, które są podzielone na kategorie według odmian pierwszorzędowej sekwencji aminokwasowej. Trzy aminokwasy, C192, H340 i W357, są niezbędne dla aktywności enzymatycznej we wszystkich wariantach. Toksyna zawiera kanoniczną domenę podobną do papainy , a mSpeB2 ma dodatkową domenę wiążącą ludzką integrynę .
Wszystkie superantygenowe paciorkowce pirogenne egzotoksyny zawierają dwie główne konserwatywne domeny białkowe, które są połączone α-helisą, która składa się z pofałdowania wiążącego oligosocaryd/oligonukleotyd na końcu aminowym i domeny β-chwytnej na końcu karboksylowym, jak również regionu wiążącego dodekapeptyd. SpeA ma również pętlę cystynową, miejsce wiązania MHC II łańcucha α o niskim powinowactwie i miejsce wiązania Vβ-TCR. SpeC, SpeG, SpeH i SpeJ zawiera zależne od Zn2 + miejsce wiązania MHC II o wysokim łańcuchu β oprócz miejsca o niskim powinowactwie obecnym w SpeA i nie zawiera pętli cystynowej. SpeH ma również dodatkową pętlę α3-β8, która pośredniczy w specyficzności miejsca wiązania Vβ-TCR toksyny.
Przetwarzanie i regulacja
W speB koduje gen dla kwasu sekwencji aminokwasowej, która staje się 40 kDa zymogenu , znany jako SpeBz po odcięciu sekwencji sygnałowej. SpeBz przechodzi autokatalizę przez co najmniej osiem półproduktów, aby wytworzyć SpeBm 28 kDa. Ostatecznie cystyna-192 i histydyna-340 tworzą katalityczną diadę. Każdy etap jest ściśle regulowany przez wiele czynników, co pozwala na wyrafinowaną ekspresję czasową dojrzałej proteinazy.
Mechanizmy działania
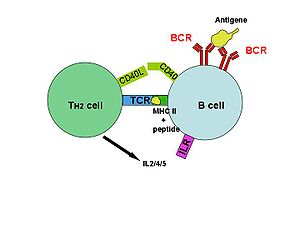
SpeA i speC
SpeA i SpeC wiążą się z cząsteczkami MHC klasy II , są prezentowane limfocytom T i wiążą się ze zmiennym regionem łańcucha beta receptorów komórek T. Po aktywacji komórki T uwalniają prozapalne cytokiny i chemokiny. Interakcje z TCR charakteryzują się niskim powinowactwem i szybką dysocjacją, umożliwiając toksynie aktywację wielu limfocytów T po kolei. Brak swoistości pozwala na aktywację do 50% limfocytów T w organizmie.
SpeB
Rozszczepienie SpeB degraduje wiele białek poprzez hydrolizę, w tym cytokiny, białka macierzy zewnątrzkomórkowej i immunoglobuliny. Wymaga trzech aminokwasów przed miejscem cięcia, znanym jako P1, P2 i P3. Spośród nich SpeB preferuje hydrofobowe reszty P2 i dodatnio naładowane reszty P1, z większym znaczeniem aminokwasu P2.
Role w zjadliwości, patogenezie i infekcji
SpeB
Proteinaza cysteinowa paciorkowcowa odgrywa rolę w unikaniu odporności i apoptozie, a także ma potencjalny wpływ na internalizację bakterii. Istnieją sprzeczne dowody dotyczące wpływu SpeB na zjadliwość. Niektóre badania wykazały zwiększone poziomy proteazy w szczepach wywołujących szkarlatynę w porównaniu z tymi związanymi z paciorkowcowym zespołem wstrząsu toksycznego, podczas gdy inne wykazują zmniejszoną ekspresję w bardziej zjadliwych szczepach.
SpeB degraduje immunoglobuliny i cytokiny, a także poprzez rozszczepienie C3b, hamując rekrutację komórek fagocytarnych i szlak aktywacji dopełniacza . Powoduje to zmniejszenie stanu zapalnego i poziomu neutrofili wokół miejsca infekcji, zapobiegając usuwaniu i poprzez fagocytozę oraz promując przeżycie S. pyogenes.
Toksyna indukuje również apoptozę w komórkach gospodarza po internalizacji GAS. Dowody sugerują, że może to odbywać się poprzez zewnętrzne i wewnętrzne szlaki kaspazy. W proces ten zaangażowany jest szlak wiązania receptora i apoptotyczny szlak sygnałowy, w którym pośredniczy Fas. Indukcja apoptozy powoduje martwicze zapalenie powięzi.
Bibliografia
- ^ a b c d Brosnahan, AJ; Schlievert, premier (grudzień 2011). „Sygnalizacja zewnętrzna superantygenu bakterii Gram-dodatnich powoduje zespół wstrząsu toksycznego: sygnalizacja zewnętrzna superantygenu z zewnątrz” . Dziennik FEBS . 278 (23): 4649-67. doi : 10.1111/j.1742-4658.2011.08151.x . PMC 3165073 . PMID 21535475 .
- ^ B c d e Spaulding Ar; Salgado-Pabon, W.; Kohler, PL; Horswill, AR; Leung, DYM; Schlievert, premier (2013). „Egzotoksyny superantygenów gronkowcowych i paciorkowcowych” . Recenzje mikrobiologii klinicznej . 26 (3): 422–47. doi : 10.1128/CMR.00104-12 . PMC 3719495 . PMID 23824366 .
- ^ a b c d Llewelyn, M.; Cohen, J. (marzec 2002). „Superantygeny: czynniki drobnoustrojowe, które psują odporność”. Lancetowe choroby zakaźne . 2 (3): 156–62. doi : 10.1016/s1473-3099(02)00222-0 . PMID 11944185 .
- ^ B c d e f g Chiang-Ni, C .; Wu, J.-J (2008). „Wpływ Streptococcus pirogennej egzotoksyny B na patogenezę Streptococcus pyogenes” . Czasopismo Towarzystwa Lekarskiego z Formosanu . 107 (9): 677–85. doi : 10.1016/S0929-6646(08)60112-6 . PMID 18796357 .
- ^ B c d e Nelson, Daniel C .; Garbe, Julio; Collin, Mattias (2011). „Proteaza cysteinowa SpeB ze Streptococcus pyogenes – silny modyfikator immunologicznie ważnych białek gospodarza i bakterii”. Chemia biologiczna . 392 (12): 1077–88. doi : 10.1515/bc.2011.208 . PMID 22050223 .
- ^ B Brosnahan Amanda J .; Schlievert, Patrick M. (01.12.2011). „Sygnalizacja superantygenu bakterii Gram-dodatnich na zewnątrz wewnątrz powoduje zespół wstrząsu toksycznego” . Dziennik FEBS . 278 (23): 4649-4667. doi : 10.1111/j.1742-4658.2011.08151.x . ISSN 1742-4658 . PMC 3165073 . PMID 21535475 .
- ^ B Hongmin Li; Andrea Llera; Emilio L. Malchiodi; Roy A. Mariuzza (1999). „Strukturalne podstawy aktywacji komórek T przez superantygeny”. Roczny przegląd immunologii . 17 (1): 435–466. doi : 10.1146/annurev.immunol.17.1.435 . PMID 10358765 .
- ^ Tortora, Gerard; Funke'a, Berdella; Sprawa, Christine (2013). Mikrobiologia (wyd. 11). Osoba. str. 439.
- ^ Knöll H Srámek J Vrbová K Gerlach D Reichardt W Kohler W (grudzień 1991). „Szkarlatyna i rodzaje toksyn erytrogennych wytwarzanych przez zarażające szczepy paciorkowców”. Zentralbl Bakteriol . 276 (1): 94-106. doi : 10.1016/s0934-8840(11)80223-9 . PMID 1789905 .
- ^ McShan, WM; Tang, YF; Ferretti, JJ (1997). „Bakteriofag T12 Streptococcus pyogenes integruje się z genem kodującym seryny tRNA” . Mikrobiologia molekularna . 23 (4): 719–28. doi : 10.1046/j.1365-2958.1997.2591616.x . PMID 9157243 .
- ^ B c d e f Carroll Ronan K .; Musser, James M. (01.08.2011). „Od transkrypcji do aktywacji: jak paciorkowiec grupy A, patogen mięsożerny, reguluje produkcję proteazy cysteinowej SpeB” . Mikrobiologia molekularna . 81 (3): 588-601. doi : 10.1111/j.1365-2958.2011.07709.x . ISSN 1365-2958 . PMID 21707787 .
- ^ B c Nelson, Daniel C .; Garbe, Julio; Collin, Mattias (01.12.2011). „Proteaza cysteinowa SpeB ze Streptococcus pyogenes - silny modyfikator immunologicznie ważnych białek gospodarza i bakterii”. Chemia biologiczna . 392 (12): 1077-1088. doi : 10.1515/BC.2011.208 . ISSN 1437-4315 . PMID 22050223 .
- ^ „Pirogen (definicja)” . Darmowy słownik .
- ^ B Chiang-Ni Chuan; Wu, Jiunn-Jong (2008). „Wpływ paciorkowców pirogennych egzotoksyny B na patogenezę Streptococcus pyogenes” . Czasopismo Towarzystwa Lekarskiego z Formosanu . 107 (9): 677–685. doi : 10.1016/s0929-6646(08)60112-6 . PMID 18796357 .
- ^ Boyd, E. Fidelma (2012). Szybalski, Małgorzata Łobocka i Wacław T. (red.). Rozdział 4 — Zakodowane przez bakteriofagi bakteryjne czynniki wirulencji i interakcje między fagami a patogennością wysp . Postępy w badaniach nad wirusami . Bakteriofagi, część A. 82 . s. 91–118. doi : 10.1016/b978-0-12-394621-8.00014-5 . Numer ISBN 9780123946218. PMID 22420852 .
Linki zewnętrzne
-
 Multimedia związane z toksyną erytrogenną w Wikimedia Commons
Multimedia związane z toksyną erytrogenną w Wikimedia Commons - Internetowy podręcznik bakteriologii Todaradar
- Streptococcus pirogenna egzotoksyna A1