Hipertermiczna chemioterapia dootrzewnowa - Hyperthermic intraperitoneal chemotherapy
| Hipertermiczna chemioterapia dootrzewnowa | |
|---|---|
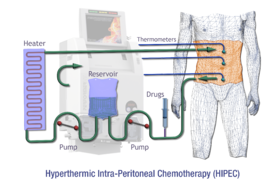 Schematyczny przegląd HIPEC
| |
| Inne nazwy | Hipertermiczna chemioterapia dootrzewnowa (HIPEC), hipertermiczna chemioperfuzja w jamie brzusznej, śródoperacyjna chemohipertermiczna perfuzja otrzewnowa (CHPP) lub technika Sugarbakera |
| Specjalność | Chirurgia onkologiczna |
Dootrzewnowa chemoperfuzja hipertermiczna ( HIPEC lub IPHC ) to rodzaj terapii hipertermicznej stosowanej w połączeniu z zabiegiem chirurgicznym w leczeniu zaawansowanych nowotworów jamy brzusznej. W tej procedurze podgrzane leki przeciwnowotworowe są podawane w infuzji i krążą w jamie otrzewnej (brzuch) przez krótki czas. Do środków chemioterapeutycznych zwykle podane w ciągu IPHC są mitomycyna-C i cisplatyny .
Zastosowania medyczne
IPHC jest zwykle stosowany po chirurgicznym usunięciu jak największej ilości raka ( zmniejszanie masy ), co może obejmować usunięcie wszystkich zaangażowanych obszarów otrzewnej . Dowody potwierdzają korzyści w niektórych przypadkach raka jajnika .
Nie ma wystarczających dowodów na rok 2020, aby uzasadnić jego zastosowanie w pierwotnym zaawansowanym raku jajnika, jajowodzie lub pierwotnym raku otrzewnej, nawrotowym raku jajnika, raku jelita grubego otrzewnej, raku otrzewnej żołądka, złośliwym międzybłoniaku otrzewnej lub rozsianym nowotworze śluzowym wyrostka robaczkowego .
Procedury te mogą trwać 8–10 godzin i niosą ze sobą znaczną liczbę powikłań.
Odpowiednikiem HIPEC w klatce piersiowej jest hipertermiczna chemioterapia do klatki piersiowej (HITOC).
Środki do chemioterapii
Stosuje się różne chemioterapie i nie ma jasnego konsensusu co do tego, które leki powinny być stosowane. Najczęściej stosowanymi środkami w przypadku raka jelita grubego są mitomycyna C i oksaliplatyna , natomiast w przypadku raka jajnika cisplatyna .
Historia
W 1934 roku Joe Vincent Meigs z Nowego Jorku opisał chirurgię zmniejszania masy guza (operację cytoredukcyjną) raka jajnika w celu zmniejszenia choroby makroskopowej. W latach 60. i 70. zaczęto akceptować to agresywne podejście cytoredukcyjne. W tym czasie dr Kent Griffith z National Cancer Institute przedstawił również wskaźniki prognostyczne przeżycia u pacjentów z rakiem jajnika w II i III stopniu zaawansowania, co ważne, zauważając, że wielkość masy guza resztkowego (<1,6 cm) po operacji cytoredukcyjnej była istotnie związana z wydłużonym czasem przeżycia . W tym czasie badania zaczęły wykazywać, że hipertermia oraz chemioterapia dootrzewnowa są skuteczne w zabijaniu komórek rakowych. Spratt i in. w latach 80. na Uniwersytecie Louisville w Kentucky połączono te koncepcje w system infiltracji termicznej transfuzji (TIFS) do dostarczania podgrzanej chemioterapii do przestrzeni otrzewnowej psów. Pierwszy człowiek został poddany TIFS z podaniem chemioterapii hipertermicznej w przypadku miejscowo zaawansowanego nowotworu jamy brzusznej w 1979 roku. Dalsze badania w latach 80. dostarczyły środków chemioterapeutycznych w stężeniach do 30 razy większych niż te bezpiecznie podawane drogą dożylną. W połowie lat 80. Sugarbaker kierował dalszymi badaniami w Washington Cancer Institute nad terapią nowotworów przewodu pokarmowego z rozsiewem otrzewnej i był w stanie odnotować korzyści w zakresie przeżycia. Wcześnie okazało się, że kompletność cytoredukcji wiązała się z korzyścią dla przeżycia. W 1995 roku Sugarbaker stworzył stopniowe podejście do cytoredukcji, próbując ujednolicić i zoptymalizować ten proces.
Technikę HIPEC dodatkowo udoskonalono, sugerując wiele sposobów porodu. Technika „Coliseum” oraz podobne podejście opisane przez dr Paula Sugarbakera w 1999 roku to techniki otwartego brzucha, w których wlewano podgrzaną chemioterapię. Korzyści z tego otwartego podejścia obejmowały bezpośredni dostęp chirurga do jamy podczas podawania środków hipertermicznych do manipulowania płynem i jelitami w celu uzyskania szybkiej i jednorodnej temperatury i rozprowadzenia leku w jamie brzusznej. Dodatkowo można zadbać o to, aby wszystkie powierzchnie otrzewnej były równomiernie odsłonięte przez cały czas trwania terapii, a także aby uniknąć niebezpiecznych temperatur lub nadmiernej ekspozycji na normalne tkanki. Dla porównania, technika zamknięta polega na zamknięciu ściany jamy brzusznej przed infuzją chemioterapii, zmniejszając problem utraty ciepła z powierzchni otrzewnej. Próbując połączyć potencjalne zalety tych dwóch technik, Sugarbaker zastosował metodę półotwartą, opracowując nowy instrument zabezpieczający (rozciągacz Thompsona) opisany w 2005 r. do wspomagania wodoszczelnego podniesienia krawędzi skóry brzucha. Niedawno opisano laparoskopowe podejście do CRS z HIPEC u wysoce wyselekcjonowanych pacjentów z minimalnym obciążeniem chorobą.
Kolejny postęp nastąpił w 2016 roku, kiedy Lotti M. et al. opisali nową technikę, technikę Laparoscopy-Enhanced HIPEC (LE-HIPEC), w której chemioterapia hipertermiczna jest podawana po zamknięciu rany brzusznej, a dostęp laparoskopowy jest używany do mieszania treści brzusznej podczas perfuzji. Lotti M zakwestionowała stwierdzenie, że technika Coliseum może osiągnąć jednorodny rozkład ciepła. Celem LE-HIPEC jest osiągnięcie lepszego dostarczania i konserwacji ciepła (jak w technice zamkniętej) oraz lepszej cyrkulacji płynu perfuzyjnego (jak w technice otwartej). W porównaniu ze standardową techniką zamkniętego brzucha, technika LE-HIPEC pozwala chirurgowi otworzyć przedziały brzuszne, aby umożliwić napływ podgrzanego płynu perfuzyjnego. Ponadto pozwala na identyfikację i podział wczesnych zrostów śródbrzusznych, które mogą utrudniać krążenie płynu perfuzyjnego podczas standardowej perfuzji zamkniętej jamy brzusznej. W dalszym badaniu Lotti M i in. wykazali, że po CRS wczesne zrosty śródbrzuszne występują u 70% pacjentów, wkrótce po zamknięciu rany.
Mechanizm
Chemioterapia we wlewie dyfunduje z płynu śródotrzewnowego do tkanek, przestrzeni śródmiąższowej i osocza, podobnie jak dializa otrzewnowa . Bariera osocze-otrzewna zapobiega ogólnoustrojowej absorpcji chemioterapii do krwiobiegu, ograniczając w ten sposób toksyczność i skutki uboczne. Niektóre środki, takie jak cisplatyna lub mitomycyna C, są podgrzewane do 41–43°C w celu zwiększenia efektu cytotoksycznego.
Środki znieczulające
Istnieją doniesienia, że terapia celowa może przyczynić się do indywidualnego dostosowania płynoterapii i leków, co może pozwolić uniknąć przewodnienia i zapewnić stabilność hemodynamiczną .
Spór
Chociaż potencjalnie leczniczy, CRS plus HIPEC wiąże się ze znaczną okołooperacyjną chorobowością i śmiertelnością oraz krótkotrwałym pogorszeniem jakości życia. Sceptycy tej procedury twierdzą, że nie ma wieloośrodkowego randomizowanego badania III fazy porównującego CRS+HIPEC z całkowitą cytoredukcją, po której następuje leczenie systemowe. Dlatego terapia ta nie spełniła naukowej poprzeczki, aby uznać ją za standard opieki. Zwolennicy CRS+HIPEC twierdzą jednak, że do tej pory nie było terapii systemowej, która zapewniłaby przedłużone przeżycie przerzutów do otrzewnej. Przerzuty do otrzewnej, na podstawie guza pierwotnego i rozległości choroby, mają medianę całkowitego przeżycia wynoszącą mniej niż 36 miesięcy w oparciu o samą terapię systemową. Leczenie raka otrzewnej pochodzenia jelita grubego za pomocą chirurgii cytoredukcyjnej (CRS) z hipertermiczną chemioterapią dootrzewnową (HIPEC) charakteryzuje się 5-letnim odsetkiem nawrotów lub wyleczalności wynoszącym co najmniej 16%.
