Czerwona sól Roussina - Roussin's red salt

|
|
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
tetranitrozylo-di-μ-sulfidodiżelazo( Fe – Fe )(2–) potasu
|
|
| Inne nazwy
Żelazian(2-), tetranitrozylodi-mu-tioksodi-, (Fe-Fe), dipotas
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| Fe 2 N 4 K 2 O 4 S 2 | |
| Masa cząsteczkowa | 374,04 g/mol |
| Wygląd zewnętrzny | Ciemnoczerwone kryształy |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Czerwona Sól Roussina jest związkiem nieorganicznym o wzorze K 2 [Fe 2 S 2 (NO) 4 ]. Ten metal nitrozyl został po raz pierwszy opisany przez Zacharie Roussin w 1858 roku, co czyni go jednym z pierwszych syntetycznych klastrów żelazowo-siarkowych .
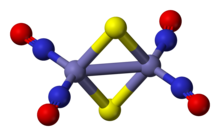
Struktura i klejenie
Anion soli czerwonej Roussina jest bitetrahedronem o wspólnych krawędziach, w którym para jednostek Fe(NO) 2 jest zmostkowana przez parę ligandów siarczkowych . Wiązania Fe- NO są liniowe, co oznacza, że NO działa jako donor trzech elektronów. Związek diamagnetyczny podlega zasadzie 18 elektronów . Ciemnoczerwony kolor kompleksu przypisuje się szeregowi oddziaływań przeniesienia ładunku między rdzeniem żelazowym a ligandami nitrozylowymi.
Synteza
Francuski chemik Z. Roussin jako pierwszy przygotował tę sól, badając reakcje między jonem nitroprusydku ([Fe(CN) 5 NO] 2- ) a siarką. Sól można wytworzyć w reakcji soli siarczkowych z halogenkami nitrozylu żelaza:
- Fe 2 I 2 (NO) 4 + 2Li 2 S → Li 2 Fe 2 S 2 (NO) 4 + 2LiI
Aby otrzymać „estry”, sól jest alkilowana:
- Li 2 Fe 2 S 2 (NO) 4 + 2 RX → Fe 2 (SR) 2 (NO) 4 + 2 LiX
Estry można również łatwo otrzymać w reakcji Fe 2 I 2 (NO) 4 z tiolem .
Występowanie i potencjalne zastosowania
Występuje w naturze jako „estry” o wzorze Fe 2 (SR) 2 (NO) 4 , gdzie „R” oznacza dowolną grupę alkilową [1]. Ponadto czerwona sól Roussina jest omawiana w dziedzinie mikrobiologii i nauk o żywności ze względu na jej właściwości mutagenne.
Pochodna estrowa jest badana jako donory tlenku azotu w biologii i medycynie. Ze względu na stosunkowo niską toksyczność i dobrą stabilność czerwona sól Roussina. Fotoliza związku indukuje uwalnianie NO, tym samym uwrażliwiając komórki docelowe na ekspozycję na promieniowanie [2].
Zobacz też
Bibliografia
- ^ Butler, Anthony R. (lipiec 1982). „Chemik Z. Roussin (1827-94)”. Journal of Chemical Education . 59 (7): 549. Kod Bib : 1982JChEd..59..549B . doi : 10.1021/ed059p549 .
- ^ Roussin, ML (1858). „Recherches sur les nitrosulfures doubles de fer (nouvelle classe de sels)” . Anny. Szym. Fiz . 52 : 285–303.
- ^ Tomasz, JT; Robertson, JH; Cox, EG (1 września 1958). „Struktura krystaliczna czerwonego estru etylowego Roussina”. Acta Crystallographica . 11 (9): 599–604. doi : 10.1107/S0365110X58001602 .
- ^ Jaworska Maria; Stasicka, Zofia (2005). „Struktura i spektroskopia UV-Vis żelazowo-siarkowych dwupierścieniowych kompleksów nitrozylowych [Fe 2 S 2 (NO) 4 ] 2- i [Fe 2 (SR) 2 (NO) 4 ]”. Nowy Czasopismo Chemii . 29 (4): 604. doi : 10.1039/B409519G .
- ^ Butler, Anthony R. (lipiec 1982). „Chemik Z. Roussin (1827-94)”. Journal of Chemical Education . 59 (7): 549. Kod Bib : 1982JChEd..59..549B . doi : 10.1021/ed059p549 .
- ^ Hans Reihlen, Adolf v. Friedolsheim (1927). "Über komplexe Stickoxydverbindungen und das sogenannte einwertige Eisen" . Justus Liebigs Annalen der Chemie . 457 : 71-82. doi : 10.1002/jlac.19274570103 .
- ^ TB Rauchfussa; TD Weatherill (1982). „Czerwona sól Roussina ponownie: reaktywność Fe2 (μ-E) 2 (NO) 42-(E = S, Se, Te) i pokrewne”. Chemia nieorganiczna . 21 (2): 827-830. doi : 10.1021/ic00132a071 .
- ^ Greenwood, NN; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4 .
