Atom Rydberga - Rydberg atom

Rydberga atom jest wzbudzony atom z jednym lub więcej elektronów , które mają bardzo wysoką główną liczbę kwantową , n . Im wyższa wartość n , tym średnio elektron jest dalej od jądra . Atomy Rydberga mają szereg specyficznych właściwości, w tym przesadną reakcję na pola elektryczne i magnetyczne , długie okresy rozpadu i funkcje fal elektronowych, które w pewnych warunkach przybliżają klasyczne orbity elektronów wokół jąder . Elektrony rdzenia osłaniają zewnętrzny elektron z pola elektrycznego jądra, tak że z pewnej odległości potencjał elektryczny wygląda identycznie jak elektron w atomie wodoru .
Pomimo swoich wad model atomu Bohra jest przydatny w wyjaśnianiu tych właściwości. Klasycznie, elektron na orbicie kołowej o promieniu r , wokół jądra wodoru o ładunku + e , spełnia drugie prawo Newtona :
gdzie k = 1 / (4π ε 0 ).
Pęd orbitalny jest kwantyzowany w jednostkach ħ :
- .
Połączenie tych dwóch równań prowadzi do Bohra ekspresji jest do promienia orbity w odniesieniu do głównego liczby kwantów , n :
Teraz jest oczywiste, dlaczego atomy Rydberga mają tak szczególne właściwości: skala promienia orbity wynosi n 2 ( stan wodoru n = 137 ma promień atomowy ~ 1 µm) i przekrój geometryczny n 4 . Zatem atomy Rydberga są niezwykle duże z luźno związanymi elektronami walencyjnymi , łatwo zakłócanymi lub jonizowanymi przez zderzenia lub pola zewnętrzne.
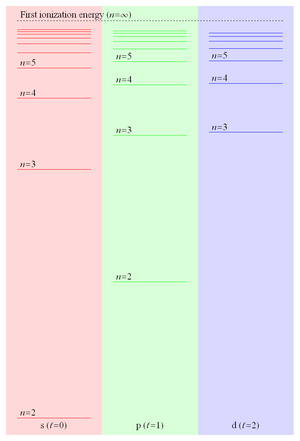
Ponieważ energia wiązania elektronu Rydberga jest proporcjonalna do 1 / r, a zatem spada jak 1 / n 2 , odstępy poziomów energii spadają jak 1 / n 3, prowadząc do coraz bliżej położonych poziomów zbiegających się z pierwszą energią jonizacji . Te blisko rozmieszczone stany Rydberga tworzą coś, co jest powszechnie określane jako seria Rydberga . Figura 2 pokazuje kilka poziomów energii trzech najniższych wartości orbitalnej pędu w litu .
Historia
Istnienie serii Rydberga zostało po raz pierwszy zademonstrowane w 1885 roku, kiedy Johann Balmer odkrył prosty empiryczny wzór na długości fal światła związane z przejściami w atomowym wodorze . Trzy lata później szwedzki fizyk Johannes Rydberg przedstawił uogólnioną i bardziej intuicyjną wersję wzoru Balmera, który stał się znany jako wzór Rydberga . Formuła ta wskazywała na istnienie nieskończonej serii coraz bliżej rozmieszczonych dyskretnych poziomów energii, zbiegających się na skończonej granicy.
Seria ta została jakościowo wyjaśniona w 1913 roku przez Nielsa Bohra jego półklasycznym modelem atomu wodoru, w którym skwantyzowane wartości momentu pędu prowadzą do zaobserwowanych dyskretnych poziomów energii. Pełne ilościowe wyprowadzenie obserwowanego widma zostało wyprowadzone przez Wolfganga Pauliego w 1926 roku po rozwinięciu mechaniki kwantowej przez Wernera Heisenberga i innych.
Metody produkcji
Jedynym prawdziwie stabilnym stanem atomu wodoru jest stan podstawowy z n = 1. Badanie stanów Rydberga wymaga niezawodnej techniki wzbudzania atomów w stanie podstawowym do stanów o dużej wartości n .
Wzbudzenie udarowe elektronów
Wiele wczesnych prac eksperymentalnych nad atomami Rydberga polegało na wykorzystaniu skolimowanych wiązek szybkich elektronów padających na atomy w stanie podstawowym. Nieelastyczne procesy rozpraszania mogą wykorzystywać energię kinetyczną elektronów do zwiększania energii wewnętrznej atomów ekscytujących do szerokiego zakresu różnych stanów, w tym wielu wysoko położonych stanów Rydberga,
- .
Ponieważ elektron może zachować dowolną ilość swojej początkowej energii kinetycznej, proces ten zawsze skutkuje powstaniem populacji o szerokim zasięgu różnych energii.
Wzbudzenie wymiany ładunku
Inny filar wczesnych eksperymentów atomowych Rydberga polegał na wymianie ładunków między wiązką jonów a populacją neutralnych atomów innego gatunku, w wyniku czego powstała wiązka silnie wzbudzonych atomów,
- .
Ponownie, ponieważ energia kinetyczna interakcji może przyczyniać się do końcowych energii wewnętrznych składników, technika ta obejmuje szeroki zakres poziomów energii.
Wzbudzenie optyczne
Pojawienie się przestrajalnych laserów barwnikowych w latach 70. XX wieku umożliwiło znacznie większy poziom kontroli nad populacjami wzbudzonych atomów. W przypadku wzbudzenia optycznego padający foton jest absorbowany przez atom docelowy, co jest absolutnie niezbędne do określenia końcowej energii stanu. Problem wytwarzania pojedynczych, monoenergetycznych populacji atomów Rydberga staje się więc nieco prostszym problemem precyzyjnego sterowania częstotliwością wyjścia lasera,
- .
Ta forma bezpośredniego wzbudzenia optycznego jest na ogół ograniczona do eksperymentów z metalami alkalicznymi , ponieważ energia wiązania w stanie podstawowym w innych gatunkach jest ogólnie zbyt wysoka, aby była dostępna dla większości systemów laserowych.
W przypadku atomów o dużej energii wiązania elektronów walencyjnych (równoważnej dużej energii pierwszej jonizacji ) stany wzbudzone szeregu Rydberga są niedostępne w konwencjonalnych systemach laserowych. Początkowe wzbudzenie kolizyjne może uzupełnić niedobór energii, umożliwiając użycie wzbudzenia optycznego do wyboru stanu końcowego. Chociaż początkowy etap wzbudza szeroki zakres stanów pośrednich, precyzja nieodłącznie związana z procesem wzbudzenia optycznego oznacza, że światło lasera oddziałuje tylko z określonym podzbiorem atomów w określonym stanie, pobudzając do wybranego stanu końcowego.
Potencjał hydrogenny
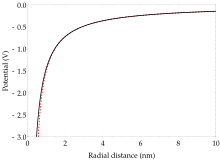
Atom w stanie Rydberga ma elektron walencyjny na dużej orbicie daleko od rdzenia jonu; na takiej orbicie najbardziej zewnętrzny elektron odczuwa prawie hydrogeniczny potencjał Coulomba , U C ze zwartego rdzenia jonowego składającego się z jądra z protonami Z i dolnych powłok elektronowych wypełnionych elektronami Z -1. Elektron w sferycznie symetrycznym potencjale Coulomba ma energię potencjalną:
- .
Podobieństwo efektywnego potencjału „widzianego” przez zewnętrzny elektron do potencjału wodoru jest charakterystyczną cechą stanów Rydberga i wyjaśnia, dlaczego funkcje falowe elektronów zbliżają się do klasycznych orbit w granicach zasady zgodności . Innymi słowy, orbita elektronu przypomina orbitę planet w układzie słonecznym, podobnie do tego, co widzieliśmy w przestarzałych, ale przydatnych wizualnie modelach atomu Bohra i Rutherforda .
Istnieją trzy godne uwagi wyjątki, które można scharakteryzować dodatkowym terminem dodanym do energii potencjalnej:
- Atom może mieć dwa (lub więcej) elektrony w stanach silnie wzbudzonych o porównywalnych promieniach orbity. W tym przypadku oddziaływanie elektron-elektron prowadzi do znacznego odchylenia od potencjału wodoru. Dla atomu w stanie wielokrotnego Rydberga, dodatkowy termin, U ee , zawiera sumę każdej pary wysoce wzbudzonych elektronów:
- .
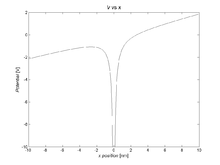
- Jeżeli elektronów wartościowość ma bardzo niską momentem pędu (interpretować klasycznie jako niezwykle mimośrodowego eliptycznej), to może on przejść wystarczająco blisko do polaryzacji rdzeń jonowej, dając w 1 / r 4 rdzenia polaryzacji terminu w potencjale. Interakcja między indukowanym dipolem a ładunkiem, który go wytwarza, jest zawsze atrakcyjna, więc wkład ten jest zawsze ujemny,
- ,
- gdzie α d jest polaryzowalnością dipolową . Rysunek 3 pokazuje, jak termin polaryzacji modyfikuje potencjał w pobliżu jądra.
- Jeśli zewnętrzny elektron przeniknie przez wewnętrzne powłoki elektronów, „zobaczy” więcej ładunku jądra, a tym samym doświadczy większej siły. Ogólnie rzecz biorąc, modyfikacja energii potencjalnej nie jest łatwa do obliczenia i musi opierać się na znajomości geometrii rdzenia jonowego.
Detale kwantowo-mechaniczne
Z mechaniki kwantowej stan z nienormalnie wysokim n odnosi się do atomu, w którym elektron (y) walencyjny został (e) wzbudzony do niegdyś niezamieszkanego orbitalu elektronowego z wyższą energią i niższą energią wiązania . W wodorze energia wiązania jest wyrażona wzorem:
- ,
gdzie Ry = 13,6 eV jest stałą Rydberga . Niska energia wiązania przy wysokich wartościach n wyjaśnia, dlaczego stany Rydberga są podatne na jonizację.
Dodatkowe terminy w wyrażeniu energii potencjalnej dla stanu Rydberga, oprócz hydrogenicznej energii potencjalnej Coulomba, wymagają wprowadzenia defektu kwantowego , δ l , do wyrażenia dla energii wiązania:
- .
Funkcje falowe elektronów
Długie okresy życia stanów Rydberga z wysokim orbitalnym momentem pędu można wyjaśnić nakładaniem się funkcji falowych. Funkcja falowa elektronu w stanie wysokim l (wysoki moment pędu, „orbita kołowa”) w bardzo niewielkim stopniu pokrywa się z funkcjami falowymi elektronów wewnętrznych, a zatem pozostaje stosunkowo niezakłócona.
Trzy wyjątki od definicji atomu Rydberga jako atomu o potencjale wodorowym mają alternatywny opis mechaniki kwantowej, który można scharakteryzować dodatkowymi terminami w atomowym hamiltonianie :
- Jeśli drugi elektron zostanie wzbudzony w stan n i , energetycznie zbliżony do stanu zewnętrznego elektronu n o , wówczas jego funkcja falowa stanie się prawie tak duża jak pierwszy (podwójny stan Rydberga). Dzieje się tak, gdy n i zbliża się do n o i prowadzi do stanu, w którym rozmiary orbit dwóch elektronów są powiązane; stan czasami określany jako korelacja radialna . Termin odpychania elektron-elektron musi być zawarty w hamiltonianie atomowym.
- Polaryzacja rdzenia jonowego wytwarza potencjał anizotropowy, który powoduje korelację kątową między ruchami dwóch najbardziej zewnętrznych elektronów. Można to traktować jako efekt blokowania pływów ze względu na potencjał niesferycznie symetryczny. W hamiltonianie atomowym należy uwzględnić termin polaryzacji rdzenia.
- Funkcja falowa elektronu zewnętrznego w stanach o niskim orbitalnym momencie pędu l jest okresowo lokalizowana w powłokach wewnętrznych elektronów i oddziałuje z pełnym ładunkiem jądra. Figura 4 przedstawia pół-klasycznym interpretacja kątowych stanów pędu elektronu orbitalnej, pokazującym, że niskiego l stany przechodzą bliżej pierścienia potencjalnie penetrującego rdzenia jonowy. Do atomowego hamiltonianu należy dodać termin penetracji rdzenia.
Na polach zewnętrznych
Duża separacja między elektronem i rdzeniem jonowym w atomie Rydberga umożliwia niezwykle duży elektryczny moment dipolowy , d . Istnieje energia związana z obecnością dipola elektrycznego w polu elektrycznym , F , znana w fizyce atomowej jako przesunięcie Starka ,
W zależności od znaku rzutu momentu dipolowego na lokalny wektor pola elektrycznego, stan może mieć energię, która rośnie lub maleje wraz z siłą pola (odpowiednio stany niskiego i wysokiego pola poszukiwania). Wąskie odstępy między sąsiednimi n- poziomami w szeregu Rydberga oznaczają, że stany mogą zbliżyć się do degeneracji nawet przy stosunkowo niewielkich natężeniach pola. Teoretyczne natężenie pola, przy którym wystąpiłoby skrzyżowanie przy założeniu braku sprzężenia między stanami, określa granica Inglisa – Tellera ,
W atomie wodoru czysty potencjał 1 / r Coulomba nie łączy stanów Starka z sąsiednich n- rozgałęzień, co powoduje rzeczywiste skrzyżowania, jak pokazano na rysunku 5 . Obecność dodatkowych składników w energii potencjalnej może prowadzić do sprzężenia skutkującego uniknięciem skrzyżowań, jak pokazano dla litu na rysunku 6 .
Aplikacje i dalsze badania
Precyzyjne pomiary uwięzionych atomów Rydberga
Czas życia rozpadu radiacyjnego atomów w stanach metastabilnych do stanu podstawowego jest ważny dla zrozumienia obserwacji astrofizycznych i testów modelu standardowego.
Badanie efektów diamagnetycznych
Dużych rozmiarów i niskiej energii wiązania atomów Rydberga prowadzić do dużej podatności magnetycznej , . Ponieważ efekty diamagnetyczne są skalowane wraz z obszarem orbity, a powierzchnia jest proporcjonalna do kwadratu promienia ( A ∝ n 4 ), efekty niemożliwe do wykrycia w atomach w stanie podstawowym stają się oczywiste w atomach Rydberga, które wykazują bardzo duże przesunięcia diamagnetyczne.
Atomy Rydberga wykazują silne sprzężenie dipolowo-elektryczne atomów z polami elektromagnetycznymi i są wykorzystywane do wykrywania komunikacji radiowej.
W plazmach
Atomy Rydberga tworzą się powszechnie w plazmie w wyniku rekombinacji elektronów i jonów dodatnich; rekombinacja niskoenergetyczna skutkuje dość stabilnymi atomami Rydberga, podczas gdy rekombinacja elektronów i jonów dodatnich o wysokiej energii kinetycznej często prowadzi do autoionizujących stanów Rydberga. Duże rozmiary atomów Rydberga oraz podatność na zakłócenia i jonizację przez pola elektryczne i magnetyczne są ważnym czynnikiem determinującym właściwości plazmy.
Kondensacja atomów Rydberga tworzy materię Rydberga , najczęściej obserwowaną w postaci długowiecznych skupisk. Odwzbudzenie jest znacznie utrudnione w materii Rydberga przez efekty korelacyjno-wymienne w niejednorodnej cieczy elektronowej utworzonej podczas kondensacji przez kolektywne elektrony walencyjne, co powoduje wydłużenie żywotności klastrów.
W astrofizyce
Sugerowano, że atomy Rydberga są powszechne w przestrzeni międzygwiazdowej i można je obserwować z Ziemi. Ponieważ gęstość w międzygwiazdowych obłokach gazu jest o wiele rzędów wielkości niższa niż w najlepszych próżniach laboratoryjnych dostępnych na Ziemi, stany Rydberga mogą utrzymywać się przez długi czas bez zniszczenia przez kolizje.
Silnie współdziałające systemy
Atomy Rydberga ze względu na swoje duże rozmiary mogą wykazywać bardzo duże elektryczne momenty dipolowe . Obliczenia wykorzystujące teorię zaburzeń pokazują, że prowadzi to do silnych interakcji między dwoma bliskimi atomami Rydberga. Spójna kontrola tych interakcji w połączeniu z ich stosunkowo długą żywotnością sprawia, że są one odpowiednim kandydatem do realizacji komputera kwantowego . W 2010 r. Bramki dwukubitowe zostały osiągnięte eksperymentalnie. Silnie oddziałujące atomy Rydberga mają również kwantowo-krytyczne zachowanie, co sprawia, że ich samodzielne badanie jest interesujące.
Aktualne kierunki badań
Od 2000 roku badania atomów Rydberga obejmują zasadniczo trzy kierunki: wykrywanie, optykę kwantową, obliczenia kwantowe i symulację kwantową . Wysokie momenty dipolowe elektryczne między stanami atomowymi Rydberga są wykorzystywane do wykrywania i obrazowania częstotliwości radiowych i terahercowych , w tym do pomiarów bez wyburzeń pojedynczych fotonów mikrofalowych. Zastosowano przezroczystość indukowaną elektromagnetycznie w połączeniu z silnymi oddziaływaniami między dwoma atomami wzbudzonymi w stanie Rydberga, aby uzyskać ośrodek, który wykazuje silnie nieliniowe zachowanie na poziomie pojedynczych fotonów optycznych. Dostrajalna interakcja między stanami Rydberga umożliwiła również pierwsze eksperymenty z symulacją kwantową.
W październiku 2018 roku United States Army Research Laboratory publicznie omówiło wysiłki mające na celu opracowanie super szerokopasmowego odbiornika radiowego wykorzystującego atomy Rydberga. W marcu 2020 r. Laboratorium ogłosiło, że jego naukowcy przeanalizowali czułość czujnika Rydberga na oscylujące pola elektryczne w ogromnym zakresie częstotliwości - od 0 do 10 ^ 12 Hz (widmo do długości fali 0,3 mm). Czujnik Rydberga może niezawodnie wykrywać sygnały w całym widmie i korzystnie porównać go z innymi uznanymi technologiami czujników pola elektrycznego, takimi jak kryształy elektrooptyczne i pasywna elektronika sprzężona z anteną dipolową.
Klasyczna symulacja

Prosty potencjał 1 / r skutkuje zamkniętą eliptyczną orbitą Keplera . W obecności zewnętrznego pola elektrycznego atomy Rydberga mogą uzyskiwać bardzo duże momenty dipolowe, co czyni je wyjątkowo podatnymi na zakłócenia pola. Rysunek 7 pokazuje, jak zastosowanie zewnętrznego pola elektrycznego (znanego w fizyce atomowej jako pole Starka ) zmienia geometrię potencjału, radykalnie zmieniając zachowanie elektronu. Potencjał kulombowski nie przykłada żadnego momentu obrotowego, ponieważ siła jest zawsze przeciwrównoległa do wektora położenia (zawsze skierowana wzdłuż linii biegnącej między elektronem a jądrem):
- ,
- .
Przy zastosowaniu statycznego pola elektrycznego elektron odczuwa stale zmieniający się moment obrotowy. Wynikowa trajektoria staje się stopniowo coraz bardziej zniekształcona w czasie, ostatecznie przechodząc przez pełny zakres momentu pędu od L = L MAX , do linii prostej L = 0, do początkowej orbity w przeciwnym kierunku L = - L MAX .
Okres oscylacji momentu pędu (czas do zakończenia trajektorii na ryc. 8 ), prawie dokładnie odpowiada okresowi przewidzianemu przez mechanikę kwantową, w którym funkcja falowa powróci do stanu początkowego, demonstrując klasyczną naturę atomu Rydberga.