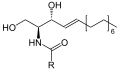
Sfingomielina - Sphingomyelin

Sfingomielina ( SPH , ˌsfɪŋɡoˈmaɪəlɪn) jest rodzajem sfingolipidu znajdującego się w błonach komórek zwierzęcych , zwłaszcza w błoniastej osłonce mielinowej otaczającej niektóre aksony komórek nerwowych . Zwykle składa się z fosfocholiny i ceramidu lub grupy czołowej fosfoetanoloaminy ; dlatego sfingomieliny można również sklasyfikować jako sfingofosfolipidy. U ludzi SPH stanowi ~85% wszystkich sfingolipidów i zazwyczaj stanowi 10-20% molowych lipidów błony komórkowej .
Sfingomielina została po raz pierwszy wyizolowana przez niemieckiego chemika Johanna LW Thudicum w latach 80. XIX wieku. Struktura sfingomieliny została po raz pierwszy opisana w 1927 roku jako N-acylo-sfingozyno-1-fosforylocholina. Zawartość sfingomieliny u ssaków waha się od 2 do 15% w większości tkanek, przy czym wyższe stężenia znajdują się w tkankach nerwowych, krwinkach czerwonych i soczewkach oka. Sfingomielina pełni w komórce istotne role strukturalne i funkcjonalne. Jest składnikiem błony plazmatycznej i uczestniczy w wielu szlakach sygnałowych. Metabolizm sfingomieliny tworzy wiele produktów, które odgrywają znaczącą rolę w komórce.
Charakterystyka fizyczna
Kompozycja
Sfingomielina składa się z fosfocholiny , sfingozyny i kwasu tłuszczowego . Jest jednym z nielicznych fosfolipidów błonowych, które nie są syntetyzowane z glicerolu. Sfingozynę i kwas tłuszczowy można wspólnie zaklasyfikować jako ceramid. Kompozycja ta pozwala sfingomieliny odgrywać znaczącą rolę w szlakach sygnalizacyjnych: degradacja i synteza sfingomieliny wytwarzają ważne wtórne przekaźniki do przekazywania sygnału.
Sfingomielina pozyskiwana z naturalnych źródeł, takich jak jaja czy mózg bydlęcy, zawiera kwasy tłuszczowe o różnej długości łańcucha. Sfingomielina o ustalonej długości łańcucha, taka jak palmitoilosfingomielina z nasyconym łańcuchem 16-acylowym, jest dostępna w handlu.
Nieruchomości
Idealnie, cząsteczki sfingomieliny mają kształt cylindra, jednak wiele cząsteczek sfingomieliny ma znaczne niedopasowanie łańcuchów (długości dwóch hydrofobowych łańcuchów są znacząco różne). Hydrofobowe łańcuchy sfingomieliny wydają się być znacznie bardziej nasycone niż inne fosfolipidy. Temperatura głównej fazy przejściowej sfingomielin jest również wyższa w porównaniu z temperaturą przejścia fazowego podobnych fosfolipidów, w pobliżu 37°C. Może to wprowadzić boczną niejednorodność w błonie, generując domeny w dwuwarstwie błony.
Sfingomielina podlega znaczącym interakcjom z cholesterolem. Cholesterol ma zdolność eliminowania przejścia z fazy ciekłej do stałej w fosfolipidach. Ze względu na to, że temperatura przejścia sfingomieliny mieści się w fizjologicznych zakresach temperatur, cholesterol może odgrywać istotną rolę w fazie sfingomieliny. Sfingomieliny są również bardziej podatne na międzycząsteczkowe wiązania wodorowe niż inne fosfolipidy.
Lokalizacja
Sfingomielina jest syntetyzowana w retikulum endoplazmatycznym (ER), gdzie występuje w niewielkich ilościach, oraz w trans Golgiego. Jest wzbogacony na błonie komórkowej o większym stężeniu na zewnętrznej niż wewnętrznej ulotce. Kompleks Golgiego stanowi produkt pośredni między ER a błoną plazmatyczną, z nieco wyższymi stężeniami w kierunku strony trans.
Metabolizm
Synteza
Synteza sfingomieliny obejmuje enzymatyczne przeniesienie fosfocholiny z fosfatydylocholiny do ceramidu. Pierwszy etap syntezy sfingomieliny obejmuje kondensację L-seryny i palmitoilo-CoA . Reakcja ta jest katalizowana przez palmitoilotransferazę serynową . Produkt tej reakcji jest redukowany, dając dihydrosfingozynę. Dihydrosfingozyna podlega N-acylowaniu, a następnie desaturacji, z wytworzeniem ceramidu. Każda z tych reakcji zachodzi na cytozolowej powierzchni retikulum endoplazmatycznego . Ceramid jest transportowany do aparatu Golgiego, gdzie może zostać przekształcony w sfingomielinę. Syntaza sfingomieliny odpowiada za produkcję sfingomieliny z ceramidu. Diacyloglicerol jest wytwarzany jako produkt uboczny podczas przenoszenia fosfocholiny.
Degradacja
Rozpad sfingomieliny jest odpowiedzialny za inicjowanie wielu uniwersalnych szlaków sygnałowych. Jest hydrolizowany przez sfingomielinazy (fosfolipazy specyficzne dla sfingomieliny typu C). Grupa głowy fosfocholiny jest uwalniana do środowiska wodnego, podczas gdy ceramid dyfunduje przez membranę.
Funkcjonować
Membrany
Błoniastą mieliny osłona , która otacza i elektrycznie izoluje wiele komórek nerwowych aksonów jest szczególnie bogaty w sfingomieliny, co sugeruje jego rolę izolatora włókien nerwowych. Błona innych komórek jest również bogaty w sfingomieliny, choć jest to w dużej mierze można znaleźć w egzoplazmatycznych ulotce błony komórkowej. Istnieją jednak pewne dowody na to, że w wewnętrznym płatku błony może również znajdować się pula sfingomieliny. Ponadto stwierdzono, że obojętna sfingomielinaza-2 – enzym rozkładający sfingomielinę na ceramid – jest zlokalizowana wyłącznie w wewnętrznym płatku, co dodatkowo sugeruje, że może tam być obecna sfingomielina.
Transdukcja sygnału
Funkcja sfingomieliny pozostawała niejasna, dopóki nie odkryto jej roli w transdukcji sygnału . Odkryto, że sfingomielina odgrywa znaczącą rolę w szlakach sygnalizacji komórkowej. Synteza sfingomieliny w błonie komórkowej przez syntazę sfingomieliny 2 wytwarza diacyloglicerol, który jest rozpuszczalnym w lipidach drugim przekaźnikiem, który może przechodzić wzdłuż kaskady sygnału. Ponadto degradacja sfingomieliny może wytwarzać ceramid, który bierze udział w apoptotycznej ścieżce sygnalizacyjnej.
Apoptoza
Stwierdzono, że sfingomielina odgrywa rolę w apoptozie komórek poprzez hydrolizę do ceramidu. Badania przeprowadzone pod koniec lat 90. wykazały, że ceramid był wytwarzany w różnych warunkach prowadzących do apoptozy. Następnie wysunięto hipotezę, że hydroliza sfingomieliny i sygnalizacja ceramidowa były niezbędne do podjęcia decyzji o śmierci komórki. Na początku XXI wieku pojawiły się nowe badania, które zdefiniowały nową rolę hydrolizy sfingomieliny w apoptozie, określając nie tylko, kiedy komórka umiera, ale także w jaki sposób. Po dalszych eksperymentach wykazano, że jeśli hydroliza sfingomieliny zachodzi na wystarczająco wczesnym etapie szlaku, produkcja ceramidu może wpływać na szybkość i formę śmierci komórek lub działać w celu uwolnienia blokad w dalszych zdarzeniach.
Tratwy lipidowe
Sfingomielina, jak również inne sfingolipidy, są związane z mikrodomenami lipidowymi w błonie komórkowej znanymi jako tratwy lipidowe . Tratwy lipidowe charakteryzują się tym, że cząsteczki lipidowe znajdują się w fazie uporządkowanej lipidowo, oferując większą strukturę i sztywność w porównaniu z resztą błony komórkowej. W tratwach łańcuchy acylowe mają niewielki ruch łańcuchowy, ale cząsteczki mają wysoką ruchliwość boczną. Ta kolejność jest częściowo spowodowana wyższą temperaturą przejścia sfingolipidów, a także interakcjami tych lipidów z cholesterolem. Cholesterol jest stosunkowo małą, niepolarną cząsteczką, która może wypełnić przestrzeń między sfingolipidami, która jest wynikiem dużych łańcuchów acylowych. Uważa się, że tratwy lipidowe biorą udział w wielu procesach komórkowych, takich jak sortowanie i transport błonowy, transdukcja sygnału i polaryzacja komórek. Nadmiar sfingomieliny w tratwach lipidowych może prowadzić do insulinooporności .
Ze względu na specyficzne typy lipidów w tych mikrodomenach, tratwy lipidowe mogą gromadzić pewne rodzaje powiązanych z nimi białek, zwiększając w ten sposób specjalne funkcje, które posiadają. Spekuluje się, że tratwy lipidowe biorą udział w kaskadzie apoptozy komórek.
Nieprawidłowości i związane z nimi choroby
Sfingomielina może się kumulować w rzadkiej dziedzicznej chorobie Niemanna-Picka typu A i B . Jest to choroba dziedziczona genetycznie spowodowana niedoborem enzymu lizosomalnego kwaśnej sfingomielinazy , który powoduje gromadzenie się sfingomieliny w śledzionie , wątrobie , płucach , szpik kostny i mózg , powodując nieodwracalne uszkodzenia neurologiczne. Spośród dwóch typów obejmujących sfingomielinazę , typ A występuje u niemowląt. Charakteryzuje się żółtaczką , powiększeniem wątroby i głębokim uszkodzeniem mózgu . Dzieci z tym typem rzadko żyją dłużej niż 18 miesięcy. Typ B obejmuje powiększoną wątrobę i śledzionę, która zwykle pojawia się przed nastolatkiem. Mózg nie jest dotknięty. Większość pacjentów ma <1% normalnego poziomu enzymu w porównaniu do normalnego poziomu. Białko hemolityczne, lisenina, może być wartościową sondą do wykrywania sfingomieliny w komórkach pacjentów z Niemann-Pick A.
W wyniku choroby autoimmunologicznej stwardnienia rozsianego (MS), osłonka mielinowa komórek neuronalnych w mózgu i rdzeniu kręgowym ulega degradacji, co powoduje utratę zdolności transdukcji sygnału. Pacjenci ze stwardnieniem rozsianym wykazują podwyższenie poziomu niektórych cytokin w płynie mózgowo-rdzeniowym, szczególnie czynnika martwicy nowotworu alfa . To aktywuje sfingomielinazę, enzym, który katalizuje hydrolizę sfingomieliny do ceramidu; Zaobserwowano aktywność sfingomielinazy w połączeniu z apoptozą komórek.
Nadmiar sfingomieliny w błonie krwinek czerwonych (jak w abetalipoproteinemii ) powoduje nadmierne gromadzenie lipidów w zewnętrznym płatku błony plazmatycznej krwinek czerwonych . Powoduje to nieprawidłowe ukształtowanie czerwonych krwinek zwanych akantocytami .
Dodatkowe obrazy
Model kulowo-kijowy sfingomieliny
Szkieletowa formuła sfingomieliny
Bibliografia
Zewnętrzne linki
- Sfingomieliny w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)