Transaminacja - Transamination
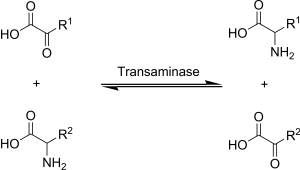
Transamination , reakcja chemiczna, która przenosi grupę aminową do kwasu ketonowego w celu utworzenia nowych aminokwasów. Szlak ten odpowiada za deaminację większości aminokwasów. Jest to jeden z głównych szlaków degradacji, który przekształca aminokwasy egzogenne w aminokwasy nieistotne (aminokwasy, które organizm może syntetyzować de novo).
Transaminacja w biochemii jest realizowana przez enzymy zwane transaminazami lub aminotransferazami. α-ketoglutaran działa jako dominujący akceptor grup aminowych i wytwarza glutaminian jako nowy aminokwas.
- Aminokwas + α-ketoglutaran ↔ α-ketokwas + glutaminian
Z kolei grupa aminowa glutaminianu jest przenoszona do szczawiooctanu w drugiej reakcji transaminacji dając asparaginian.
- Glutaminian + szczawiooctan (α-ketoglutaran + asparaginian)
Mechanizm akcji
Transaminacja katalizowana przez aminotransferazę przebiega dwuetapowo. W pierwszym etapie grupa α-aminowa aminokwasu jest przenoszona do enzymu, wytwarzając odpowiedni α-ketokwas i aminowany enzym. W drugim etapie grupa aminowa zostaje przeniesiona do akceptora ketokwasów, tworząc produkt aminokwasowy podczas regeneracji enzymu. Chiralności aminokwasu jest ustalana podczas transaminowania. W celu przeprowadzenia reakcji do wykonania, wymagają udziału aminotransferazy zawierający aldehyd koenzymu, pirydoksal-5'-fosforan (PLP) , pochodną pirydoksyny ( witamina B 6 ). Grupa aminowa jest przystosowana przez konwersję tego koenzymu do pirydoksaminy-5'-fosforanu (PMP). PLP jest kowalencyjnie przyłączony do enzymu przez wiązanie zasady Schiffa utworzone przez kondensację jego grupy aldehydowej z grupą ε-aminową enzymatycznej reszty Lys . W centrum aktywności koenzymu znajduje się zasada Schiffa, która jest sprzężona z enzymami pierścienia pirydyniowego.
-
Produkt reakcji transaminacji zależy od dostępności α-ketokwasów. Produktami tymi są zazwyczaj alanina , asparaginian lub glutaminian , ponieważ odpowiadające im alfa-ketokwasy powstają w wyniku metabolizmu paliw. Będąc głównym szlakiem degradacji aminokwasów, lizyna , prolina i treonina są jedynymi trzema aminokwasami, które nie zawsze ulegają transaminacji i raczej wykorzystują odpowiednią dehydrogenazę.
 Mechanizm Ping Pong Bi Bi transaminacji katalizowanej przez enzymy zależne od PLP. Reakcja aminotransferazy przebiega w dwóch etapach składających się z trzech etapów: transiminacji, tautomeryzacji i hydrolizy. W pierwszym etapie grupa alfa-aminowa aminokwasu jest przenoszona do PLP dając alfa ketokwas i PMP. W drugim etapie reakcji, w którym grupa aminowa PMP jest przenoszona do innego alfa Ketokwasu, aby uzyskać nowy alfa aminokwas i PLP.
Mechanizm Ping Pong Bi Bi transaminacji katalizowanej przez enzymy zależne od PLP. Reakcja aminotransferazy przebiega w dwóch etapach składających się z trzech etapów: transiminacji, tautomeryzacji i hydrolizy. W pierwszym etapie grupa alfa-aminowa aminokwasu jest przenoszona do PLP dając alfa ketokwas i PMP. W drugim etapie reakcji, w którym grupa aminowa PMP jest przenoszona do innego alfa Ketokwasu, aby uzyskać nowy alfa aminokwas i PLP. - Mechanizm alternatywny
- Drugi typ reakcji transaminacji można opisać jako podstawienie nukleofilowe jednego anionu aminy lub amidu na soli aminy lub amonu. Na przykład atak pierwszorzędowej aminy przez pierwszorzędowy anion amidu można wykorzystać do wytworzenia drugorzędowych amin:
- RNH 2 + R'NH − → RR'NH + NH 2 −
- Symetryczne amin drugorzędowych, można wytwarzać za pomocą niklu Raney'a (2RNH 2 → R 2 NH + NH 3 ). I wreszcie czwartorzędowe sole amoniowe można dealkilować przy użyciu etanoloaminy:
- R 4 N + + NH 2 CH 2 CH 2 OH → R 3 N + RN + H 2 CH 2 CH 2 OH
- Aminonaftaleny również ulegają transaminacji. [2]
Rodzaje aminotransferazy
W transaminacji pośredniczy kilka różnych enzymów aminotransferaz. Mogą być one specyficzne dla poszczególnych aminokwasów lub mogą przetwarzać grupę chemicznie podobnych. To ostatnie dotyczy grupy aminokwasów rozgałęzionych, do której należą leucyna, izoleucyna i walina. Dwa powszechne typy aminotransferaz to aminotransferaza alaninowa (ALT) i aminotransferaza asparaginianowa (AST).
Bibliografia
• Smith, MB i March, J. Zaawansowana chemia organiczna: reakcje, mechanizmy i struktura, wyd. Wiley, 2001, s. 503. ISBN 0-471-58589-0 • Gerald Booth „Pochodne naftalenu” w Encyklopedii Chemii Przemysłowej Ullmanna, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_009
Voet i Voet. „Biochemia” Wydanie czwarte
