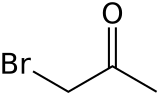
bromoaceton - Bromoacetone
| |
| |
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
1-bromopropan-2-onu | |
| Inne nazwy
Bromoaceton
1-bromo-2-propanonu α-bromoaceton acetonylowa bromek acetylu bromek metylu bromometylo keton Monobromoacetone Martonite BA UN 1569 | |
| identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.009.027 |
|
pubchem CID
|
|
| Numer RTECS | UC0525000 |
| |
| |
| Nieruchomości | |
| C 3 H 5 Br O | |
| Masa cząsteczkowa | 136,98 g • mola -1 |
| Wygląd | bezbarwny lachrymator |
| Gęstość | 1,634 g / cm 3 |
| Temperatura topnienia | -36,5 ° C (-33,7 ° C; 236,7 K) |
| Temperatura wrzenia | 137 ° C (279 ° K, 410 K) |
| Ciśnienie pary | 1,1 kPa (20 ° C) |
| zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | MSDS w MOP |
| Temperatura zapłonu | 51,1 ° C (124,0 ° C; 324,2 K) |
|
Jeśli nie zaznaczono inaczej, dane dla materiałów w ich warunków standardowych (25 ° C [77 ° F], 100 kPa). | |
|
| |
| referencje Infobox | |
Bromoaceton jest związkiem organicznym o wzorze C H 3 C O CH 2 Br . Bezbarwny ciecz jest środek łzawienie . Jest prekursorem innych związków organicznych .
Występowanie
Bromoaceton występuje naturalnie (mniej niż 1%) w olejku z wodorostów ( taxiformis Asparagopsis ) z sąsiedztwie Hawajów .
Synteza
Bromoaceton jest dostępny w handlu, czasami stabilizowanego tlenku magnezu . Po raz pierwszy została opisana w 19 wieku, nadana N. Sokolowsky.
Bromoaceton wytwarza się przez połączenie bromu i aceton za pomocą kwasu katalitycznego. Podobnie jak w przypadku wszystkich ketonów, aceton enolizes w obecności kwasów lub zasad. Alfa węgla przechodzi następnie elektrofilowe podstawienie bromem. Głównym problemem w tej metodzie jest nadmiernie bromowania, powodując di- i tribrominated produktów. Jeśli obecna jest zasada, bromoform uzyskuje się natomiast przez reakcję haloform .
Aplikacje
Był on używany w I wojnie światowej jako broń chemiczną o nazwie BA przez brytyjskich i B-Stoff (biały krzyż) przez Niemców. Ze względu na swoją toksyczność, jest przestarzały jako środek kontroli zamieszek i nie jest już używany. Bromoaceton jest uniwersalnym reagent w syntezie organicznej . Jest, na przykład, prekursor pirydynie .
Zobacz też
- Korzystanie z trującego gazu w I wojnie światowej
- chloroaceton
- Fluoroacetone
- Iodoacetone
- Thioacetone
Referencje
- ^ Merck Index , wydanie 11, 1389
- ^ Burreson BJ; Moore, RE; Roller, PP (1976). „Lotne związki halogenowe w algi taxiformis Asparagopsis (Rhodophyta)”. Journal of Agricultural i Chemii Żywności . 24 (4): 856-861. doi : 10,1021 / jf60206a040 .
- ^ Wagner, G. (1876). "Sitzung der russischen chemischen Gesellschaft am 7./19. Październik 1876" . Berichte der Deutschen Gesellschaft Chemischen . 9 (2): 1687/88. doi : 10,1002 / cber.187600902196 .
- ^ Levene'a, PA (1930). „Bromoaceton” . Syntezach organicznych . 10 : 12.; Zbiorcze objętość , 2 , str. 88
- ^ Reusch W. (05/05/2013). „Karbonylowych Reaktywność” . Wirtualny Podręcznik Chemii Organicznej . Michigan State University.
- ^ Levene'a, Pensylwania; Walti, A. (1930). "Acetol" . Syntezach organicznych . 10 : 1.; Zbiorcze objętość , 2 , str. 5

