Cuprate - Cuprate
Miedzian luźno odnosi się do materiału, który może być postrzegany jako zawierający anionowe kompleksy miedzi . Przykłady obejmują tetrachloridocuprate ([CuCl 4 ] 2 ), przy czym nadprzewodnik arz 2 Cu 3 O 7 , a organocuprates (np dimethylcuprate [Cu (CH 3 ) 2 ] - ). Termin cuprates pochodzi od łacińskiego słowa oznaczającego miedź, cuprum . Termin ten jest używany głównie w trzech kontekstach: materiały tlenkowe , anionowe kompleksy koordynacyjne i anionowe związki organiczne miedzi .
Tlenki
Jednym z najprostszych miedzianów na bazie tlenków jest tlenek miedzi(III) KCuO 2 . Gatunek ten można postrzegać jako sól K + polianionu [ CuO−
2] N . Jako taki materiał jest klasyfikowany jako miedzian. Ta ciemnoniebieska diamagnetyczna substancja stała jest wytwarzana przez ogrzewanie nadtlenku potasu i tlenku miedzi(II) w atmosferze tlenu:
- K 2 O 2 + 2 CuO → 2 KCuO 2
Kompleksy koordynacyjne
Miedź tworzy wiele anionowych kompleksów koordynacyjnych z ujemnie naładowanymi ligandami, takimi jak cyjanek, wodorotlenek, halogenki, a także alkile i aryle.
Miedź(I)
Miedzianów zawierający miedź (I) na ogół być bezbarwne, co odzwierciedla ich d 10 konfiguracji. Struktury wahają się od liniowych 2-współrzędnych, trygonalnych planarnych i czworościennych. Przykłady obejmują dichloro i trichloromiedzian, tj. liniowy [CuCl 2 ] − i trygonalny planarny [CuCl 3 ] 2- . Cyjanek daje analogiczne kompleksy, ale także trianionowy tetracyjanomiedzian(I), [Cu(CN) 4 ] 3- . Dicyjanomiedzian(I) występuje zarówno w motywach molekularnych, jak i polimerycznych, w zależności od przeciwkationu.
Miedź(II)
Do chloromiedzian należą trichloromiedzian (II) [CuCl 3 ] − , który jest dimerem, kwadratowo-płaski tetrachloromiedzian (II) [CuCl 4 ] 2- i pentachloromiedzian (II) [CuCl 5 ] 3- . Kompleksy 3-koordynacyjne chloromiedzian(II) są rzadkie.
Kompleksy tetrachloromiedzianowe (II) mają tendencję do przyjmowania spłaszczonej geometrii czworościennej z pomarańczowymi kolorami.
Tetrahydroksymiedzian sodu (Na 2 [Cu(OH) 4 ]) jest przykładem homoleptycznego kompleksu wodorotlenkowego (wszystkie ligandy są takie same).
- Cu(OH) 2 + 2 NaOH → Na 2 Cu(OH) 4
Miedź(III) i miedź(IV)
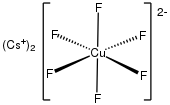
Hexafluorocuprate (III) [CUF 6 ] 3- i hexafluorocuprate (IV) [CUF 6 ] 2- rzadkie przykłady miedzi (III), miedź (IV). Są silnymi utleniaczami .
organiczne miedziany
Miedziany odgrywają rolę w syntezie organicznej . Są to niezmiennie Cu(I), chociaż w niektórych mechanizmach są przywoływane pośrednie Cu(II) lub nawet Cu(III). Miedzianów organiczne mają często wyidealizowany Cur wzorach [ 2 ] - i [Cur 3 ] 2- , w której R oznacza alkil lub aryl. Odczynniki te znajdują zastosowanie jako nukleofilowe odczynniki alkilujące .