Daurycyna - Dauricine
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
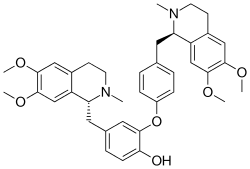
(1 1 R , 7 1 R ) -1 6 1 7 7 6 7 7 -Tetramethoxy 1 2 7 2 -dimetylo-1 1 , 1 2 , 1 3 , 1 4 7 1 7 2 , 7 3 ,7 4 -oktahydro-4-oksa-1,7(1)-diizochinolina-3(1,3),5(1,4)-dibenzenaheptafan-3 4- ol |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.208.622 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 38 H 44 N 2 O 6 | |
| Masa cząsteczkowa | 624,778 g·mol -1 |
| Gęstość | 1,186 g/ml |
| Temperatura topnienia | 115 °C |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
| Referencje do infoboksu | |
Daurycyna jest metabolitem roślinnym , chemicznie zaliczanym do fenolu , eteru aromatycznego i alkaloidu izochinolinowego . Została wyizolowana z azjatyckiej winorośli Menispermum dauricum , powszechnie znanej jako azjatyckie nasiona księżyca i północnoamerykańskiej winorośli Menispermum canadense , powszechnie znanej jako kanadyjskie nasiona księżyca. Naukowcy Tetsuji Kametani i Keiichiro Fukumoto z Japonii zostali uznani za pierwszych, którzy zsyntetyzowali daurycynę w 1964 roku, wykorzystując w tym celu zarówno reakcję Arndta-Eisterta, jak i reakcję Bischlera-Napieralskiego . Daurycynę badano in vitro pod kątem jej potencjału hamowania wzrostu komórek rakowych i blokowania przezbłonowych prądów jonów Na + , K + i Ca2 + w sercu .
Bibliografia
- ^ "CHEBI: 4331 - daurycyna" . CHEBI . Źródło 30 maja 2015 .
- ^ Kametani, Tetsuji; Fukumoto, Keiichiro (1964). „Całkowita synteza (±)-daurycyny”. Czworościan litery . 5 (38): 2771–2775. doi : 10.1016/S0040-4039(00)71728-X .
- ^ Manske, RHF (1967). Alkaloidy: chemia i fizjologia V9 . Nowy Jork: prasa akademicka. str. 141. Numer ISBN 9780080865331. Źródło 30 maja 2015 .
- ^ Yang, Zhengfeng; Li, Chenghai; Wang, Xiu; Zhai, Chunyan; Yi, Zhengfang; Wang, Lei; Liu, Bisheng; Du, Bing; Wu, Huihui; Guo, Xizhi; Liu, Mingjao; Li, Dali; Luo, Jian (2010). „Daurycyna indukuje apoptozę, hamuje proliferację i inwazję poprzez hamowanie szlaku sygnałowego NF-kappaB w komórkach raka okrężnicy”. J. Komórka. Fizjol . 225 (1): 266–75. doi : 10.1002/jcp.22261 . PMID 20509140 . S2CID 5501319 .
- ^ Jin, Hua; Dai, Jieyu; Chen, Xiaoyan; Liu, Jia; Zhong, Dafang; Gu, Yansong; Zheng, Jiang (2009). „Toksyczność płucna i aktywacja metaboliczna daurycyny u myszy CD-1”. Czasopismo Farmakologii i Terapii Eksperymentalnej . 332 (3): 738–46. doi : 10.1124/jpet.109.162297 . PMID 20008063 . S2CID 21824941 .
- ^ Tang, Xu-dong; Zhou, Xin; Zhou, Ke-yuan (2009). „Daurycyna hamuje akumulację białka indukowanego przez czynnik 1alfa indukowanego przez insulinopodobny czynnik wzrostu I oraz ekspresję czynnika wzrostu śródbłonka naczyniowego w ludzkich komórkach raka piersi” . Acta Pharmacol grzech . 30 (5): 605–16. doi : 10.1038/aps.2009.8 . PMC 4002832 . PMID 19349962 .
- ^ Wang, czerwiec; Li, Yuan; Zu, Xiong-Bing; Chen, Min-Feng; Qi, Li (2012). „Daurycyna może hamować aktywność proliferacji komórek nowotworowych dróg moczowych” . Azjatycki Pac J Trop Med . 5 (12): 973-76. doi : 10.1016/S1995-7645(12)60185-0 . PMID 23199717 .
- ^ Qian, JQ (2002). „Skutki farmakologiczne sercowo-naczyniowej pochodnych alkaloidów bisbenzyloizochinolinowych”. Acta Pharmacol grzech . 23 (12): 1086–92. PMID 12466045 .
