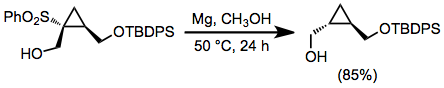Reakcje desulfonylacji - Desulfonylation reactions
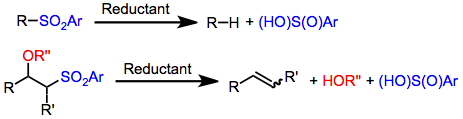
Reakcje desulfonylowania to reakcje chemiczne prowadzące do usunięcia grupy sulfonylowej ze związków organicznych . Ponieważ sulfonylowa grupa funkcyjna wycofuje elektrony , metody rozszczepiania wiązań siarkowo- węglowych w sulfonach mają zwykle charakter redukcyjny. Olefinowanie lub zastąpienie wodorem można przeprowadzić stosując metody redukcyjnej desulfonylacji.
Wprowadzenie
Sulfonylową grupą funkcyjną (R (O) 2 R ") stały się ważnym odciągającą elektrony grupę nowoczesnej chemii organicznej. α-sulfonylo karboaniony mogą być wykorzystane jako nukleofile w reakcji alkilowania typu Michaela dodatków i innych procesów. Grupy sulfonylowe są często usuwane po spełnieniu ich funkcji syntetycznej. W obecności pewnych środków redukujących jedno z wiązań siarka-węgiel z grupy sulfonylowej jest rozszczepiane, co prowadzi do produktów organicznych wolnych od siarki. W zależności od rodzaju substratu i warunków reakcji, alkilosulfony dają albo odpowiednie alkany, albo olefiny ( olefinacja Julii ). Redukcyjne desulfonylation się zwykle z aktywnych metali lub soli ( amalgamat sodu , glinu amalgamatu , magnezu , samaru (II), jodek ), wodorkami cyny ( wodorek tributylocyny ), bądź kompleksy metali przejściowych z czynnikami lub nukleofile (PdCl zmniejszenie 2 (dppp) / LiHBEt 3 , Pd (PPh 3 ) 4 / LiHBEt 3 , Pd (PPh 3 ) 4 / NaHC (CO 2 Et) 2 ). Sulfony alkilowe, alkenylowe i allilowe można redukować przy użyciu jednej lub więcej z tych metod.
(1)
Mechanizm i stereochemia
Redukcyjna desulfonylacja
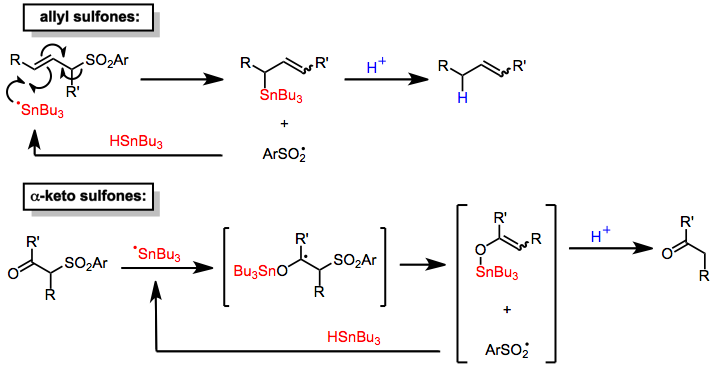
Reakcje desulfonylacji redukcyjnej prowadzą do zastąpienia wiązania węgiel-siarka w grupie sulfonylowej wiązaniem węgiel- wodór. Ponieważ grupa sulfonylowa jest z definicji przyłączona do dwóch atomów węgla, możliwa jest jednak redukcja do dwóch zestawów produktów. Badania mechanistyczne redukcji z użyciem amalgamatów metali jako środka redukującego sugerują, że po przeniesieniu elektronu na sulfon następuje fragmentacja do anionu siarczanowego i bardziej stabilny rodnik organiczny. Następuje wtedy natychmiastowa redukcja rodnika i protonowanie, w wyniku czego otrzymuje się wolny od siarki produkt pochodzący z bardziej stabilnego rodnika. Zatem wiązania S-alkilowe rozszczepia się korzystnie względem wiązań S-arylowych lub S-alkenylowych.
-
( 2 )
Jodek samaru (II) może być stosowany do redukcyjnego rozszczepiania α-ketonosulfonów; w obecności heksametylofosforamidu (HMPA), SmI 2 jest w stanie spowodować redukcyjną eliminację α-funkcjonalizowanych sulfonów (patrz równanie ( 11 ) poniżej).
-
( 3 )
Wodorki cyny redukują α-keto i allilosulfony. Mechanizmy tych procesów obejmują dodanie do substratu rodnika z centrum cyny, a następnie eliminację rodnika sulfinylowego, który usuwa wodór z cząsteczki wodorku cyny w celu propagacji łańcucha rodników. Protonowanie tak utworzonych związków pośrednich cynoorganicznych (przez kwas sulfinowy wytworzony in situ ) prowadzi do zredukowania produktów. Dodanie stechiometrycznej ilości źródła protonów pozwala na zastosowanie wodorku cyny w ilościach katalitycznych. Chociaż desulfonylacje allilowych sulfonów są selektywne względem miejsca (dostarczając tylko produkty transpozycji allilowej), nie są one stereoselektywne i dają mieszaniny izomerów wiązań podwójnych . Mechanizm desulfonylacji α-ketonosulfonów jest podobny.
-
( 4 )
Redukcyjne desulfonylacje za pośrednictwem metali przejściowych polegają na wytwarzaniu pośredniego kompleksu π-allilowego, który ulega nukleofilowemu atakowi przez wodorek lub inny nukleofil, dając zredukowane produkty. Atak nukleofilowy generalnie występuje w mniej podstawionej pozycji ugrupowania π-allilowego, chociaż selektywność miejsc silnie zależy od substratu i warunków reakcji. Kompleksy palladu (0) są najczęściej stosowanymi prekatalizatorami.
-
( 5 )
Eliminacja redukcyjna
Sulfony z dobrą grupą opuszczającą w pozycji β mogą podlegać eliminacji redukcyjnej w warunkach desulfonylowania z wytworzeniem alkenów . Proces ten jest kluczowym etapem olefinacji Julii , w wyniku której powstają alkeny poprzez dodanie a-sulfonylokarboanionu do aldehydu, a następnie eliminację redukcyjną. Amalgamat sodu lub jodek samaru (II) / HMPA mogą być użyte do konwersji β-sulfonyloksy lub β- acyloksy- sulfonów do odpowiednich alkenów. Kluczowym mechanistycznym etapem tego procesu jest eliminacja anionowego lub metaloorganicznego związku pośredniego w celu wytworzenia alkenu.
(6)

Zastosowanie amalgamatu sodu, który sprzyja tworzeniu się zasadniczo wolnych anionów alkilowych, prowadzi do ( E ) alkenów o niezwykle wysokiej selektywności. Jodek samaru (II) również wytwarza głównie ( E ) alken, ale z mniejszą selektywnością.
Zakres i ograniczenia
Stosując odpowiedni odczynnik i warunki, można zredukować alkilowe, alkenylowe, allilowe i α-ketosulfony z dobrą wydajnością i wysoką stereoselektywnością (w stosownych przypadkach). Odpowiednie warunki redukcji tych klas sulfonów omówiono poniżej.
Sulfony alkilowe można redukować sodem lub litem w ciekłym amoniaku ; jednakże silnie podstawowe warunki tych redukcji rozpuszczających się metali stanowią istotną wadę. W rozpuszczalnikach alkoholowych można stosować metaliczny magnez i katalityczną ilość chlorku rtęci (II). Warunki te nie mają wpływu na wiele różnych grup funkcyjnych, w tym wiele, które ulegają przekształceniu w wyniku redukcji redukcji metali. Redukcyjne desulfonylowanie tymi odczynnikami nie zachodzi w reakcjach β-hydroksysulfonów ze względu na słabą zdolność grupy opuszczającej grupy hydroksylowej.
-
( 7 )
Istotną kwestią związaną z redukcją allilowych sulfonów jest transpozycja allilowego wiązania podwójnego, która występuje w różnych ilościach podczas redukcji przez amalgamaty metali. i wodorki cyny Katalizowane palladem redukcyjne desulfonylacje allilowych sulfonów nie mają tego problemu i dają allilowe sulfony o wysokim miejscu i stereoselektywności.
-
( 8 )
Amalgamat glinu (Al / Hg) może być stosowany do chemoselektywnej redukcji α-sulfonylowanych grup karbonylowych. Pochodne kwasu karboksylowego , acetale, tioacetale , aminy, alkohole i izolowane wiązania podwójne są obojętne wobec Al / Hg. Selektywne desulfonylowanie można prowadzić na β-hydroksysulfonach bez eliminacji redukcyjnej.
-
( 9 )
Kataliza metali przejściowych jest również przydatna do stereospecyficznej redukcji alkenylosulfonów. W obecności nadmiaru odczynnika Grignarda , katalizatora palladowego (II) lub niklowego (II) i ligandu fosforowego lub azotowego, alkenylosulfony są przekształcane stereospecyficznie w odpowiednie alkeny z dobrą wydajnością. Z drugiej strony rozpuszczanie metali i redukcje amalgamatu metali nie są generalnie stereoselektywne. Kataliza palladowa jest ogólnie lepsza od katalizy niklowej, dając wyższe wydajności i stereoselektywność.
-
( 10 )
Sulfony alkilowe i alkenylowe z dobrymi grupami opuszczającymi w pozycji β ulegają eliminacji w warunkach redukcyjnych z wytworzeniem alkenów lub alkinów. Julia olefinowania wykorzystuje ten proces syntezy alkenów z alkilowych sulfonów i związków karbonylowych. Dodanie anionu α-sulfonylowego do związku karbonylowego, a następnie wygaszenie chlorkiem acylowym lub sulfonylowym prowadzi do β-acyloksy lub -sulfonyloksysulfonu, który ulega eliminacji w warunkach redukcyjnych. Do wykonania etapu eliminacji można zastosować amalgamat sodu; jednakże połączenie jodku samaru (II) i HMPA jest łagodniejsze niż silnie zasadowy amalgamat sodu i prowadzi do wyższych wydajności w procesach eliminacji redukcyjnej.
-
( 11 )
Aplikacje syntetyczne
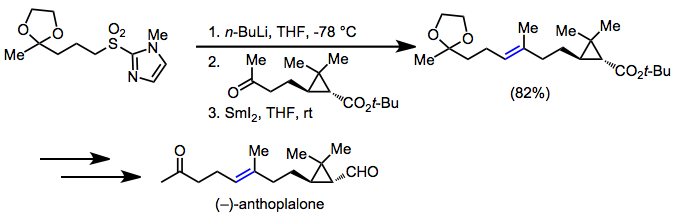
Skromna kwasowość węgli sąsiadujących z grupą sulfonylową uczyniła sulfony użytecznymi w syntezie organicznej . Po usunięciu grupy sulfonylowej przez desulfonylację lub eliminację redukcyjną, wynikiem netto jest utworzenie wiązania pojedynczego lub podwójnego wiązania węgiel-węgiel między dwoma niefunkcjonalizowanymi atomami węgla, wszechobecnego motywu w syntetycznych celach. W syntezie (-) - anthoplononu, olefinacja Julia została wykorzystana do ustalenia ( E ) -alkenu w celu.
(12)
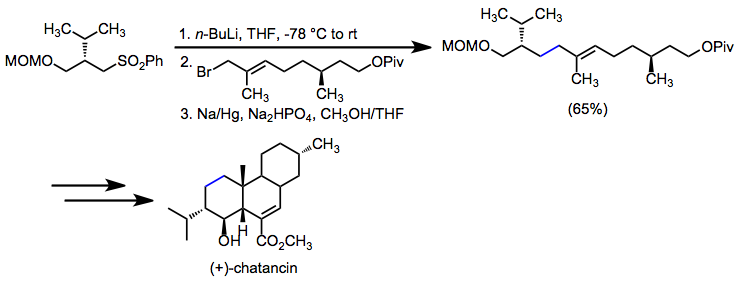
Desulfonylacja redukcyjna jest stosowana, gdy celem jest ustanowienie pojedynczego wiązania węgiel-węgiel. W syntezie (+) - czatancyny, alkilacja α-sulfonylokarbanionu, a następnie desulfonylacja utworzyła kluczowe allilowe wiązanie węgiel-węgiel.
(13)
Porównanie z innymi metodami
Ponieważ α-cyjanokarbaniony mogą być stosowane w wielu takich samych kontekstach, jak aniony α-sulfonylowe, redukcyjne metody dekyjanacji stanowią realną alternatywę dla redukcyjnej desulfonylacji. Redukcje metali rozpuszczających są najbardziej przydatne do usuwania cyjanów trzeciorzędowych nitryli (pierwszorzędowe i drugorzędowe nitryle dają odpowiednie aminy oprócz produktów dekyjanowanych), ale potas jest bardziej ogólnym środkiem redukującym, który ogranicza pierwszorzędowe, drugorzędowe i trzeciorzędowe nitryle.
(14)

Szeroka różnorodność metod karbonylo olefinowania, które są bezpośrednią alternatywą olefinowanie Julia znane są w reakcji Wittiga , w reakcji Hornera-Wadswortha-Emmonsa , Reakcja Petersona i in. Podstawową zaletą olefinowania Julii jest to, że prekursory sulfonowe są czasami łatwiej dostępne i łatwiejsze do oczyszczenia niż odpowiednie związki zawierające fosfor lub krzem. Ponadto istnieje wiele metod syntezy sulfonów. Niemniej jednak czasami ograniczona stereoselektywność (aw szczególności trudność dostępu do ( Z ) -alkenów) reakcji Julii może być problematyczna. Wiele alternatywnych metod olefinacji, w tym reakcja Petersona, nie ma tego problemu.
(15)


![{\ Displaystyle {\ rozpocząć {wyrównane} {\ ce {ArSO2R -> [+ {\ ce {e ^ {-}}}] {[ArSO2R] ^ {.-}} -> {ArSO2 ^ {-}} + }} \ & {\ ce {R ^ {.}}} \\ & {\ ce {R ^ {.} -> [+ {\ ce {e ^ {-}}}] [{\ ce {H- olv}}] RH}} \\\ end {aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af990b4b965c4b6ecf4e38875554dc167745a312)