Fumonizyna B1 - Fumonisin B1

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
(2 S ,2′ S )-2,2′-[(5 S ,6 R ,7 R ,9 R ,11 S ,16 R ,18 S ,19 S )-19-Amino-11,16,18 kwas -trihydroksy-5,9-dimetyloikozano-6,7-diylo]bis[oksy(2-oksoetano-2,1-diylo)]dibutanodiowy |
|
| Inne nazwy
Makrofuzyna
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA |
100.150.289 |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 34 H 59 N O 15 | |
| Masa cząsteczkowa | 721,838 g·mol -1 |
| Wygląd | Proszek o barwie białej do złamanej bieli |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Fumonizyna B 1 jest najbardziej rozpowszechnionym członkiem rodziny toksyn, zwanych fumonizynami , wytwarzanych przez kilka gatunków pleśni Fusarium , takich jak Fusarium verticillioides , które występują głównie w kukurydzy, pszenicy i innych zbożach. Zanieczyszczenie kukurydzy fumonizyną B1 odnotowuje się na całym świecie na poziomie mg/kg. Narażenie człowieka występuje na poziomie mikrogramów do miligramów dziennie i jest największe w regionach, gdzie produkty kukurydziane są podstawowym składnikiem diety.
Fumonizyny B 1 jest toksyczne dla wątroby i nefrotoksyczne we wszystkich badanych gatunków zwierząt. Najwcześniejsze zmiany histologiczne pojawiające się w wątrobie lub nerkach zwierząt leczonych fumonizyną to zwiększona apoptoza, po której następuje regeneracyjna proliferacja komórek. Chociaż ostra toksyczność fumonizyny jest niewielka, jest ona znaną przyczyną dwóch chorób, które występują u zwierząt domowych o szybkim początku: leukoencefalomalacji koni i zespołu obrzęku płuc świń. Obie te choroby wiążą się z zaburzonym metabolizmem sfingolipidów i dysfunkcją układu sercowo-naczyniowego.
Historia
W 1970 roku wybuch leukoencefalomalacji u koni w Afryce Południowej był związany z zanieczyszczeniem kukurydzy grzybem Fusarium verticillioides . Jest to jeden z najbardziej rozpowszechnionych grzybów nasiennych związanych z kukurydzą. Przeprowadzono inne badanie dotyczące możliwej roli toksyn grzybiczych w etiologii raka przełyku u ludzi w regionie Afryki Południowej. Dieta ludzi żyjących na tym obszarze stanowiła kukurydza uprawiana w domu, a F. verticillioides był najczęściej występującym grzybem w kukurydzy spożywanym przez osoby z wysoką zachorowalnością na raka przełyku. Dalsze wybuchy leukoencefalomalacji i ludzi w niektórych regionach o wysokiej zachorowalności na raka przełyku doprowadziły do dalszych badań nad F. verticillioides . Wkrótce odkryli eksperymentalnie, że F. verticillioides powoduje leukoencefalomalację u koni i obrzęk płuc u świń. Stwierdzono, że jest wysoce hepatotoksyczny i kardiotoksyczny u szczurów. W 1984 r. wykazano, że grzyb jest hepatokarcynogenny u szczurów. Chemiczny charakter metabolitów wywołujących to wszystko nie został jeszcze odkryty w 1984 roku. Po odkryciu rakotwórczości grzyba pilnie nałożono izolację i charakterystykę chemiczną mykotoksyn i czynników rakotwórczych wytwarzanych przez F. verticillioides . Dopiero w 1988 roku ujawniono chemiczną naturę tego czynnika rakotwórczego. Fumonizynę B 1 i fumonizynę B 2 wyizolowano z hodowli F. verticillioides w Programie Mikotoksyn i Doświadczalnej Karcynogenezy. Struktury zostały wyjaśnione we współpracy z Radą Badań Naukowych i Przemysłowych. W stałej hodowli ryżu wykryto kilka izomerów fumonizyny B1. Obecnie znanych jest ponad 100 różnych fumonizyn, z których najważniejsze to fumonizyny B 1 , B 2 i B 3 .
Toksykokinetyka
Jeśli chodzi o toksykokinetykę, nie ma dostępnych danych dotyczących ludzi, ale przeprowadzono badania na zwierzętach.
Wchłanianie
FB 1 przyjmuje się doustnie z pożywieniem. Ogólnie rzecz biorąc, FB 1 jest słabo wchłaniany, mniej niż 6%. Absorpcja podawanych doustnie fumonizyny B 1 (ciężar 10 mg / kg masy ciała) u szczurów jest niska (3,5% dawki), ale szybko (T max = 1,02 h). FB 1 nie przenika znacząco przez ludzką skórę, a zatem nie stanowi znaczącego ogólnoustrojowego zagrożenia dla zdrowia po narażeniu przez skórę.
Dystrybucja
Po wchłonięciu część wydaje się być zatrzymywana w wątrobie i nerkach. W przypadku szczurów karmionych dietą zawierającą fumonizyny przez kilka tygodni, stężenie fumonizyn w nerkach było około 10-krotnie wyższe niż w wątrobie.
Dystrybucja wchłoniętej dawki w osoczu była zgodna z otwartym dwuprzedziałowym modelem, a wyniki stężenia w tkankach (wątroba, nerki) w czasie były zgodne z jednoprzedziałowym otwartym modelem .
Wydalanie
Okres półtrwania w fazie eliminacji u szczurów wynosi 3,15 h dla osocza, 4,07 h dla wątroby i 7,07 h dla nerek. Jednak FB 1 jest szybko wydalany, głównie w swojej pierwotnej postaci. Małe ilości są wydalane z moczem; większość jest wydalana z kałem.
Toksydynamika
Ze względu na swoje podobieństwo fumonizyny mogą hamować transferazy sfingozyno -sfinganinowe i syntazy ceramidowe, a zatem są konkurencyjnymi inhibitorami biosyntezy i metabolizmu sfingolipidów .
Figura 2 przedstawia metabolizm sfingolipidów (schemat) i hamowanie powodowane przez fumonizyny. Fumonizyna B 1 hamuje enzym syntazę ceramidową ( N- acylotransferazę sfingozyny ), który acyluje zasady sfingoidowe. Blokuje to tworzenie ceramidu dwoma drogami. Hamuje powstawanie poprzez de novo sfinganinę i tłuszczowy acylo-CoA oraz poprzez sfingozynę wytwarzaną przez rozkład ceramidu przez ceramidazę. Inhibicja powoduje wzrost stężeń sfinganiny, sfingozyny i ich metabolitów 1-fosforanowych oraz zmniejszenie stężeń złożonych sfingolipidów. Akumulacja sfinganiny i sfingozyny jest główną przyczyną toksyczności fumonizyny B 1 Sfinganina i sfingozyna są cytotoksyczne i hamują wzrost. Ponadto te zasady sfingoidalne indukują apoptozę. Wydaje się, że zwiększona apoptoza odgrywa ważną rolę w skutkach toksycznych, w tym indukcji guza. Należy jednak wspomnieć, że obniżone stężenie ceramidu i podwyższone stężenie sfingozyno-1-fosforanu (w wyniku przyjmowania FB 1 ) powodują zahamowanie apoptozy oraz sprzyjają mitozie i regeneracji. Równowaga między wewnątrzkomórkowym stężeniem związków hamujących apoptozę i tych, które indukują apoptozę, określi odpowiedź komórkową. Również zmniejszone stężenia złożonych sfingolipidów wydają się odgrywać rolę w nieprawidłowym zachowaniu i zmienionej morfologii dotkniętych komórek.
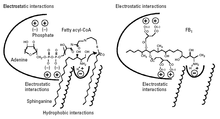
Mechanizm akcji
Proponowany mechanizm działania przedstawiono na rycinie 3. Fumonizyna B 1 zajmuje przestrzeń i oddziaływania elektrostatyczne zarówno sfinganiny (lub sfingozyny), jak i tłuszczowego acylo-CoA w syntazie ceramidowej. Część FB 1 , który ma podobieństwa strukturalnego zasady sfingoidowe (część aminopentol) mogą wchodzić w interakcje z miejscem wiązania sphinganine, natomiast ujemnie naładowane grupy kwasowe tricarbyllic mogą wchodzić w interakcje z miejscem wiązania tłuszczowych acylo-CoA.
Ponieważ FB 1 zajmuje również tłuszczową przestrzeń acylo-CoA, nie jest acylowany, ponieważ acylo-CoA jest niezbędny do acylowania; FB 1 hamuje tylko syntazę ceramidów. Jednak, kiedy kwasowe grupy tricarbillic są usuwane z FB 1 hydrolizy i otrzymany produkt (aminopentol AP1) nie tylko działa jako inhibitor, ale jako substrat dla syntazy ceramidową; aminopentol jest acylowany przez syntazę ceramidową z wytworzeniem N-palmitoilo-AP1. Potwierdza to sugestię, że aminopentolowa część FB 1 zajmuje przestrzeń sfinganiny w enzymie. N-palmitoilo-AP1 jest jeszcze silniejszym inhibitorem syntazy ceramidowej i dlatego może odgrywać rolę w toksyczności nixtamalizowanych fumonizyn.
Efekty toksyczne
Zagrożenia związane z fumonizyną B1 zostały ocenione przez Międzynarodowy Program Bezpieczeństwa Chemicznego Światowej Organizacji Zdrowia oraz Komitet Naukowy ds. Żywności Komisji Europejskiej. Ustalili tolerowane dzienne spożycie FB 1 , FB 2 , FB 3 , pojedynczo lub w połączeniu 2 µg/kg masy ciała. Do tej pory nie doniesiono o kinetyce i metabolizmie fumonizyny B 1 u ludzi. Na innych zwierzętach przeprowadzono wiele badań, ale mogą one nie być porównywalne z ludźmi. U myszy eliminacja FB 1 jest bardzo szybka, ale u ludzi może być znacznie wolniejsza, biorąc pod uwagę ich masę ciała. Istnieje kilka możliwych ścieżek, które powodują toksyczne działanie Fumonizyny B 1 . Większość efektów toksycznych wynika ze zmienionego metabolizmu sfingolipidów przez hamowanie syntazy ceramidowej. Może wystąpić produkcja reaktywnych form tlenu. Zwiększa to stres oksydacyjny i indukuje peroksydację lipidów i może uszkadzać komórki. W zgodzie z tym niektóre badania wykazały obniżony poziom glutationu w wątrobie, ale inne badania wykazały nawet podwyższony poziom glutationu. Zgłaszano również efekty cytotoksyczne. Innym efektem ekspozycji na FB 1 jest apoptoza. Zaobserwowano to w wielu różnych komórkach i tkankach. Za ten efekt nie odpowiada hamowanie syntazy ceramidowej. Głównymi czynnikami mogą być fragmentacja DNA i aktywacja kaspazy-3. FB 1 ma również działanie immunotoksyczne, ale potrzeba znacznie więcej badań, aby uzyskać jasny obraz wpływu na układ odpornościowy.
Skutki toksyczne u ludzi
Wady cewy nerwowej
Wady cewy nerwowej to nieprawidłowości mózgu i rdzenia kręgowego w zarodku wynikające z niemożności zamknięcia cewy nerwowej. Badania epidemiologiczne i badania kliniczne wykazały niedobór kwasu foliowego jako główny czynnik ryzyka wad cewy nerwowej. FB 1 zaburza metabolizm sfingolipidów i dlatego może wpływać na wychwyt kwasu foliowego i powodować wady cewy nerwowej. W latach 1990 i 1991 na granicy Teksasu z Meksykiem doszło do nagłego wybuchu wad cewy nerwowej. Uważa się, że ta epidemia mogła być spowodowana wysokim poziomem FB 1, który zaobserwowano w kukurydzy w poprzednich latach. Regiony w Chinach i RPA o wysokim spożyciu kukurydzy mają również wysoką częstość występowania wad cewy nerwowej.
Rak przełyku
Uważa się, że istnieje związek między występowaniem F. verticillioides a ludzkim rakiem przełyku. Niski status społeczno-ekonomiczny i mniej zróżnicowana dieta, składająca się głównie z kukurydzy i pszenicy, wiąże się z pojawieniem się raka przełyku. Wynika to z badań epidemiologicznych w różnych krajach. Inne badania pokazują, że wyższe stężenia FB 1 , FB 2 i F. verticillioides są obecne w kukurydzy rosnącej w regionach o wysokim odsetku raka przełyku. Ta, w przeciwieństwie do regionów o niskim poziomie F. verticillioides FB 1 i FB 2 w kukurydzy. Ponadto wydaje się, że osoby z wysokim spożyciem kukurydzy są bardziej narażone na rozwój raka przełyku niż osoby z niskim spożyciem kukurydzy. Obserwują to ludzie w regionach we Włoszech, Iranie, Kenii, Zimbabwe, Stanach Zjednoczonych i Brazylii o wysokiej zachorowalności na raka przełyku. Inne badanie dotyczące związku między poziomem sfingolipidów a zapadalnością na raka nie wykazało żadnego istotnego związku między sfingolipidami w surowicy a ryzykiem raka przełyku. Jest to bardzo zaskakujący, ponieważ podwyższony poziom sfingolipidy sphinganine i sfingozyny Uważa się biomarkery ekspozycji FB 1 .
Ostra mykotoksykoza
Ostra mykotoksykoza to zatrucie pokarmowe produktami spożywczymi skażonymi grzybami. W 1995 roku w 27 wioskach w Indiach wybuchła epidemia choroby charakteryzująca się biegunką i bólami brzucha. Było to wynikiem konsumpcji spleśniałego sorgo i kukurydzy z powodu szkód spowodowanych deszczem. Ta epidemia była badana, a mykotoksykoza była powiązana ze spożyciem przaśnego chleba. Próbki kukurydzy i sorgo zostały pobrane z gospodarstw domowych i przebadane. Kukurydza i sorgo zostały skażone przez Fusarium i Aspergillus i zawierały wysoki poziom FB 1 w porównaniu z próbkami gospodarstw domowych bez zmian.
Skutki toksyczne u zwierząt
Przeprowadzono wiele badań dotyczących toksycznego wpływu FB 1 na zwierzęta. Badania in vivo wskazują, że głównymi narządami docelowymi są wątroba i nerki. Fumonizyny są słabo wchłaniane, szybko eliminowane i nie są metabolizowane u zwierząt. U świń i szczurów występuje szeroka dystrybucja FB 1 i stwierdzono, że niewielkie ilości akumulują się tylko w wątrobie i nerkach. U koczkodanów niektóre FB 1 są częściowo hydrolizowane w jelitach.
Skutki rakotwórcze
U szczurów i myszy, które były narażone na FB 1 powstawania nowotworu miejsce. Przeprowadzono kilka badań na ten temat. W zależności od szczepu myszy, które zostały użyte, wykazano różne nowotwory. FB 1 stwierdza się nongenotoxic. Dlatego mechanizmy odpowiedzialne za rozwój raka powinny leżeć gdzie indziej. Ważnymi mechanizmami rozwoju raka wywołanymi fumonizyną B 1 mogą być uszkodzenia oksydacyjne (produkcja reaktywnych form tlenu) i peroksydacja lipidów. Guzy wątroby i nerek mogą być również spowodowane apoptozą przez FB 1 . W odpowiedzi na to może nastąpić ciągła regeneracja komórek powodująca raka. Wydaje się, że utrudniała sfingolipid metabolizm jest sprawczym czynnikiem FB 1 indukowaną rakotwórczego, jak to ma miejsce w przypadku skutków toksycznych. Na podstawie wszystkich tych badań na zwierzętach FB 1 została sklasyfikowana przez Międzynarodową Agencję Badań nad Rakiem (IARC) jako potencjalnie rakotwórcza dla ludzi (grupa 2B).
Obrzęk płuc świń
Obrzęk płuc świń spowodowany przez FB 1 jest intensywnie badany po pierwszym doniesieniu w 1981 roku u świń z obrzękiem płuc po ekspozycji na kukurydzę skażoną F. verticillioides . Opisano zmiany w biosyntezie sfingolipidów, zwłaszcza w tkance płuc, serca, nerek i wątroby. Śmiertelny obrzęk płuc rozwinął się w ciągu 4–7 dni po ekspozycji na paszę o stężeniu FB 1 >16 mg/kg masy ciała (>92 części na milion). Dawki 10 części na milion powodowały łagodniejszą postać obrzęku płuc.
Leukoencefalomalacja koni
Leukoencefalomalacja jest neurotoksyczną chorobą koni. Wybuchy tej choroby w XX wieku zaowocowały szeregiem badań. Najwyraźniej FB 1 był przyczyną tej choroby. Wykazano podwyższone poziomy enzymów w surowicy, które wskazują na uszkodzenie wątroby. Były one zwykle obserwowane przez podwyższenie stosunku sfinganina/sfingozyna. FB 1 prawdopodobnie indukuje czynność układu sercowo-naczyniowego z powodu podwyższonego stosunku sfinganina/sfingozyna. Może to być jeden z głównych czynników powodujących leukoencefalomalację.
Toksyczność u zwierząt laboratoryjnych
Efekty karmienia szczurów FB 1 przez okres do 90 dni były zwykle nefrotoksycznością. Pomiędzy różnymi szczepami szczurów, wrażliwość na FB 1 zmieniana. W nerkach głównym efektem była apoptoza. Stwierdzono również zanik i regenerację kanalików oraz zmniejszenie masy nerek. Zgłaszano wpływ histopatologiczny na wątrobę szczura zarówno po krótko-, jak i długookresowej ekspozycji. Główną przyczyną była apoptoza. Myszy nie wydają się być bardzo wrażliwe na działanie nefrotoksyczne w porównaniu ze szczurami. W nerkach myszy zaobserwowano niewielkie zmiany histologiczne po ekspozycji na duże dawki. Wątroba była również głównym narządem docelowym u myszy. Patologia jest podobna jak u szczurów, z apoptozą i przerostem komórek wątrobowych. Fumonizyny B 1 jest ewentualnie embriotoksyczne, gdy dawka jest toksyczny dla matki. Szereg badań dotyczących genotoksyczności nie wykazało efektów mutagenetycznych. Chociaż fumonizyna może bezpośrednio uszkadzać DNA poprzez wytwarzanie reaktywnych form tlenu. Zarodki myszy wystawiono na działanie FB 1 i wykazywały zahamowaną syntezę i wzrost sfingolipidów. To spowodowało wady cewy nerwowej. Wychwyt kwasu foliowego został dramatycznie zahamowany. Leczenie po ekspozycji kwasem foliowym zmniejszyło wady cewy nerwowej o 50-65%.
Tolerowane dzienne spożycie
Zagrożenia związane z fumonizyną B1 zostały ocenione przez Międzynarodowy Program Bezpieczeństwa Chemicznego Światowej Organizacji Zdrowia oraz Komitet Naukowy ds. Żywności Komisji Europejskiej. Ustalili tolerowane dzienne spożycie FB1, FB2, FB3, samodzielnie lub w połączeniu 2 µg/kg masy ciała.
Detoksykacja
Hamowanie syntazy FB ceramidową 1, uważa się, że jest odwracalny, ponieważ wiąże się tworzy niekowalencyjne. Czynniki, które prawdopodobnie indukują ten odwracalność zmniejszenie FB komórkowej 1 -concentration i zwiększenie stężenia komórkowych substratów syntazy ceramidu. Również tempo usuwania nagromadzonej sfinganiny i sfingozyny wpłynie na detoksykację. Informacje na temat metabolizmu i biotransformacji FB 1 są bardzo skąpe. Jednak metabolizm najprawdopodobniej zachodzi w jelicie, ponieważ częściowo zhydrolizowany i całkowicie zhydrolizowany FB 1 wykryto w kale, ale nie w żółci koczkodanów. Biodostępność FB 1 można zmniejszyć przez obróbkę fumonizyny zanieczyszczonych kukurydzy z glukomannany wyekstrahowanych ze ściany komórkowej drożdży, Saccharomyces cerevisiae. Te polisacharydy są zdolne do wiązania niektórych mikotoksyn i mają 67% zdolność wiązania fumonizyn.