Proces politropowy - Polytropic process
| Termodynamika |
|---|

|
Politropowe proces jest termodynamiczny proces , który słucha relacji:
gdzie p to ciśnienie , V to objętość , n to indeks politropy , a C to stała. Politropowe równanie procesu może opisywać wiele procesów rozszerzania i ściskania, które obejmują przenoszenie ciepła.
Szczególne przypadki
Pewne określone wartości n odpowiadają konkretnym przypadkom:
- dla procesu izobarycznego ,
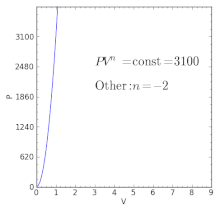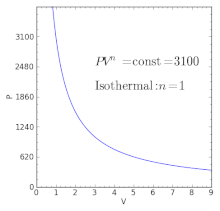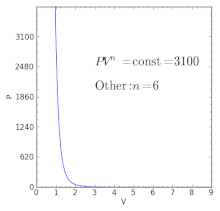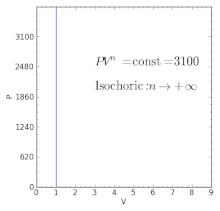
- dla procesu izochorycznego .
Ponadto, gdy ma zastosowanie prawo dotyczące gazu doskonałego :
- do procesu izotermicznego ,
- dla procesu izentropowego .
Gdzie jest stosunek pojemności cieplnej przy stałym ciśnieniu ( ) do pojemności cieplnej przy stałej objętości ( ).
Równoważność między współczynnikiem politropy a stosunkiem transferów energii
Dla gazu doskonałego w układzie zamkniętym przechodzącego powolny proces z pomijalnymi zmianami energii kinetycznej i potencjalnej proces jest politropowy, tak że
gdzie C jest stałą , oraz z politropowe współczynnik .
Związek z idealnymi procesami
Dla pewnych wartości wskaźnika politropy proces będzie synonimem innych typowych procesów. W poniższej tabeli przedstawiono przykłady skutków różnych wartości indeksu.
Indeks politropy |
Relacja | Efekty |
|---|---|---|
| n <0 | - | Ujemne wykładniki potęgowe odzwierciedlają proces, w którym praca i ciepło przepływają jednocześnie do lub z systemu. W przypadku braku sił poza ciśnieniem, taki spontaniczny proces nie jest dozwolony przez drugą zasadę termodynamiki ; Jednak ujemne wykładniki mogą mieć znaczenie w niektórych szczególnych przypadkach, w których nie są zdominowane przez oddziaływania termiczne, na przykład w procesach niektórych plazmy w astrofizyce lub jeśli w procesie (np. eksplozja ) zaangażowane są inne formy energii (np. energia chemiczna ). |
| n = 0 | Odpowiednik procesu izobarycznego (stałe ciśnienie ) | |
| n = 1 | Równoznaczne z procesem izotermicznym (stała temperatura ), przy założeniu idealnego prawa gazowego , ponieważ wtedy . | |
| 1 < n < γ | - | Przy założeniu idealnego prawa gazu przepływy ciepła i pracy idą w przeciwnych kierunkach ( K > 0), np. W chłodnictwie kompresyjnym pary podczas sprężania, gdzie podwyższona temperatura pary wynikająca z pracy sprężarki na parze prowadzi do pewnych straty ciepła z pary do chłodniejszego otoczenia. |
| n = γ | - | Odpowiednik procesu izentropowego (adiabatyczny i odwracalny, bez wymiany ciepła), przy założeniu prawa gazu doskonałego . |
| γ < n <∞ | - | Przy założeniu prawa gazu doskonałego przepływy ciepła i pracy idą w tym samym kierunku ( K <0), np. W silniku spalinowym podczas suwu mocy, gdzie ciepło jest tracone z gorących produktów spalania przez ściany cylindra, do chłodniejszego otoczenia, w tym samym czasie, gdy gorące produkty spalania dociskają tłok. |
| n = + ∞ | Odpowiednik procesu izochorycznego (stała objętość ) |
Kiedy indeks n znajduje się między dowolnymi dwiema z poprzednich wartości (0, 1, γ lub ∞), oznacza to, że krzywa politropy przecina (będzie ograniczona ) krzywe dwóch indeksów granicznych.
Dla gazu doskonałego 1 < γ <5/3, ponieważ według relacji Mayera
Inny
Rozwiązanie równania Lane'a-Emdena za pomocą płynu politropowego nazywane jest politropem .
Zobacz też
- Proces adiabatyczny
- Kompresor
- Silnik spalinowy
- Proces izentropowy
- Proces izobaryczny
- Proces izochoryczny
- Proces izotermiczny
- Polytrope
- Równowaga quasistatyczna
- Termodynamika
- Chłodnictwo kompresyjne