Wariant glikoproteiny powierzchniowej - Variant surface glycoprotein
| Zmienna glikoproteina powierzchniowa | |
|---|---|
| Identyfikatory | |
| Organizm | |
| Symbol | TB927.5.4730 |
| Alt. symbolika | Tb05.26C7.380 |
| Entrez | 3657576 |
| Inne dane | |
| Chromosom | 5: 1,41 - 1,41 Mb |
| Wariant glikoproteiny powierzchniowej MITAT 1,2 | |||||||
|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||
| Organizm | |||||||
| Symbol | Nie dotyczy | ||||||
| Alt. symbolika | VSG 221 | ||||||
| UniProt | P26332 | ||||||
| |||||||
Wariant glikoproteina powierzchniowa ( VSG ) jest białkiem, które ~ 60kDa gęsto pakuje powierzchni komórek z pierwotniaków pasożytów należących do rodzaju Trypanosoma . Ten rodzaj wyróżnia się białkami powierzchniowymi komórek. Zostały one po raz pierwszy wyizolowane z Trypanosoma brucei w 1975 roku przez George'a Crossa . VSG umożliwia pasożytom trypanosomatycznym unikanie układu odpornościowego żywiciela ssaka dzięki znacznej zmienności antygenowej . Tworzą powłokę powierzchniową 12–15 nm. Dimery VSG, ~90% wszystkich białek powierzchniowych komórki. Stanowi również ~10% całkowitego białka komórkowego. Z tego powodu białka te są wysoce immunogenne, a odpowiedź immunologiczna wywołana przeciwko specyficznemu płaszczowi VSG szybko zabije trypanosomy wyrażające ten wariant. Jednak z każdym podziałem komórki istnieje możliwość, że potomstwo zmieni ekspresję, aby zmienić wyrażany VSG. VSG nie ma zalecanej aktywności biochemicznej .
Pasożyt ma duży repertuar komórkowej antygenowo odrębne VSGs (~ 1500/2000 całkowite i częściowe ( pseudogeny )) znajduje się w telomerowych i subtelomerowych macierzy (na Mb chromosomów lub minichromosomy ). VSG są wyrażane z miejsca ekspresji we krwi (BES, ES) w policistronie przez polimerazę RNA I (rekrutowaną do promotora typu rybosomalnego ) z innymi genami związanymi z ES (ESAG), z których receptor transferyny (Tfr: ESAG6, ESAG7) jest jeden. Tylko jeden gen VSG jest eksprymowany na raz, ponieważ tylko jeden z ~15 ES jest aktywny w komórce. Ekspresja VSG jest "przełączana" przez homologiczną rekombinację cichego genu kopii podstawowej z macierzy (kierowanej przez homologię) do aktywnego miejsca ekspresji zlokalizowanego w telomerze. Podczas tego przejścia trypanosomy jednocześnie wyświetlają na swojej powierzchni zarówno przed, jak i po przełączeniu VSG. Ten proces zastępowania płaszcza jest krytyczny dla przeżycia niedawno zmienionych komórek, ponieważ początkowe VSG pozostają celami eskalacji odpowiedzi Ab gospodarza. Geny mozaiki VSG można wytworzyć przez homologiczną rekombinację częściowego genu VSG z macierzy. Ten częściowy gen może zastąpić dowolną część rezydującego genu VSG, tworząc nową mozaikę VSG. Pomiary okresu półtrwania VSG sugerują, że początkowe VSG mogą utrzymywać się na powierzchni genetycznie zmienionych trypanosomów przez kilka dni. Nie jest jasne, czy regulacja przełączania VSG jest czysto stochastyczna, czy też bodźce środowiskowe wpływają na częstotliwość przełączania. Fakt, że zamiana zachodzi in vitro sugeruje, że w tym procesie występuje przynajmniej pewien element stochastyczny niezależny od gospodarza.
Zmienność antygenowa powoduje cykliczne fale parazytemii, która jest jedną z cech charakterystycznych ludzkiej trypanosomatozy afrykańskiej . Cykliczny proces trwa 5-8 dni. Dzieje się tak, ponieważ zróżnicowana gama sierści wyrażana przez populację trypanosomów oznacza, że układ odpornościowy jest zawsze o krok w tyle: rozwinięcie się odpowiedzi immunologicznej przeciwko danemu VSG zajmuje kilka dni, co daje populacji czas na dywersyfikację, gdy osobniki przechodzą dalsze zmiany wydarzenia. Powtarzanie tego procesu zapobiega wyginięciu zakażającej populacji trypanosomów, pozwalając na chroniczne utrzymywanie się pasożytów u żywiciela i zwiększając możliwości przenoszenia.
W Trypanosoma brucei
W Trypanosoma brucei powierzchnia komórki pokryte gęstą warstwą 5 x 10 ~ 6 VSG dimerów , ~ 90% całkowitego białka na powierzchni komórki. Stanowi również ~10% całkowitego białka komórkowego.
Właściwości sierści VSG umożliwiające unikanie odporności to:
- Ekranowanie – gęsty charakter powłoki VSG (białka VSG pakują się ramię w ramię) uniemożliwia systemowi odpornościowemu ssaka dostęp do błony komórkowej lub innych pasożytniczych niezmiennych epitopów powierzchniowych (takich jak kanały jonowe , transportery , receptory itp.). ). Płaszcz jest jednolity, złożony z milionów kopii tej samej cząsteczki; dlatego VSG jest jedyną częścią trypanosomu, którą może rozpoznać układ odpornościowy.
- Okresowa zmienność antygenowa – otoczka VSG podlega częstym stochastycznym modyfikacjom genetycznym – „przełączaniu” – umożliwiając wariantom wyrażającym nową otoczkę VSG ucieczkę przed specyficzną odpowiedzią immunologiczną wywołaną w stosunku do poprzedniego okrywy. Ta zmienność antygenowa tworzy cykliczne fale parazytemii charakterystyczne dla ludzkiej trypanosomatozy afrykańskiej.
- „Oczyszczanie” antygenu i recykling VSG — VSG jest skutecznie zawracany przez kieszonkę wiciową trypanosomów, umożliwiając „oczyszczenie” przeciwciał z VSG przed ponownym włączeniem z powrotem do błony komórkowej. Co ważne, VSG rozpoznawane i wiązane przez przeciwciała są selektywnie wypychane w kierunku kieszonki wici szybciej niż niezidentyfikowane VSG; w tym scenariuszu przeciwciało działa jak „żagiel”, który przyspiesza proces przenoszenia VSG do obszaru recyklingu.
VSG z T. brucei są przyłączone do błony plazmatycznej poprzez kowalencyjne połączenie z dwoma kotwicami glikozylofosfatydyloinozytolu (GPI) (jedna na monomer ), co kieruje jego ruch do przodu z ER do kieszeni wici w celu włączenia do błony, zgodnie z przewidywaniami hipotezy walencyjnej GPI.
VSG są zastępowane przez równie gęstą powłokę procyklin, gdy pasożyt różnicuje się do formy procyklicznej w jelicie środkowym muchy tse - tse . Następuje bardzo szybkie zahamowanie transkrypcji genu VSG, które następuje zaraz po obniżeniu temperatury.
Wyrażenie
Źródłem zmienności VSG podczas infekcji jest duże „archiwum” genów VSG obecnych w genomie T. brucei . Niektóre z nich to pełnej długości, nienaruszone geny ; inne są pseudogenami (zazwyczaj z mutacjami przesunięcia ramki , przedwczesnymi kodonami stop lub fragmentacją). Ekspresja antygenowo odmiennego VSG może nastąpić przez proste przełączenie na inny gen VSG pełnej długości przez zmianę miejsca ekspresji (przełączenie, który ES jest aktywny). Ponadto, chimeryczne lub „mozaikowe” geny VSG można generować przez połączenie segmentów z więcej niż jednego cichego genu VSG . Tworzenie się mozaikowych VSG umożliwia (częściową) ekspresję pseudogenów VSG , które mogą stanowić większą część archiwum VSG i mogą bezpośrednio przyczyniać się do zmienności antygenowej, znacznie zwiększając zdolność trypanosomu do unikania odporności i stanowiąc poważny problem dla rozwój szczepionek .
VSG geny mogą być przechowywane cichy i włączone w danym momencie. Wyrażony VSG jest zawsze zlokalizowany w miejscu ekspresji (ES), które są wyspecjalizowanymi loci ekspresyjnymi znajdującymi się w telomerach niektórych dużych i pośrednich chromosomów. Każdy ES jest jednostką policistronową, zawierającą pewną liczbę genów związanych z miejscem ekspresji (ESAG), wszystkie wyrażane wraz z aktywnym VSG. Chociaż istnieje wiele ES, tylko jeden jest zawsze aktywny w danym momencie. Wydaje się, że w proces ten zaangażowanych jest wiele mechanizmów, ale dokładna natura wyciszania jest nadal niejasna.
Wyrażony VSG można zmienić albo przez aktywację innego miejsca ekspresji (i tym samym zmianę w celu ekspresji VSG w tym miejscu) albo przez zmianę genu VSG w miejscu aktywnym na inny wariant. Genom zawiera wiele kopii genów VSG, zarówno na minichromosomach, jak iw powtórzonych przekrojach we wnętrzu chromosomów. Są one na ogół nieme, zazwyczaj z pominiętymi odcinkami lub przedwczesnymi kodonami stop, ale są ważne w ewolucji nowych genów VSG. Szacuje się, że do 10% genomu T.brucei może składać się z genów lub pseudogenów VSG . Każdy z tych genów można przenieść do miejsca aktywnego przez rekombinację w celu ekspresji. Ponownie, dokładne mechanizmy, które to kontrolują, są niejasne, ale wydaje się, że proces ten opiera się na maszynerii naprawy DNA i procesie rekombinacji homologicznej .
Miejsce ekspresji we krwi (BES) lub telomeryczne miejsce ekspresji jest używane do wymiany wariantów powierzchniowych glikoprotein, gdy w krwiobiegu gospodarza wydostają się z układu dopełniacza . BES są polimorficzne pod względem wielkości i struktury, ale wykazują zaskakująco zachowaną architekturę w kontekście rozległej rekombinacji. Istnieją bardzo małe BES, a wiele funkcjonujących BES nie zawiera pełnego zestawu genów związanych z miejscami ekspresji (ESAG). Istnieje zbiór około 20-30 witryn, z których każda jest aktywna w danym momencie. Aktywne miejsca ekspresji VSG są pozbawione nukleosomów .
Repertuary genów T. brucei rozeszły się i stały się specyficzne dla szczepu.
Warianty genów powierzchniowych glikoprotein T. brucei sklasyfikowano na dwie grupy w zależności od tego, czy obserwuje się duplikację genów podczas ich ekspresji.
Handel sekretariatami
Trypanosoma mają prosty, spolaryzowany system transportu przez błonę, składający się z pojedynczego aparatu ER , lizosomu i Golgiego .
VSG jest najpierw transkrybowany jako policistron, a następnie podlega specyficznej dla trypanosomatydu poliadenylacji i trans-splicingowi kierowanemu przez szlaki polipirymidynowe . Ponieważ nie ma kontroli transkrypcji, 3'UTR VSG jest ważny dla stabilności jego RNA (najważniejsze, 8- i 14-merowy). VSG jest następnie transkrybowany na polisomach związanych z błoną , a pojawienie się N-końcowej sekwencji sygnałowej kieruje VSG do ER. VSG jest w ten sposób kotranslacyjnie transportowany do światła ER, szybko N-glikozylowany (w miejscach asn-x-ser/thr) i GPI zakotwiczony w miejscu ω przez reakcję transaminacji (usunięcie C-końca hydrofobowego 17 lub 23 aa Sekwencja zakotwiczenia GPI). Miejscem jest zawsze Ser (zwykle w peptydach o sekwencji sygnałowej o długości 17 aminokwasów), Asp (zwykle w peptydach o sekwencji sygnałowej o długości 23 aminokwasów) lub Asn. Również liczba miejsc N-glikozylacji na VSG może się różnić (zwykle 1-3 N-glikany). VSG MITat.1.5 jest glikozylowany we wszystkich trzech potencjalnych miejscach N-glikozylacji.
VSG następnie ulega kalretikulina / calnexin cyklu składania (calnexin jest nieobecny Trypanosoma brucei ), gdzie jest on przejściowo monoglucosylated i deglucosylated i współdziała z różnych białek opiekuńczych, takich jak ER BiP, w celu prawidłowego fałdowania. VSG skutecznie fałduje się i dimeryzuje (sugerując samoistnie korzystne fałdowanie) i jest transportowany przez aparat Golgiego do kieszeni wici w celu włączenia do błony komórkowej.
Co ważne, po wprowadzeniu do błony komórkowej, VSG może być później zawracany przez kieszonkę wiciową i sortowany z powrotem na powierzchnię komórki. VSG nie jest odwracany przez lizosomalne lub proteasomalne szlaki degradacji kanonicznej, ale zamiast tego jest tracony z komórki przez specyficzne cięcie jej kotwicy GPI przez PLC specyficzne dla GPI .
Struktura
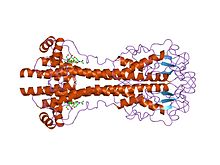
Geny VSG są bardzo zmienne na poziomie sekwencji (pierwotnym), ale uważa się, że warianty mają silnie konserwatywne cechy strukturalne (trzeciorzędowe), w oparciu o dwie określone struktury trójwymiarowe i konserwację motywów sekwencji dwuwymiarowych (zstępujące i rosnące alfa-helisy które tworzą interfejs dimeryzacji), umożliwiając im pełnienie podobnej funkcji ekranowania. VSG składają się z domeny N-końcowej około 300-350 aminokwasów o niskiej homologii sekwencji (13-30% identyczności) i bardziej konserwatywnej domeny C-końcowej o ~100 aminokwasach. Domeny N-końcowe są pogrupowane w klasy AC w zależności od ich wzorców cystein. Domeny C-końca są pogrupowane według homologii sekwencji w klasy I-III, najwyraźniej bez ograniczeń co do klas N-końca, z którymi mogą się sparować, tworząc pełną VSG. Aby zdimeryzować, domeny N-końcowe VSG tworzą wiązkę czterech helis alfa kierowanych przez oddziaływania hydrofobowe, wokół których zwisają mniejsze cechy strukturalne (pięć mniejszych helis i trzy arkusze beta).
VSG jest zakotwiczony do błony komórkowej za pomocą kotwicy glikofosfatydyloinozytolu (GPI) — niekowalencyjnego wiązania od C-końca, które kieruje jego ruchem do przodu z ER do błony. Ta kotwica GPI jest specyficznie odcinana przez fosfolipazę C GPI, przecinając błonową formę VSG i pozwalając białku VSG i części kotwicy GPI na utratę w środowisku zewnątrzkomórkowym jako rozpuszczalny VSG (sVSG, który można rozpoznać jako reagujący krzyżowo). Determinant lub CRD), zachowując dwa łańcuchy 1,2-dimirystoglicerolu w błonie.
Zmienność antygenowa
VSG jest wysoce immunogenny , a odpowiedź immunologiczna wywołana przeciwko specyficznemu płaszczowi VSG szybko zabije trypanosomy wyrażające ten wariant. Przeciwciała , w których pośredniczy świdrowiec zabijania można zaobserwować także w warunkach in vitro przez dopełniacza lizy teście . Jednak z każdym podziałem komórki istnieje możliwość, że jedno lub oba potomstwo zmieni ekspresję, aby zmienić wyrażany VSG. Częstotliwość przełączania VSG została zmierzona na około 0,1% na podział, chociaż wskaźniki przełączania różnią się w hodowli i in vivo . Ponieważ populacje T. brucei mogą osiągać szczytową wielkość 10 11 w obrębie żywiciela, tak szybkie tempo zmiany zapewnia, że populacja pasożytów jest stale zróżnicowana. Zróżnicowany zakres sierści wyrażany przez populację trypanosomów oznacza, że układ odpornościowy jest zawsze o krok w tyle: rozwinięcie się odpowiedzi immunologicznej przeciwko danemu VSG zajmuje kilka dni, co daje populacji czas na dywersyfikację, ponieważ osobniki przechodzą kolejne zmiany. Powtarzanie tego procesu zapobiega wyginięciu zakażającej populacji trypanosomów, umożliwiając przewlekłe utrzymywanie się pasożytów u żywiciela, zwiększając możliwości przenoszenia. Efektem klinicznym tego cyklu są kolejne „fale” parazytemii (trypanosomy we krwi).
W innych trypanosomach
Zmienne glikoproteiny powierzchniowe występują również w innych gatunkach Trypanosoma ,
W Trypanosoma equiperdum , pasożytem powodującym chorobę pokrywającą u koni, białka te umożliwiają pasożytowi skuteczne omijanie układu odpornościowego zwierzęcia żywiciela. Te VSG pozwalają organizmowi na ciągłą manipulację i zmianę struktury powierzchniowej jego białek, co oznacza, że jest on stale prezentowany układowi odpornościowemu jako nowy obcy organizm, co uniemożliwia organizmowi rozwinięcie wystarczająco dużej odpowiedzi immunologicznej, aby zwalczyć chorobę. W tym sensie Trypanosoma equiperdum jest bardzo wydajnym organizmem; może infekować mniej gatunków niż inne choroby, ale infekuje i przeżywa bardzo skutecznie w obrębie określonych żywicieli. Białka VSG w T. equiperdum również ulegają fosforylacji .
Gen VSG z Trypanosoma evansi , pasożyta wywołującego u zwierząt formę surry , został sklonowany w Escherichia coli . Wyrażone białko jest immunoreaktywne ze wszystkimi kombinacjami surowic. Zwierzęta immunizowane lizatem całych komórek lub rekombinowanym białkiem wykazują podobne reakcje przeciwciał w testach ELISA (test immunoenzymatyczny) i CATT ( test aglutynacji kartowej na trypanosomatozę ). Zmienna powierzchniowa glikoproteina RoTat 1.2 PCR może być stosowana jako specyficzne narzędzie diagnostyczne do wykrywania infekcji T. evansi .
Najmniejsze białko VSG (o wielkości 40 kDa) do tej pory (1996) znaleziono w Trypanosoma vivax , który zawiera mało węglowodanów.
W Trypanosoma congolense , in vitro analizy wprowadzonej cukrów po hydrolizie glikoproteiny wykazały, że glukozamina i mannozy są wykorzystywane w biosyntezie ugrupowania węglowodanowego bezpośrednio podczas galaktozy przekształcono ewentualnie innych produktów pośrednich przed włączeniem do antygenu. Nieglikozylowany VSG o masie cząsteczkowej 47 kDa całkowicie stracił niejednorodność wielkości.
Zobacz też
- Białko płaszcza (ujednoznacznienie)
- glikokaliks
- Lista kodów MeSH (D23)
- Lista kodów MeSH (D12.776.395)
- Lista kodów MeSH (D12.776.543)
- Amastin , inna powierzchniowa ( przezbłonowa ) glikoproteina u pasożytów trypanosomatycznych
Bibliografia
Zewnętrzne linki
- Wariantowe glikoproteiny powierzchniowe, trypanosoma w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- www.icp.ucl.ac.be


