Ochrona masy - Conservation of mass
| Część serii na |
| Mechanika kontinuum |
|---|
W fizyce i chemii , prawo zachowania masy lub zasady zachowania masy państw, które za każdym układzie zamkniętym do wszystkich przekazów materii i energii , masa układu musi być stała w czasie, gdy masa systemu nie można zmienić, więc ilość nie można dodawać ani usuwać. Dlatego ilość masy jest zachowana w czasie.
Z prawa wynika, że masy nie można ani stworzyć, ani zniszczyć, choć można ją przearanżować w przestrzeni, a byty z nią związane mogą zmienić formę. Na przykład w reakcjach chemicznych masa składników chemicznych przed reakcją jest równa masie składników po reakcji. Tak więc podczas dowolnej reakcji chemicznej i niskoenergetycznych procesów termodynamicznych w układzie izolowanym całkowita masa reagentów lub materiałów wyjściowych musi być równa masie produktów.
Pojęcie zachowania masy jest szeroko stosowane w wielu dziedzinach, takich jak chemia , mechanika i dynamika płynów . Historycznie, masowa konserwacja została wykazana w reakcjach chemicznych niezależnie przez Michaiła Łomonosowa, a później ponownie odkryta przez Antoine'a Lavoisiera pod koniec XVIII wieku. Sformułowanie tego prawa miało decydujące znaczenie w przejściu od alchemii do nowoczesnej chemii przyrodniczej .
Zasada zachowania masy obowiązuje jedynie w przybliżeniu i jest uważana za część szeregu założeń pochodzących z mechaniki klasycznej . Prawo to musi zostać zmodyfikowane, aby było zgodne z prawami mechaniki kwantowej i szczególnej teorii względności zgodnie z zasadą równoważności masy i energii , która mówi, że energia i masa tworzą jedną zachowaną ilość. W przypadku systemów bardzo energetycznych zachowanie tylko masy okazuje się nie mieć znaczenia, jak to ma miejsce w reakcjach jądrowych i anihilacji cząstek-antycząstek w fizyce cząstek elementarnych .
Masa również nie jest ogólnie zachowana w systemach otwartych . Tak jest w przypadku, gdy różne formy energii i materii są wpuszczane lub wypuszczane z systemu. Jednakże, o ile nie jest zaangażowana radioaktywność lub reakcje jądrowe, ilość energii uciekającej (lub wchodzącej) do takich systemów jak ciepło , praca mechaniczna lub promieniowanie elektromagnetyczne jest zwykle zbyt mała, aby można ją było zmierzyć jako spadek (lub wzrost) masy systemu .
W przypadku systemów, w których zaangażowane są duże pola grawitacyjne, należy wziąć pod uwagę ogólną teorię względności , gdzie zachowanie masy i energii staje się pojęciem bardziej złożonym, podlegającym różnym definicjom, a ani masa, ani energia nie są tak ściśle i prosto zachowane, jak w przypadku szczególna teoria względności.
Formuła i przykłady
Prawo zachowania masy można sformułować w mechanice klasycznej tylko wtedy, gdy skale energii związane z izolowanym układem są znacznie mniejsze niż , gdzie jest masa typowego obiektu w układzie, mierzona w układzie odniesienia, w którym znajduje się obiekt odpoczynek i jest prędkością światła .
Prawo to można sformułować matematycznie w dziedzinie mechaniki płynów i mechaniki ośrodków ciągłych , gdzie zachowanie masy jest zwykle wyrażane za pomocą równania ciągłości , podanego w postaci różniczkowej jako
gdzie to gęstość (masa na jednostkę objętości), to czas, to rozbieżność i to pole prędkości przepływu . Interpretacja równania ciągłości dla masy jest następująca: Dla danej powierzchni zamkniętej w układzie, zmiana w czasie masy zamkniętej przez powierzchnię jest równa masie, która przemierza powierzchnię, dodatnia, jeśli materia wchodzi i ujemna, jeśli sprawa gaśnie. Dla całego układu izolowanego warunek ten implikuje, że masa całkowita , suma mas wszystkich elementów układu, nie zmienia się w czasie, tj.
,
gdzie jest różniczką, która definiuje całkę po całej objętości układu.
Równanie ciągłości dla masy jest częścią równań Eulera dynamiki płynów. Wiele innych równań konwekcyjno-dyfuzyjnych opisuje zachowanie i przepływ masy i materii w danym układzie.
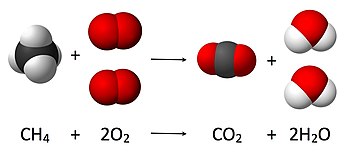
W chemii obliczanie ilości reagentów i produktów w reakcji chemicznej, czyli stechiometria , opiera się na zasadzie zachowania masy. Zasada zakłada, że podczas reakcji chemicznej całkowita masa reagentów jest równa całkowitej masie produktów. Na przykład w następującej reakcji
-
CH
4+ 2 O
2→ CO
2+ 2 godz
2O ,
gdzie cząsteczka z metanu ( CH
4) i dwie cząsteczki tlenu O
2przekształcane są w jedną cząsteczkę dwutlenku węgla ( CO
2) i dwie wody ( H
2O ). Liczbę cząsteczek powstałych w wyniku reakcji można wyprowadzić z zasady zachowania masy, ponieważ początkowo występują (jak również w stanie końcowym) cztery atomy wodoru , 4 atomy tlenu i jeden atom węgla, następnie liczba cząsteczek wody wytworzony musi być dokładnie dwa na cząsteczkę wytworzonego dwutlenku węgla.
Wiele problemów inżynierskich rozwiązywanych jest przez śledzenie rozkładu masy w czasie danego systemu, praktyka ta jest znana jako bilans masy .
Historia


Już w 520 roku pne, Jain filozofii , a nie kreacjonistów filozofii opartej na naukach Mahavira stwierdza, że wszechświat i jego składników, takich jak sprawy nie mogą być zniszczone lub tworzonych. Tekst Jain Tattvarthasutra (2nd wne) stwierdza, że dana substancja jest trwała, ale jego tryby charakteryzują tworzenia i niszczenia.
Ważną ideą starożytnej filozofii greckiej było to, że „ Nic nie pochodzi z niczego ”, tak że to, co istnieje teraz, zawsze istniało: żadna nowa materia nie może zaistnieć tam, gdzie jej wcześniej nie było. Wyraźne stwierdzenie tego, wraz z dalszą zasadą, że nic nie może przeminąć w nic, znajdujemy u Empedoklesa (ok. IV w. p.n.e.): „Niemożliwe jest bowiem, aby cokolwiek powstało z tego, co nie jest, i nie może być słyszanym lub słyszanym, że to, co jest, powinno zostać całkowicie zniszczone.
Kolejną zasadę konserwacji przedstawił Epikur około III wieku p.n.e., który opisując naturę Wszechświata napisał, że „całość rzeczy była zawsze taka, jaka jest teraz i zawsze będzie”.
Zasadę zachowania materii sformułował również Nasir al-Dīn al-Tūsī (około XIII wieku naszej ery). Pisał, że "Ciało materii nie może całkowicie zniknąć. Zmienia jedynie swoją formę, stan, skład, kolor i inne właściwości i zamienia się w inną złożoną lub elementarną materię".
Odkrycia w chemii
W XVIII wieku zasada zachowania masy podczas reakcji chemicznych była szeroko stosowana i była ważnym założeniem podczas eksperymentów, nawet zanim formalnie ustalono definicję, jak widać w pracach Josepha Blacka , Henry'ego Cavendisha i Jeana Reya . Pierwszym, który zarysował tę zasadę, był Michaił Łomonosow w 1756 r. Mógł wykazać ją eksperymentalnie iz pewnością omówił tę zasadę w 1748 r. w korespondencji z Leonhardem Eulerem , chociaż jego twierdzenie na ten temat jest czasami kwestionowane. Według sowieckiego fizyka Jakowa Dorfmana:
Prawo uniwersalne zostało sformułowane przez Łomonosowa na podstawie ogólnych filozoficznych rozważań materialistycznych, nigdy nie było przez niego kwestionowane ani testowane, ale przeciwnie, służyło mu jako solidna pozycja wyjściowa we wszystkich badaniach przez całe życie.
Bardziej wyrafinowaną serię eksperymentów przeprowadził później Antoine Lavoisier, który w 1773 r. przedstawił swój wniosek i spopularyzował zasadę zachowania masy. Demonstracje tej zasady obaliły popularną wówczas teorię flogistonu, która głosiła, że masa może zostać uzyskana lub utracona w procesach spalania i ciepła.
Zachowanie masy było niejasne przez tysiąclecia z powodu wyporu atmosfery ziemskiej na masę gazów. Na przykład kawałek drewna po spaleniu waży mniej; wydawało się to sugerować, że część jego masy znika, ulega przekształceniu lub utracie. Nie zostało to obalone, dopóki nie przeprowadzono ostrożnych eksperymentów, w których umożliwiono zachodzenie reakcji chemicznych, takich jak rdzewienie, w zamkniętych szklanych ampułkach; stwierdzono, że reakcja chemiczna nie zmieniła masy zamkniętego pojemnika i jego zawartości. Ważenie gazów za pomocą wagi nie było możliwe do czasu wynalezienia pompy próżniowej w XVII wieku.
Po zrozumieniu, zachowanie masy miało ogromne znaczenie w przejściu od alchemii do nowoczesnej chemii. Kiedy pierwsi chemicy zdali sobie sprawę, że substancje chemiczne nigdy nie zniknęły, a jedynie zostały przekształcone w inne substancje o tej samej masie, naukowcy ci mogli po raz pierwszy przystąpić do ilościowych badań przemian substancji. Idea zachowania masy oraz założenie, że pewne „substancje pierwiastkowe” również nie mogą zostać przekształcone w inne w wyniku reakcji chemicznych, doprowadziły z kolei do zrozumienia pierwiastków chemicznych , a także idei, że wszystkie procesy i przemiany chemiczne (takie jak spalanie i reakcje metaboliczne) są reakcjami pomiędzy niezmiennymi ilościami lub wagami tych pierwiastków chemicznych.
W ślad za pionierską pracą Lavoisiera wyczerpujące eksperymenty Jana Stasia potwierdziły spójność tego prawa w reakcjach chemicznych, mimo że prowadzono je z innymi intencjami. Jego badania wykazały, że w niektórych reakcjach strata lub zysk nie mogły być większe niż od 2 do 4 części na 100 000. Różnica w celności, jaką z jednej strony mierzył i osiągał Lavoisier, az drugiej Morley i Staś, jest ogromna.
Współczesna fizyka
Prawo zachowania masy zostało zakwestionowane wraz z pojawieniem się szczególnej teorii względności. W jednym z dokumentów Annus Mirabilis od Alberta Einsteina w 1905 roku zaproponował równoważność masy i energii. Teoria ta implikowała kilka twierdzeń, takich jak idea, że energia wewnętrzna systemu może przyczynić się do masy całego systemu lub że masa może zostać przekształcona w promieniowanie elektromagnetyczne . Jednak, jak zauważył Max Planck , zmiana masy w wyniku ekstrakcji lub dodania energii chemicznej, jak przewiduje teoria Einsteina, jest tak mała, że nie można jej zmierzyć dostępnymi instrumentami i nie można jej przedstawić jako testu. do szczególnej teorii względności. Einstein spekulował, że energie związane z nowo odkrytą radioaktywnością są wystarczająco znaczące w porównaniu z masą systemów je wytwarzających, aby umożliwić pomiar zmiany ich masy po usunięciu energii reakcji z systemu. Później rzeczywiście okazało się to możliwe, chociaż ostatecznie miała to być pierwsza sztuczna reakcja transmutacji jądrowej w 1932 roku, zademonstrowana przez Cockcrofta i Waltona , która okazała się pierwszym udanym testem teorii Einsteina dotyczącej utraty masy z utratą energii.
Prawo zachowania masy i analogiczne prawo zachowania energii zostały ostatecznie zniesione przez ogólniejszą zasadę znaną jako równoważność masy i energii . Szczególna teoria względności redefiniuje również pojęcie masy i energii, które mogą być używane zamiennie i odnoszą się do układu odniesienia. Kilka definicji musiało zostać zdefiniowanych dla spójności, takich jak masa spoczynkowa cząstki (masa w ramie spoczynkowej cząstki) i masa relatywistyczna (w innym układzie ). Ten ostatni termin jest zwykle rzadziej używany.
Uogólnienie
Szczególna teoria względności
W szczególnej teorii względności zasada zachowania masy nie ma zastosowania, jeśli układ jest otwarty i energia ucieka. Jednak nadal ma zastosowanie do systemów całkowicie zamkniętych (izolowanych). Jeśli energia nie może uciec z układu, jej masa nie może się zmniejszyć. W teorii względności, dopóki jakikolwiek rodzaj energii jest utrzymywany w systemie, energia ta wykazuje masę.
Ponadto należy odróżnić masę od materii , ponieważ materia może nie być doskonale zachowana w układach izolowanych, mimo że masa jest zawsze zachowana w takich układach. Jednak materia jest tak prawie zachowana w chemii, że naruszenia zachowania materii mierzono dopiero w epoce jądrowej, a założenie zachowania materii pozostaje ważną koncepcją praktyczną w większości układów w chemii i innych badaniach, które nie obejmują wysokich energii typowych dla radioaktywność i reakcje jądrowe .
Masa związana z chemicznymi ilościami energii jest zbyt mała do zmierzenia
Zmiana masy niektórych rodzajów systemów otwartych, w których atomy lub masywne cząstki nie mogą uciec, ale inne rodzaje energii (takie jak światło lub ciepło) mogą wchodzić, uciekać lub łączyć się, przeszły niezauważone w XIX wieku. ponieważ zmiana masy związana z dodaniem lub utratą niewielkich ilości energii cieplnej lub promieniowania w reakcjach chemicznych jest bardzo mała. (Teoretycznie masa w ogóle by się nie zmieniła w przypadku eksperymentów przeprowadzanych w izolowanych systemach, w których ciepło i praca nie były wpuszczane ani wyprowadzane.)
Zachowanie masy pozostaje prawidłowe, jeśli energia nie jest tracona
Zasada zachowania masy relatywistycznej implikuje punkt widzenia pojedynczego obserwatora (lub widok z pojedynczego układu inercjalnego), ponieważ zmiana układów inercjalnych może skutkować zmianą całkowitej energii (energii relatywistycznej) układów, a ta wielkość determinuje masę relatywistyczną.
Zasada, że masa układu cząstek musi być równa sumie ich mas spoczynkowych , choć prawdziwa w fizyce klasycznej, może być fałszywa w szczególnej teorii względności . Powodem, dla którego masy spoczynkowe nie można po prostu dodać jest to, że nie uwzględnia to innych form energii, takich jak energia kinetyczna i potencjalna, oraz cząstek bezmasowych, takich jak fotony, z których wszystkie mogą (lub nie) wpływać na całkowitą masę systemy.
W przypadku poruszania się masywnych cząstek w układzie, badanie mas spoczynkowych różnych cząstek sprowadza się również do wprowadzenia wielu różnych inercyjnych ram obserwacyjnych (co jest zabronione, jeśli ma być zachowana całkowita energia i pęd układu), a także gdy w układzie spoczynkowym jednego cząstki, ta procedura ignoruje pędy innych cząstek, które wpływają na masę układu, jeśli inne cząstki są w ruchu w tej ramce.
Dla specjalnego typu masy zwanego masą niezmienną , zmiana układu inercjalnego obserwacji dla całego układu zamkniętego nie ma wpływu na miarę masy niezmiennej układu, która pozostaje zarówno zachowana, jak i niezmienna (niezmienna), nawet dla różnych obserwatorów cały system. Masa niezmiennicza to układowa kombinacja energii i pędu, która jest niezmienna dla każdego obserwatora, ponieważ w każdym układzie bezwładnościowym energie i pędy różnych cząstek zawsze dodają się do tej samej wielkości (pęd może być ujemny, więc suma wynosi odejmowanie). Masa niezmiennicza jest relatywistyczną masą układu widzianego w centrum układu pędu . Jest to minimalna masa, jaką może wykazywać układ, patrząc ze wszystkich możliwych układów bezwładnościowych.
Zasada zachowania masy relatywistycznej i niezmiennej ma zastosowanie nawet do układów cząstek tworzonych przez produkcję par , gdzie energia dla nowych cząstek może pochodzić z energii kinetycznej innych cząstek lub z jednego lub więcej fotonów jako część układu, który obejmuje inne cząstki oprócz foton. Ponownie, ani relatywistyczna, ani niezmienna masa całkowicie zamkniętych (tj. izolowanych) systemów nie zmienia się, gdy tworzone są nowe cząstki. Jednak różni obserwatorzy bezwładności nie zgodzą się co do wartości tej zachowanej masy, jeśli jest to masa relatywistyczna (tj. masa relatywistyczna jest zachowana, ale nie niezmienna). Jednak wszyscy obserwatorzy są zgodni co do wartości zachowanej masy, jeśli mierzona masa jest masą niezmienną (tj. masa niezmienna jest zarówno zachowana, jak i niezmienna).
Wzór na równoważność masy i energii daje inną prognozę w układach nieizolowanych , ponieważ jeśli pozwoli się uciec energii z układu, uciekną również masa relatywistyczna i masa niezmiennicza . W tym przypadku wzór równoważności masy i energii przewiduje, że zmiana masy układu jest powiązana ze zmianą jego energii spowodowaną dodawaniem lub odejmowaniem energii: Ta forma zawierająca zmiany była formą, w której to słynne równanie zostało pierwotnie przedstawione przez Einsteina. W tym sensie zmiany masy w dowolnym systemie wyjaśnia się po prostu, jeśli weźmie się pod uwagę masę energii dodanej lub usuniętej z systemu.
Formuła implikuje, że związane systemy mają niezmienną masę (masę spoczynkową dla systemu) mniejszą niż suma ich części, jeśli pozwolono energii wiązania uciec z systemu po tym, jak system został związany. Może to nastąpić poprzez przekształcenie energii potencjalnej układu w inny rodzaj energii czynnej, taki jak energia kinetyczna lub fotony, które łatwo wymykają się z układu związanego. Różnica mas systemu, zwana defektem masy, jest miarą energii wiązania w systemach związanych – innymi słowy, energii potrzebnej do rozbicia systemu. Im większy ubytek masy, tym większa energia wiązania. Energia wiązania (która sama ma masę) musi zostać uwolniona (jako światło lub ciepło), gdy części łączą się, tworząc związany system, i to jest powód, dla którego masa związanego systemu zmniejsza się, gdy energia opuszcza system. Całkowita niezmienna masa jest faktycznie zachowana, gdy weźmie się pod uwagę masę energii wiązania, która uciekła.
Ogólna teoria względności
W ogólnej teorii względności całkowita niezmienna masa fotonów w rozszerzającej się objętości przestrzeni zmniejszy się z powodu przesunięcia ku czerwieni takiego rozszerzenia. Zachowanie zarówno masy, jak i energii zależy zatem od różnych poprawek wprowadzonych do energii w teorii, ze względu na zmieniającą się energię potencjalną grawitacji takich układów.
Zobacz też
- Ochrona ładunku
- Prawo konserwatorskie
- Prawa dyfuzji Ficka
- Prawo określonych proporcji
- Prawo wielu proporcji













