Diamentowa - Diamondoid
W chemii diamondoids są warianty węgla cząsteczki klatki zwanej adamantanu (C 10 H 16 ), przy czym najmniejsza strukturę siatkową jednostka diament sieci krystalicznej . Diamentoidy znane również jako nanodiamenty lub skondensowane adamantany mogą zawierać jedną lub więcej klatek (adamantan, diamantan , triamantan i wyższe polimantany), a także liczne izomeryczne i strukturalne warianty adamantanów i polimantanów. Te diamentoidy występują naturalnie w ropie naftowejosady i zostały wyekstrahowane i oczyszczone w duże czyste kryształy cząsteczek polimantanu, mające ponad tuzin klatek adamantanowych w cząsteczce. Gatunki te są interesujące jako przybliżenia molekularne sześciennego szkieletu diamentu , zakończonego wiązaniami CH. Cykloheksamantan można traktować jako diament wielkości nanometra o około5,6 x 10 -22 g .
Przykłady
Przykłady obejmują:
- Adamantan (C 10 H 16 )
- Icean (C 12 H 18 )
- BC-8 (C 14 H 20 )
- Diamantan (C 14 H 20 ) również diadamantan , dwie klatki z fuzją twarzową
- Triamantane (C 18 H 24 ), a także triadamantane . Diamantan ma cztery identyczne powierzchnie czołowe do zakotwienia nowej jednostki C 4 H 4 .
- Isotetramantane (C 22 H 28 ). Triamantane osiem powierzchnie, na który nowy C 4 H 4 urządzenie może być dodane wynikające z czterech izomerów . Jeden z tych izomerów wykazuje skręt spiralny i dlatego jest prochiralny . W P i M enancjomery zostały rozdzielone.
- Pentamantan ma dziewięć izomerów o wzorze chemicznym C 26 H 32 i istnieje jeszcze jeden pentamantan o wzorze chemicznym C 25 H 30
- Cyclohexamantane (C 26 H 30 )
- Superadamantan (C 30 H 36 )
Jeden izomer tetramantanu jest największym kiedykolwiek diamentoidem wytworzonym w wyniku syntezy organicznej przy użyciu reakcji keto-karbenoidowej do przyłączenia pierścieni cyklopentanowych. Dłuższe diamentoidy powstały z kwasu dikarboksylowego diamantanu. Pierwsza w historii izolacja szerokiej gamy diamentoidów z ropy naftowej odbyła się w następujących etapach: destylacja próżniowa w temperaturze powyżej 345 °C, równoważna temperatura wrzenia atmosferycznego , a następnie piroliza w temperaturze 400–450 °C w celu usunięcia wszystkich niediamentoidalnych związki (diamondoidy są termodynamicznie bardzo stabilne i przetrwają tę pirolizę), a następnie szereg technik rozdzielania metodą wysokosprawnej chromatografii cieczowej .
W jednym badaniu związek tetramantanowy jest wyposażony w grupy tiolowe w pozycjach przyczółka. Pozwala to na ich zakotwiczenie na złotej powierzchni i tworzenie samoorganizujących się monowarstw (diament na złocie). Dodatkowo zaproponowano funkcjonalizowane diamentoidy ( adamantany ) jako molekularne elementy budulcowe dla samoorganizujących się kryształów molekularnych .
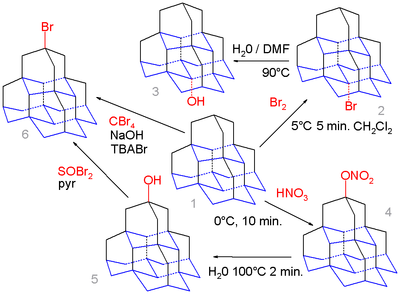
Chemia organiczna diamentoidów rozciąga się nawet na pentamantan . Stanowisko przyśrodkowej (zasada) w tej cząsteczce (izomer [1 (2,3) 4] pentamantane) oblicza się w celu uzyskania korzystniejszego karbokationu od pozycji szczytowej (na górze) i proste bromowanie z pentamane 1 z bromu wyłącznie daje przyśrodkowej bromopochodna 2, która po hydrolizie w wodzie i DMF tworzy alkohol 3 .
W przeciwieństwie nitroxylation od 1 z kwasu azotowego daje wierzchołkową azotan 4 jako związku pośredniego, który poddano hydrolizie do wierzchołkowej alkoholu 5 ze względu na wyższą zawady zapotrzebowanie aktywnego elektrofilowym NO−
2HNO+
3gatunek. Alkohol ten może reagować z bromkiem tionylu do bromku 6 iw szeregu etapów (nie pokazanych) do odpowiedniego tiolu . Pentamantan może również reagować z tetrabromometanem i bromkiem tetra- n- butyloamoniowym (TBABr) w reakcji wolnorodnikowej do bromku, ale bez selektywności.
Pochodzenie i występowanie diamentoidów
Diamentoidy znajdują się w dojrzałych wysokotemperaturowych płynach naftowych (olejach lotnych, kondensatach i wilgotnych gazach). Te płyny mogą zawierać do łyżki diamentoidów na galon amerykański (3,78 litra). Przegląd dokonany przez Mello i Moldowan w 2005 r. wykazał, że chociaż węgiel w diamentach nie ma pochodzenia biologicznego, diamentoidy znajdujące się w ropie naftowej składają się z węgla ze źródeł biologicznych. Zostało to określone przez porównanie stosunków obecnych izotopów węgla .
Właściwości optyczne i elektroniczne
Absorpcji optycznej dla diamondoids leży głęboko w nadfioletowego obszaru widma z optycznym pasma wzbronione około 6 elektronowolt wyżej. Stwierdzono, że widmo każdego diamentoidu odzwierciedla jego indywidualny rozmiar, kształt i symetrię . Ze względu na dobrze zdefiniowany rozmiar i strukturę diamentoidy służą również jako system modelowy do obliczeń struktury elektronicznej.
Wiele z właściwości optoelektronicznych diamentoidów jest determinowanych przez różnicę w naturze najwyżej obsadzonych i najniższych nieobsadzonych orbitali molekularnych : pierwszy jest stanem objętościowym , podczas gdy drugi jest stanem powierzchniowym . W rezultacie energia najniższego niezajętego orbitalu molekularnego jest z grubsza niezależna od wielkości diamentoidu.
Odkryto, że diamenty wykazują ujemne powinowactwo do elektronów , co czyni je potencjalnie użytecznymi w urządzeniach z emisją elektronów.
Nanotechnologia
- W kontekście hipotetycznych materiałów budulcowych do komponentów nanotechnologicznych , „diamondoid” został użyty przez K. Erica Drexlera w odniesieniu do struktur przypominających diament w szerokim tego słowa znaczeniu: silnych, sztywnych struktur zawierających gęste, trójwymiarowe sieci wiązań kowalencyjnych , utworzone głównie z atomy pierwszego i drugiego okresu o wartościowości trzech lub więcej. Przykłady obejmowałyby krystaliczny diament , szafir i inne sztywne struktury podobne do diamentu, ale z różnymi podstawieniami atomów, które mogą obejmować azot , tlen , krzem , siarkę i tak dalej.
- Zaproponowano pochodne adamantanu jako funkcjonalizującą cząsteczkę do ulepszania technologii sekwencjonowania DNA opartych na tunelowaniu elektronów .
Zobacz też
- Inne związki diamentopodobne: azotek boru
- Abiogenne pochodzenie ropy naftowej
Bibliografia
Zewnętrzne linki
- Grupa Badawcza Klastrów i Nanokryształów, Technische Universität Berlin
- Technologie diamentów molekularnych, Chevron Texaco
- Nanotechnologia i nadejście epoki diamentów
- Laserowa spektroskopia Ramana i modelowanie diamentów
- Elektroniczne i optyczne właściwości diamentów (do pobrania za darmo)
- Cząsteczki diamentowe: z zastosowaniami w biomedycynie, materiałoznawstwie, nanotechnologii i naftoznawstwie
- Złote nanoszczeliny z funkcją diamentoidów jako czujniki dla naturalnych, zmutowanych i zmodyfikowanych epigenetycznie nukleotydów DNA