Morfolino - Morpholino
Morfolino , znany również jako oligomer morfolinowych oraz jako fosforodiamidowe morfolino oligomeru (PMO), to rodzaj oligomer cząsteczki (potocznie An oligo ) stosowanych w biologii molekularnej do zmiany ekspresji genu . Jego struktura molekularna zawiera zasady DNA przyłączone do szkieletu pierścieni metylenomorfolinowych połączonych grupami fosforodiamidowymi . Morfolino blokują dostęp innych cząsteczek do małych (~25 zasad) specyficznych sekwencji powierzchni parowania zasad kwasu rybonukleinowego (RNA). Morfolino są wykorzystywane jako narzędzia badawcze w genetyce odwrotnej poprzez osłabianie funkcji genów.
W tym artykule omówiono tylko antysensowne oligomery Morfolino, które są analogami kwasów nukleinowych . Słowo „Morfolino” może występować w innych nazwach chemicznych, odnosząc się do związków chemicznych zawierających sześcioczłonowy pierścień morfolinowy . Aby uniknąć pomyłek z innymi cząsteczkami zawierającymi morfolinę, przy opisie oligonukleotydów „Morfolino” jest często pisane wielką literą jako nazwa handlowa , ale to użycie nie jest spójne w całej literaturze naukowej. Morfolino oligos są czasami określane jako PMO (od fosforodiamidowego oligomeru morfolino), zwłaszcza w literaturze medycznej. Vivo-Morfolinos i PPMO to zmodyfikowane formy Morfolino z grupami chemicznymi kowalencyjnie przyłączonymi w celu ułatwienia wejścia do komórek.
Knockdown genu osiąga się poprzez zmniejszenie ekspresji określonego genu w komórce. W przypadku genów kodujących białka prowadzi to zwykle do zmniejszenia ilości odpowiedniego białka w komórce. Obniżenie ekspresji genów to metoda poznania funkcji konkretnego białka; w podobny sposób, spowodowanie splicingu specyficznego egzonu z transkryptu RNA kodującego białko może pomóc w określeniu funkcji ugrupowania białkowego kodowanego przez ten egzon lub może czasami całkowicie obniżyć aktywność białka. Cząsteczki te zastosowano w badaniach kilku organizmów modelowych , w tym myszy , danio pręgowanego , żab i jeżowców . Morfoliny można modyfikować splicingu z pre-mRNA lub hamuje dojrzewanie i aktywność miRNA. Techniki kierowania Morfolino do RNA i dostarczania Morfolino do komórek zostały niedawno omówione w artykule w czasopiśmie oraz w formie książkowej.
Morfolino są opracowywane jako farmaceutyczne środki lecznicze skierowane przeciwko organizmom chorobotwórczym , takim jak bakterie lub wirusy oraz chorobom genetycznym . Lek eteplirsen na bazie Morfolino z Sarepta Therapeutics otrzymał we wrześniu 2016 r. przyspieszoną zgodę amerykańskiej Agencji ds. Żywności i Leków na leczenie niektórych mutacji powodujących dystrofię mięśni Duchenne'a , chociaż proces zatwierdzania był ugrzęzły w kontrowersji. Kolejny lek golodirsen oparty na Morfolino (również w przypadku dystrofii mięśniowej Duchenne'a) został zatwierdzony przez FDA w grudniu 2019 roku.
Historia
Morfolino oligo zostały wymyślone przez Summertona ( Gene Tools ) w AntiVirals Inc. (obecnie Sarepta Therapeutics) i pierwotnie opracowane we współpracy z Wellerem.
Struktura
Morfolino to syntetyczne cząsteczki, które są produktem przeprojektowania struktury naturalnego kwasu nukleinowego . Zwykle mają długość 25 zasad, wiążą się z komplementarnymi sekwencjami RNA lub jednoniciowego DNA przez standardowe parowanie zasad kwasów nukleinowych . Jeśli chodzi o strukturę, to różnica pomiędzy Morfoliny i DNA, jest to, że podczas Morfoliny mają standardowe zasady kwasów nukleinowych, te zasady są związane metylenu morfoliny pierścienie połączone poprzez fosforodiamidowe grup zamiast fosforanów . Rysunek porównuje struktury dwóch przedstawionych tam nici, jednej RNA i drugiej Morfolino. Zastąpienie anionowych fosforanów nienaładowanymi grupami fosforodiamidowymi eliminuje jonizację w zwykłym fizjologicznym zakresie pH , więc Morfolino w organizmach lub komórkach są cząsteczkami nienaładowanymi. Z tych zmodyfikowanych podjednostek zbudowany jest cały szkielet Morpholino.
Funkcjonować
Morfolino nie powoduje degradacji swoich docelowych cząsteczek RNA, w przeciwieństwie do wielu antysensownych typów strukturalnych (np. tiofosforany , siRNA ). Zamiast tego Morfolino działają poprzez „blokowanie steryczne”, wiążąc się z sekwencją docelową w RNA, hamując cząsteczki, które w przeciwnym razie mogłyby oddziaływać z RNA. Morfolino oligos są często wykorzystywane do badania roli specyficznego transkryptu mRNA w zarodku . Rozwojowe biolodzy oligonukleotydów wstrzyknąć do jaj lub morfolino zarodków danio , PLATANA SZPONIASTA ( Xenopus ) jeżowca oraz killifish ( F. heteroclitus ) wytwarzanie morphant zarodków, lub elektroporacji Morfoliny język kurzych zarodków w późniejszych stadiach rozwoju. Dzięki odpowiednim cytozolowym systemom dostarczania Morfolino są skuteczne w hodowli komórkowej . Vivo-Morfolinos, w którym oligo jest kowalencyjnie związany z dendrymerem dostarczającym , wnikają do komórek przy podawaniu ogólnoustrojowym dorosłym zwierzętom lub w kulturach tkankowych.
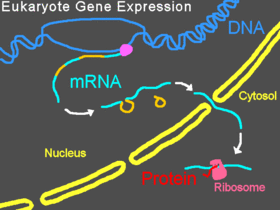
Prawidłowa ekspresja genów u eukariontów
W organizmach eukariotycznych pre-mRNA ulega transkrypcji w jądrze, introny są wyplatane , a następnie dojrzały mRNA jest eksportowany z jądra do cytoplazmy . Mała podjednostka rybosomu zwykle zaczyna się wiązaniem na końcu 5' mRNA i jest tam połączona różnymi innymi eukariotycznymi czynnikami inicjacji , tworząc kompleks inicjacyjny. Zapoczątkowanie złożone skanuje wzdłuż nici mRNA, aż osiągnie kodon startu , a następnie Duża podjednostka przyłączeń rybosomu do małej podjednostki i translacji z białka rozpoczyna się. Cały ten proces jest określany jako ekspresja genów; jest to proces, w którym informacja w genie , zakodowana jako sekwencja zasad w DNA , jest przekształcana w strukturę białka. Morfolino może modyfikować splicing, blokować translację lub blokować inne funkcjonalne miejsca na RNA w zależności od sekwencji zasad Morfolino.
Blokowanie tłumaczenia
Związane z nieulegającym translacji regionem 5' informacyjnego RNA (mRNA), morfoliny mogą zakłócać progresję rybosomalnego kompleksu inicjującego od czapeczki 5' do kodonu start. Zapobiega to translacji regionu kodującego docelowego transkryptu (tzw. „ knock down ” ekspresji genu ). Jest to przydatne eksperymentalnie, gdy badacz chce poznać funkcję konkretnego białka; Morfolino zapewniają wygodny sposób na obniżenie ekspresji białka i poznanie, w jaki sposób to osłabienie zmienia komórki lub organizm. Niektóre Morfolino tłumią ekspresję tak skutecznie, że po degradacji wcześniej istniejących białek, docelowe białka stają się niewykrywalne metodą Western blot .
W 2016 roku stwierdzono, że syntetyczny PMO sprzężony z peptydem (PPMO) hamuje ekspresję metalo-beta-laktamazy z New Delhi , enzymu używanego przez wiele lekoopornych bakterii do niszczenia karbapenemów.
Modyfikowanie splicingu pre-mRNA
Morfolino może zakłócać etapy przetwarzania pre-mRNA albo poprzez zapobieganie wiązaniu małych jądrowych kompleksów rybonukleoproteinowych ( snRNP ) kierujących splicingiem z ich celami na granicach intronów na nici pre-mRNA lub poprzez blokowanie nukleofilowej zasady adeninowej i zapobieganie jej z tworzenia struktury lariatu splicingowego lub przez zakłócanie wiązania białek regulatorowych splicingu, takich jak tłumiki splicingowe i wzmacniacze splicingowe . Zapobieganie wiązaniu snRNP U1 (w miejscu donorowym) lub U2 / U5 (w ugrupowaniu polipirymidynowym i miejscu akceptorowym) może powodować zmodyfikowany splicing , zwykle wykluczający eksony z dojrzałego mRNA. Celowanie w niektóre cele splicingowe powoduje inkluzje intronowe, podczas gdy aktywacja ukrytych miejsc splicingowych może prowadzić do częściowych inkluzji lub wykluczeń. Cele snRNP U11 / U12 mogą być również blokowane. Modyfikacja splicingu może być dogodnie testowana za pomocą reakcji łańcuchowej polimerazy z odwrotną transkryptazą ( RT-PCR ) i jest postrzegana jako przesunięcie pasma po elektroforezie żelowej produktów RT-PCR.
Inne zastosowania: blokowanie innych miejsc mRNA i użycie jako sond
Morfolino zostały wykorzystane do blokowania aktywności i dojrzewania miRNA . Morfolino znakowane fluoresceiną w połączeniu z przeciwciałami specyficznymi dla fluoresceiny można stosować jako sondy do hybrydyzacji in situ do miRNA. Morfolino mogą blokować aktywność rybozymu . Funkcje snRNP U2 i U12 zostały zahamowane przez Morfolino. Morfolino ukierunkowane na „śliskie” sekwencje mRNA w obrębie regionów kodujących białka mogą indukować translacyjne przesunięcia ramki odczytu . Morfolino może blokować edycję RNA, ogonowanie poli-A i sekwencje translokacji. Aktywność Morfolino przeciwko tym różnorodnym celom sugeruje, że Morfolino można stosować jako narzędzie ogólnego przeznaczenia do blokowania interakcji białek lub kwasów nukleinowych z mRNA.
Specyficzność, stabilność i efekty nieantysensowne
Morfolino stały się standardowym narzędziem knockdown w zwierzęcych układach embrionalnych , które mają szerszy zakres ekspresji genów niż komórki dorosłe i mogą być silnie dotknięte przez interakcje poza celem. Po wstępnych wstrzyknięciach do zarodków żab lub ryb w stadium jednokomórkowym lub kilkukomórkowym, efekty Morfolino można zmierzyć do pięciu dni później, po tym, jak większość procesów organogenezy i różnicowania minęło, a obserwowane fenotypy są zgodne z genem docelowym ogłuszający. Kontrolne oligonukleotydy z nieistotnymi sekwencjami zwykle nie powodują zmian w embrionalnym fenotypie, co jest dowodem na specyficzność sekwencji Morfolino oligo i brak efektów nieantysensownych. Dawkę wymaganą do knockdown można zmniejszyć przez jednoczesne wstrzyknięcie kilku Morfolino oligos celujących w ten sam mRNA, co jest skuteczną strategią zmniejszania lub eliminowania zależnych od dawki interakcji poza docelowym RNA.
Eksperymenty z ratowaniem mRNA mogą czasami przywrócić zarodkom fenotyp typu dzikiego i dostarczyć dowodów na specyficzność Morfolino. W ratowaniu mRNA, Morfolino jest wstrzykiwane razem z mRNA, które koduje białko morfolino. Jednak ratowniczy mRNA ma zmodyfikowany 5'-UTR (region nieulegający translacji), tak że ratowniczy mRNA nie zawiera celu dla Morfolino. Region kodujący ratunkowego mRNA koduje białko będące przedmiotem zainteresowania. Translacja ratunkowego mRNA zastępuje produkcję białka, które zostało stłumione przez Morfolino. Ponieważ ratunkowe mRNA nie wpłynęłoby na zmiany fenotypowe z powodu modulacji ekspresji genu poza docelowym Morfolino, ten powrót do fenotypu typu dzikiego jest kolejnym dowodem na specyficzność Morfolino. W niektórych przypadkach ektopowa ekspresja ratunkowego RNA uniemożliwia odzyskanie fenotypu typu dzikiego.
W embrionach Morfolino można przetestować na mutantach zerowych, aby sprawdzić nieoczekiwane interakcje RNA, a następnie zastosować w zarodku typu dzikiego w celu ujawnienia fenotypu ostrego knockdown. Fenotyp knockdown jest często bardziej ekstremalny niż fenotyp zmutowany; u mutanta skutki utraty genu zerowego można ukryć przez kompensację genetyczną.
Ze względu na ich całkowicie nienaturalny szkielet, Morfolino nie są rozpoznawane przez białka komórkowe. Nukleazy nie degradują Morfolino, ani nie są degradowane w surowicy ani w komórkach.
Wydaje się, że do 18% Morfolinos indukuje fenotypy niezwiązane z celem, w tym śmierć komórek w ośrodkowym układzie nerwowym i tkankach somitów zarodków danio pręgowanego . Większość z tych efektów jest spowodowana aktywacją apoptozy za pośrednictwem p53 i może być stłumiona przez jednoczesne wstrzyknięcie anty-p53 Morfolino wraz z eksperymentalnym Morfolino. Co więcej, apoptotyczny efekt, w którym pośredniczy p53 z knockdown Morfolino, został fenokopiowany przy użyciu innego antysensownego typu strukturalnego, pokazując, że apoptoza, w której pośredniczy p53, jest konsekwencją utraty docelowego białka, a nie konsekwencją typu knockdown oligo. Wydaje się, że te efekty są specyficzne dla sekwencji; jak w większości przypadków, jeśli Morfolino jest powiązane z efektami innymi niż cel, niedopasowanie 4 zasad Morfolino nie wywoła tych efektów.
Powodem do niepokoju w stosowaniu Morfolinos jest możliwość wystąpienia efektów „poza celami”. To, czy obserwowany fenotyp morfanta jest spowodowany zamierzonym knockdown, czy interakcją z poza docelowym RNA, można często rozwiązać na zarodkach, przeprowadzając kolejne eksperymenty w celu potwierdzenia, że obserwowany fenotyp morfanta wynika z knockdown oczekiwanego celu. Można tego dokonać poprzez zrekapitulowanie fenotypu morfantu drugim, niepokrywającym się Morfolino, którego celem jest to samo mRNA, poprzez potwierdzenie zaobserwowanych fenotypów przez porównanie ze szczepem zmutowanym (chociaż kompensacja zaciemni fenotyp u niektórych mutantów), testując Morfolino na tle mutacji zerowej w celu wykrycia dodatkowych zmian fenotypowych lub metodami dominująco-negatywnymi. Jak wspomniano powyżej, ratowanie obserwowanych fenotypów przez jednoczesne wstrzyknięcie ratowniczego mRNA jest, jeśli to możliwe, wiarygodnym testem specyficzności Morfolino.
Dostawa
Aby Morfolino było skuteczne, musi być dostarczone przez błonę komórkową do cytozolu komórki. Po dostaniu się do cytozolu, Morfolinos swobodnie dyfundują między cytozolem a jądrem, co wykazano poprzez aktywność modyfikującą splot jądrowy Morfolinos obserwowaną po mikroiniekcji do cytozolu komórek. Do dostarczania do zarodków, do hodowanych komórek lub do dorosłych zwierząt stosuje się różne metody. Aparat do mikroiniekcji jest zwykle używany do dostarczania do zarodka, przy czym iniekcje wykonuje się najczęściej na etapie jednokomórkowym lub kilkukomórkowym; alternatywną metodą dostarczania embrionalnego jest elektroporacja , która może dostarczyć oligonukleotydy do tkanek w późniejszych stadiach embrionalnych. Powszechne techniki dostarczania do hodowanych komórek obejmują peptyd Endo-Porter (który powoduje uwalnianie Morfolino z endosomów ), specjalny system dostarczania (nie jest już dostępny w handlu, wykorzystuje heterodupleks Morfolino-DNA i etoksylowany odczynnik dostarczający polietylenoiminę ), elektroporację lub ładowanie zgarniające.
Dostarczanie do tkanek dorosłych jest zwykle trudne, chociaż istnieje kilka systemów umożliwiających użyteczny wychwyt niezmodyfikowanych Morpholino oligos (w tym wychwyt do komórek mięśniowych z dystrofią mięśniową Duchenne'a lub komórek śródbłonka naczyń obciążonych podczas angioplastyki balonowej ). Chociaż skutecznie przenikają przez przestrzenie międzykomórkowe w tkankach, nieskoniugowane PMO mają ograniczoną dystrybucję do przestrzeni cytozolu i jądra w zdrowych tkankach po podaniu dożylnym. Dostarczanie ogólnoustrojowe do wielu komórek w organizmach dorosłych można osiągnąć za pomocą kowalencyjnych koniugatów Morfolino oligo z peptydami penetrującymi komórki , i chociaż toksyczność jest związana z umiarkowanymi dawkami koniugatów peptydowych, są one stosowane in vivo do skutecznego dostarczania oligonukleotydów w dawki poniżej tych, które powodują zaobserwowaną toksyczność. Dendrymer okta-guanidynowy dołączony do końca Morfolino może dostarczyć zmodyfikowany oligo (zwany Vivo-Morfolino) z krwi do cytozolu. Morfolino z funkcją dostarczania, takie jak koniugaty peptydów i Vivo-Morfolino, są obiecujące jako terapeutyki chorób wirusowych i genetycznych.
Zobacz też
Bibliografia
Dalsza lektura
- Wiley-Liss, Inc. Wydanie specjalne: Morpholino Gene Knockdowns of genesis Tom 30, wydanie 3 strony 89-200 (lipiec 2001) . Jest to specjalne wydanie Genesis, które składa się z serii recenzowanych, krótkich artykułów, w których wykorzystano knock down funkcji genów Morfolino w różnych systemach hodowli zwierzęcej i tkankowej.
- „Peptydowe kwasy nukleinowe, morfoliny i pokrewne antysensowne biomolekuły”. wyd. Janson i podczas (Springer, 2007)
- Moultona J (2007). „Korzystanie z Morfolinos do kontroli ekspresji genów (Rozdział 4.30)” . W Beaucage S (red.). Aktualne protokoły w chemii kwasów nukleinowych . New Jersey: John Wiley & Sons, Inc. ISBN 978-0-471-24662-6.