Podstawowa transkrypcja - Primary transcript

Pierwotny transkrypt jest jednoniciowy kwas rybonukleinowy ( RNA ) produkt otrzymuje się poprzez transkrypcję z DNA i przetwarzany z wytworzeniem różnych produktów, takich jak dojrzały RNA, mRNA , tRNA , i rRNA . Pierwotne transkrypty oznaczone jako mRNA są modyfikowane w przygotowaniu do translacji . Na przykład prekursorowe mRNA ( pre-mRNA ) jest rodzajem pierwotnego transkryptu, który po przetworzeniu staje się informacyjnym RNA (mRNA) .
Pre-mRNA jest syntetyzowane z matrycy DNA w jądrze komórkowym na drodze transkrypcji . Pre-mRNA zawiera większość heterogenicznego jądrowego RNA ( hnRNA ). Po całkowitym przetworzeniu pre-mRNA określa się je mianem „ dojrzałego informacyjnego RNA ” lub po prostu „informacyjnego RNA ”. Termin hnRNA jest często używany jako synonim pre-mRNA, chociaż w ścisłym sensie hnRNA może zawierać transkrypty jądrowego RNA, które nie kończą jako cytoplazmatyczny mRNA.
Istnieje kilka kroków przyczyniających się do wytworzenia pierwotnych transkryptów. Wszystkie te etapy obejmują serię interakcji dla inicjacji i zakończenia transkrypcji DNA w jądrze w komórkach eukariotycznych . Pewne czynniki odgrywają kluczową rolę w aktywacji i hamowaniu transkrypcji, gdzie regulują pierwotną produkcję transkrypcji. Transkrypcja wytwarza pierwotne transkrypty, które są dalej modyfikowane przez kilka procesów. Te procesy obejmują czapkę 5 ' , 3'-poliadenylację i alternatywny splicing . W szczególności alternatywny splicing bezpośrednio przyczynia się do różnorodności mRNA znajdującego się w komórkach. Modyfikacje pierwotnych transkryptów były dalej badane w badaniach w celu uzyskania większej wiedzy na temat roli i znaczenia tych transkryptów. Badania eksperymentalne oparte na zmianach molekularnych w pierwotnych transkryptach oraz procesach przed i po transkrypcji doprowadziły do lepszego zrozumienia chorób związanych z pierwotnymi transkryptami.
Produkcja
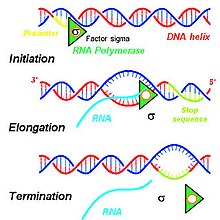
Kroki przyczyniające się do produkcji pierwotnych transkryptów obejmują szereg interakcji molekularnych, które inicjują transkrypcję DNA w jądrze komórki. W zależności od potrzeb danej komórki, określone sekwencje DNA są transkrybowane w celu wytworzenia różnorodnych produktów RNA, które mają zostać przetłumaczone na funkcjonalne białka do użytku komórkowego. Aby zainicjować proces transkrypcji w jądrze komórki, podwójne helisy DNA są rozwijane, a wiązania wodorowe łączące kompatybilne kwasy nukleinowe DNA są rozrywane, tworząc dwie niepołączone pojedyncze nici DNA. Jedna nić matrycy DNA jest używana do transkrypcji jednoniciowego mRNA pierwotnego transkryptu. Ta nić DNA jest związana przez polimerazę RNA w regionie promotorowym DNA.
U eukariontów trzy rodzaje RNA - rRNA , tRNA i mRNA - są wytwarzane w oparciu o aktywność trzech różnych polimeraz RNA, podczas gdy u prokariotów istnieje tylko jedna polimeraza RNA, która tworzy wszystkie rodzaje cząsteczek RNA. Polimeraza RNA II eukariontów dokonuje transkrypcji pierwotnego transkryptu, transkryptu przeznaczonego do przetworzenia na mRNA, z antysensownej matrycy DNA w kierunku od 5 'do 3', a ten nowo zsyntetyzowany pierwotny transkrypt jest komplementarny do antysensownej nici DNA. Polimeraza RNA II konstruuje pierwotny transkrypt przy użyciu zestawu czterech specyficznych reszt monofosforanowych rybonukleozydów ( monofosforan adenozyny (AMP), monofosforan cytydyny (CMP), monofosforan guanozyny (GMP) i monofosforan urydyny (UMP)), które są dodawane w sposób ciągły do 3 ' grupa hydroksylowa na końcu 3 'rosnącego mRNA.
Badania pierwotnych transkryptów wytwarzanych przez polimerazę RNA II ujawniają, że przeciętny pierwotny transkrypt ma 7 000 nukleotydów długości, a niektóre rosną nawet do 20 000 nukleotydów. Włączenie sekwencji egzonu i intronu do pierwotnych transkryptów wyjaśnia różnicę wielkości między większymi pierwotnymi transkryptami a mniejszym, dojrzałym mRNA gotowym do translacji na białko.
Rozporządzenie
Szereg czynników przyczynia się do aktywacji i hamowania transkrypcji, a zatem reguluje wytwarzanie pierwotnych transkryptów z danej matrycy DNA.
Aktywacja aktywności polimerazy RNA w celu wytworzenia pierwotnych transkryptów jest często kontrolowana przez sekwencje DNA zwane wzmacniaczami . Czynniki transkrypcyjne , białka, które wiążą się z elementami DNA, aby aktywować lub hamować transkrypcję, wiążą się ze wzmacniaczami i rekrutują enzymy, które zmieniają składniki nukleosomów , powodując, że DNA jest mniej lub bardziej dostępne dla polimerazy RNA. Unikalne kombinacje czynników aktywujących lub hamujących transkrypcję, które wiążą się z regionami DNA wzmacniacza, decydują o tym, czy gen, z którym oddziałuje wzmacniacz, jest aktywowany do transkrypcji, czy nie. Aktywacja transkrypcji zależy od tego, czy kompleks wydłużania transkrypcji, składający się z różnych czynników transkrypcyjnych, może indukować dysocjację polimerazy RNA od kompleksu Mediator, który łączy region wzmacniacza z promotorem.
Hamowanie aktywności polimerazy RNA może być również regulowane przez sekwencje DNA zwane wyciszaczami . Podobnie jak wzmacniacze, wyciszacze mogą znajdować się w lokalizacjach dalej w górę lub w dół od genów, które regulują. Te sekwencje DNA wiążą się z czynnikami, które przyczyniają się do destabilizacji kompleksu inicjacyjnego wymaganego do aktywacji polimerazy RNA, a zatem hamują transkrypcję.
Modyfikacja histonów przez czynniki transkrypcyjne jest kolejnym kluczowym czynnikiem regulującym transkrypcję przez polimerazę RNA. Ogólnie czynniki prowadzące do acetylacji histonów aktywują transkrypcję, podczas gdy czynniki prowadzące do deacetylacji histonów hamują transkrypcję. Acetylacja histonów wywołuje odpychanie między ujemnymi składnikami w nukleosomach, umożliwiając dostęp polimerazy RNA. Deacetylacja histonów stabilizuje ciasno zwinięte nukleosomy, hamując dostęp polimerazy RNA. Oprócz wzorców acetylacji histonów, wzorce metylacji w regionach promotorowych DNA mogą regulować dostęp polimerazy RNA do danej matrycy. Polimeraza RNA jest często niezdolna do syntezy pierwotnego transkryptu, jeśli region promotorowy docelowego genu zawiera specyficzne metylowane cytozyny - reszty, które utrudniają wiązanie czynników aktywujących transkrypcję i rekrutują inne enzymy do stabilizacji ściśle związanej struktury nukleosomu, wykluczając dostęp do polimerazy RNA i zapobiegając produkcja pierwotnych transkryptów.
Pętle R.
Pętle R powstają podczas transkrypcji. Pętla R to trójniciowa struktura kwasu nukleinowego zawierająca region hybrydowy DNA-RNA i powiązany z nim nie-matrycowy jednoniciowy DNA. Aktywnie transkrybowane regiony DNA często tworzą pętle R, które są podatne na uszkodzenia DNA . Introny zmniejszają tworzenie się pętli R i uszkodzenia DNA w genach drożdży o wysokiej ekspresji.
Przetwarzanie RNA
Transkrypcja, silnie regulowana faza ekspresji genów, wytwarza pierwotne transkrypty. Jednak transkrypcja jest tylko pierwszym krokiem, po którym powinno nastąpić wiele modyfikacji dających funkcjonalne formy RNA. Inaczej mówiąc, nowo zsyntetyzowane pierwotne transkrypty są modyfikowane na kilka sposobów w celu przekształcenia ich w ich dojrzałe, funkcjonalne formy w celu wytworzenia różnych białek i RNA, takich jak mRNA, tRNA i rRNA.
Przetwarzanie
Podstawowy proces modyfikacji pierwotnego transkryptu jest podobny dla tRNA i rRNA zarówno w komórkach eukariotycznych, jak i prokariotycznych. Z drugiej strony, pierwotne przetwarzanie transkryptu różni się w mRNA komórek prokariotycznych i eukariotycznych. Na przykład niektóre prokariotyczne bakteryjne mRNA służą jako matryce do syntezy białek w tym samym czasie, gdy są one wytwarzane na drodze transkrypcji. Alternatywnie, pre-mRNA komórek eukariotycznych podlega szerokiemu zakresowi modyfikacji przed ich transportem z jądra do cytoplazmy, gdzie ulegają translacji ich dojrzałe formy. Te modyfikacje są odpowiedzialne za różne typy zakodowanych wiadomości, które prowadzą do tłumaczenia różnych typów produktów. Ponadto pierwotna obróbka transkryptu zapewnia kontrolę ekspresji genów, a także mechanizm regulacyjny dla szybkości degradacji mRNA. Przetwarzanie pre-mRNA w komórkach eukariotycznych obejmuje czapeczkę 5 ' , poliadenylację 3' i alternatywny splicing .
5 'zamknięcie
Krótko po zainicjowaniu transkrypcji u eukariontów, koniec 5 'pre-mRNA jest modyfikowany przez dodanie czapeczki 7-metyloguanozynowej , znanej również jako czapeczka 5'. Modyfikacja 5 'czapeczki jest inicjowana przez dodanie GTP do 5' końcowego nukleotydu pre-mRNA w odwrotnej orientacji, po czym następuje dodanie grup metylowych do reszty G. Czapeczka 5 'jest niezbędna do produkcji funkcjonalnych mRNA, ponieważ czapeczka 5' jest odpowiedzialna za dopasowanie mRNA do rybosomu podczas translacji.
Poliadenylacja
U eukariotów poliadenylacja dodatkowo modyfikuje pre-mRNA, podczas którego dodaje się strukturę zwaną ogonem poli-A . Sygnały poliadenylacji, które obejmują kilka elementów sekwencji RNA, są wykrywane przez grupę białek, które sygnalizują dodanie ogona poli-A (o długości około 200 nukleotydów). Reakcja poliadenylacji dostarcza sygnału do końca transkrypcji i ta reakcja kończy się w przybliżeniu o kilkaset nukleotydów za lokalizacją ogona poli-A.
Alternatywne spawanie
Eukariotyczne pre-mRNA mają swoje introny składane przez spliceosomy zbudowane z małych jądrowych rybonukleoprotein .
W złożonych komórkach eukariotycznych jeden pierwotny transkrypt jest w stanie przygotować duże ilości dojrzałych mRNA dzięki alternatywnemu składaniu. Alternatywny splicing jest regulowany tak, że każdy dojrzały mRNA może kodować wiele białek.
Efekt alternatywnego splicingu w ekspresji genów można zaobserwować u złożonych eukariontów, które mają ustaloną liczbę genów w swoim genomie, ale wytwarzają znacznie większą liczbę różnych produktów genów. Większość eukariotycznych transkryptów pre-mRNA zawiera wiele intronów i eksonów. Różne możliwe kombinacje miejsc splicingowych 5 'i 3' w pre-mRNA mogą prowadzić do różnych wycięć i kombinacji eksonów, podczas gdy introny są eliminowane z dojrzałego mRNA. W ten sposób generowane są różne rodzaje dojrzałych mRNA. Alternatywny splicing zachodzi w dużym kompleksie białkowym zwanym spliceosomem . Alternatywny splicing ma kluczowe znaczenie dla specyficznej tkankowo i rozwojowej regulacji ekspresji genów. Na splicing alternatywny mogą wpływać różne czynniki, w tym mutacje, takie jak translokacja chromosomów .
U prokariotów splicing jest wykonywany przez rozszczepienie autokatalityczne lub rozszczepienie endolityczne. Cięcia autokatalityczne, w których nie uczestniczą żadne białka, są zwykle zarezerwowane dla odcinków kodujących rRNA, podczas gdy cięcie endolityczne odpowiada prekursorom tRNA.
Eksperymenty
Badanie przeprowadzone przez Cindy L. Wills i Bruce J. Dolnick z Departamentu Terapii Eksperymentalnej w Roswell Park Comprehensive Cancer Center (wówczas znanym jako Roswell Park Memorial Institute) w Buffalo w stanie Nowy Jork oraz z Cell and Molecular Biology Program na University of Wisconsin w Madison w stanie Wisconsin zostało stworzone, aby zrozumieć procesy komórkowe obejmujące pierwotne transkrypty. Badacze chcieli dowiedzieć się, czy 5- fluorouracyl (FUra), lek znany z leczenia raka, hamuje lub wyłącza przetwarzanie pre-mRNA reduktazy dihydrofolianu (DHFR) i / lub stabilność jądrowego mRNA w komórkach KB opornych na metotreksat . Długotrwała ekspozycja na FUra nie miała wpływu na poziom pre-mRNA DHFR zawierającego określone introny, które są odcinkami pre-mRNA, które są zwykle wycinane z sekwencji w ramach przetwarzania. Jednak poziomy całkowitego mRNA DHFR zmniejszyły się dwukrotnie w komórkach eksponowanych na 1,0 µM FUra. Nie było znaczącej zmiany w okresie półtrwania , który odnosi się do czasu, w jakim rozpada się 50% mRNA, całkowitego mRNA DHFR lub pre-mRNA obserwowanego w komórkach eksponowanych na FUra. Eksperymenty dotyczące znakowania jądrowego / cytoplazmatycznego RNA wykazały, że szybkość zmiany jądrowego RNA DHFR w cytoplazmatyczny mRNA DHFR zmniejszyła się w komórkach traktowanych FUra. Wyniki te dostarczają dalszych dowodów, że FUra może pomóc w obróbce prekursorów mRNA i / lub wpływać na stabilność jądrowego mRNA DHFR.
Judith Lengyel i Sheldon Penman z wydziału biologii w Massachusetts Institute of Technology (MIT) w Cambridge w stanie Massachusetts napisali artykuł o jednym typie pierwotnego transkryptu zaangażowanego w geny dwóch muchówek lub owadów posiadających dwa skrzydła: Drosophila i Aedes . Artykuł opisuje, w jaki sposób badacze przyjrzeli się hnRNA, czyli w zasadzie pre-mRNA, pierwotnym transkryptom u dwóch rodzajów owadów. Porównywano wielkość transkryptów hnRNA i frakcję hnRNA, która jest konwertowana do mRNA w liniach komórkowych lub grupach komórek pochodzących z jednej badanej komórki Drosophila melanogaster i Aedes albopictus . Oba owady to muchówki, ale Aedes ma większy genom niż Drosophila . Oznacza to, że Aedes ma więcej DNA, co oznacza więcej genów. Linia Aedes wytwarza większe hnRNA niż linia Drosophila , mimo że dwie linie komórkowe rosły w podobnych warunkach i wytwarzały dojrzały lub przetworzony mRNA o tej samej wielkości i złożoności sekwencji. Dane te sugerują, że rozmiar hnRNA zwiększa się wraz ze wzrostem wielkości genomu, co oczywiście wykazał Aedes.
Ivo Melcak, Stepanka Melcakova, Vojtech Kopsky, Jaromıra Vecerova i Ivan Raska z Wydziału Biologii Komórki Instytutu Medycyny Doświadczalnej Akademii Nauk Republiki Czeskiej w Pradze badali wpływ plamek jądrowych na pre-mRNA. Plamki jądrowe (plamki) są częścią jąder komórkowych i są wzbogacone o czynniki splicingowe znane z udziału w przetwarzaniu mRNA. Okazało się, że plamki jądrowe służą sąsiednim aktywnym genom jako miejsca przechowywania tych czynników splicingowych. W tym badaniu naukowcy wykazali, że w komórkach HeLa pochodzących z komórek osoby z rakiem szyjki macicy, które okazały się przydatne w eksperymentach, pierwsza grupa spliceosomów na pre-mRNA pochodzi z tych plamek. Naukowcy wykorzystali mikroiniekcje pre-mRNA adenowirusa akceptującego spliceosomy i zmutowanego adenowirusa z różnym wiązaniem czynników splicingowych, aby utworzyć różne grupy, a następnie zbadali miejsca, w których były silnie obecne. Pre-mRNA akceptujące spliceosomy były szybko kierowane do plamek, ale stwierdzono, że celowanie jest zależne od temperatury. Sekwencje polipirymidynowe w mRNA sprzyjają budowie grup spliceosomów i są wymagane do ukierunkowania, ale same w sobie nie były wystarczające. Sekwencje flankujące poniżej były szczególnie ważne dla kierowania zmutowanych pre-mRNA w plamkach. W eksperymentach wspomagających zachowanie plamek obserwowano po mikroiniekcji antysensownych deoksyoligorybonukleotydów (komplementarne sekwencje DNA i / lub RNA do określonej sekwencji), aw tym przypadku specyficznych sekwencji snRNA . SnRNA są również znane z tego, że pomagają w przetwarzaniu pre-mRNA. W tych warunkach na endogennych pre-mRNA powstały grupy spliceosomów. Badacze doszli do wniosku, że grupy spliceosomów na mikroiniekcji pre-mRNA tworzą się wewnątrz plamek. Ukierunkowanie na pre-mRNA i jego gromadzenie się w plamkach jest wynikiem załadowania czynników splicingowych do pre-mRNA, a grupy spliceosomów dały początek zaobserwowanemu wzorowi plamkowemu.
Powiązane choroby
Badania doprowadziły również do poszerzenia wiedzy na temat niektórych chorób związanych ze zmianami w pierwotnych transkryptach. Jedno z badań dotyczyło receptorów estrogenu i splicingu różnicowego. W artykule Paola Ferro, Alessandra Forlani, Marco Muselli i Ulrich Pfeffer z laboratorium Molecular Oncology w National Cancer Research Institute w Genui we Włoszech wyjaśniono artykuł zatytułowany „Alternatywne splicing pierwotnego transkryptu alfa receptora ludzkiego estrogenu: mechanizmy pominięcia egzonu” że 1785 nukleotydów regionu w DNA, który koduje receptor alfa estrogenu (ER-alfa), jest rozproszonych w regionie, który zawiera ponad 300 000 nukleotydów w pierwotnym transkrypcie. Składanie tego pre-mRNA często prowadzi do wariantów lub różnych rodzajów mRNA pozbawionych jednego lub więcej egzonów lub regionów niezbędnych do kodowania białek. Te warianty zostały powiązane z progresją raka piersi . W cyklu życiowym retrowirusów prowirusowy DNA jest włączany do transkrypcji DNA zakażonej komórki. Ponieważ retrowirusy muszą zamienić swoje pre-mRNA w DNA, aby ten DNA mógł zostać zintegrowany z DNA gospodarza, na który wpływa, tworzenie tej matrycy DNA jest istotnym krokiem w replikacji retrowirusa. Typ komórki, zróżnicowanie lub zmieniony stan komórki oraz stan fizjologiczny komórki powodują znaczną zmianę w dostępności i aktywności niektórych czynników niezbędnych do transkrypcji. Te zmienne tworzą szeroki zakres ekspresji genów wirusów. Na przykład komórki hodowli tkankowej aktywnie wytwarzające zakaźne wiriony wirusów białaczki ptasiej lub mysiej (ASLV lub MLV) zawierają tak wysokie poziomy wirusowego RNA, że 5–10% mRNA w komórce może być pochodzenia wirusowego. To pokazuje, że pierwotne transkrypty wytwarzane przez te retrowirusy nie zawsze podążają normalną ścieżką do produkcji białka i przekształcenia z powrotem w DNA w celu namnażania i ekspansji.