Mutageneza (technika biologii molekularnej) - Mutagenesis (molecular biology technique)
W biologii molekularnej , mutagenezy jest ważną techniką laboratorium przy czym DNA mutacje są celowo zaprojektowane w celu wytworzenia bibliotek zmutowanych genów białek, szczepy bakterii i innych organizmów genetycznie zmodyfikowanych . Różne składniki genu, a także jego elementy regulacyjne i produkty genów mogą być zmutowane, aby można było szczegółowo zbadać funkcjonowanie locus, procesu lub produktu genetycznego. Mutacja może wytwarzać zmutowane białka o interesujących właściwościach lub ulepszonych lub nowych funkcjach, które mogą mieć zastosowanie komercyjne. Można również wytworzyć zmutowane szczepy, które mają praktyczne zastosowanie lub umożliwiają badanie podstaw molekularnych określonej funkcji komórki.
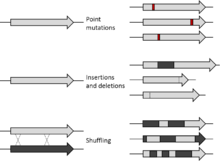
Obecnie istnieje wiele metod mutagenezy. Początkowo rodzaj mutacji sztucznie wywołanych w laboratorium był całkowicie losowy przy użyciu mechanizmów takich jak napromieniowanie UV. Mutageneza losowa nie może celować w określone regiony lub sekwencje genomu; jednak wraz z rozwojem ukierunkowanej mutagenezy można wprowadzić bardziej szczegółowe zmiany. Od 2013 roku rozwój technologii CRISPR /Cas9, opartej na prokariotycznym systemie obrony wirusowej, pozwala na edycję lub mutagenezę genomu in vivo . Mutageneza ukierunkowana na miejsce okazała się przydatna w sytuacjach, w których mutageneza losowa nie jest. Inne techniki mutagenezy obejmują mutagenezę kombinatoryczną i insercyjną. Mutageneza, która nie jest losowa, może być wykorzystana do klonowania DNA, badania efektów mutagenów i inżynierii białek. Ma również zastosowania medyczne, takie jak pomoc pacjentom z obniżoną odpornością, badania i leczenie chorób, w tym HIV i nowotworów oraz leczenie chorób, takich jak talasemia beta .
Losowa mutageneza

Wczesne podejścia do mutagenezy opierały się na metodach, które dawały całkowicie losowe mutacje. W takich sposobach komórki lub organizmy poddaje się działaniu mutagenów, takich jak promieniowanie UV lub mutagenne chemikalia, a następnie wybiera się mutanty o pożądanych właściwościach. Hermann Muller odkrył w 1927 r., że promieniowanie rentgenowskie może powodować mutacje genetyczne u muszek owocowych , a następnie wykorzystał mutanty, które stworzył do swoich badań genetycznych . W przypadku Escherichia coli , mutanty można najpierw wyselekcjonować przez ekspozycję na promieniowanie UV, a następnie wysiać na podłoże agarowe. Utworzone kolonie są następnie wysiewane na płytki , jedna na bogatej pożywce , druga na pożywce minimalnej, a mutanty, które mają specyficzne wymagania żywieniowe można następnie zidentyfikować na podstawie ich niezdolności do wzrostu na pożywce minimalnej. Podobne procedury można powtórzyć z innymi typami komórek iz różnymi podłożami do selekcji.
Szereg metod wytwarzania losowe mutacje w konkretnych białek zostały następnie rozwinięte na ekranie mutantów z interesujących lub ulepszonych właściwościach. Metody te mogą obejmować zastosowanie domieszkowanych nukleotydów w syntezie oligonukleotydów lub przeprowadzenie reakcji PCR w warunkach zwiększających nieprawidłowe włączanie nukleotydów (PCR podatna na błędy), na przykład poprzez zmniejszenie wierności replikacji lub zastosowanie analogów nukleotydów. Odmianą tej metody integracji nieobciążonych mutacji w genie jest mutageneza z wysyceniem sekwencji . Produkty PCR, które zawierają mutację(e) są następnie klonowane do wektora ekspresyjnego, a wytworzone zmutowane białka można następnie scharakteryzować.
W badaniach na zwierzętach do wytworzenia zmutowanych myszy stosowano środki alkilujące, takie jak N- etylo- N- nitrozomocznik (ENU). Metanosulfonian etylu (EMS) jest również często używany do generowania mutantów zwierzęcych, roślinnych i wirusowych.
W prawie Unii Europejskiej (jako dyrektywa 2001/18) ten rodzaj mutagenezy może być wykorzystany do produkcji GMO, ale produkty są wyłączone z regulacji: bez etykietowania, bez oceny.
Mutageneza ukierunkowana na miejsce
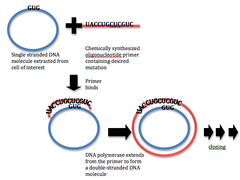
Przed opracowaniem technik mutagenezy ukierunkowanej na miejsce, wszystkie dokonane mutacje były losowe, a naukowcy musieli użyć selekcji pod kątem pożądanego fenotypu, aby znaleźć pożądaną mutację. Techniki mutagenezy losowej mają przewagę pod względem liczby mutacji, które można wytworzyć; jednak, chociaż losowa mutageneza może powodować zmianę pojedynczych nukleotydów, nie zapewnia dużej kontroli nad tym, który nukleotyd jest zmieniany. Dlatego wielu badaczy stara się wprowadzać wybrane zmiany w DNA w sposób precyzyjny, specyficzny dla miejsca. Wczesne próby wykorzystania analogów nukleotydów i innych substancji chemicznych zostały po raz pierwszy wykorzystane do wygenerowania zlokalizowanych mutacji punktowych . Takie środki chemiczne obejmują aminopuryny , który indukuje AT GC przejścia , a nitrozoguanidyna, wodorosiarczyn , i N- 4 może indukować -hydroxycytidine GC AT transformacji. Techniki te umożliwiają wbudowanie w białko określonych mutacji; jednak nie są one elastyczne w odniesieniu do rodzajów generowanych mutantów ani nie są tak specyficzne jak późniejsze metody mutagenezy ukierunkowanej, a zatem mają pewien stopień losowości. Inne technologie, takie jak cięcie DNA w określonych miejscach na chromosomie, dodawanie nowych nukleotydów i wymiana par zasad, pozwalają teraz decydować, dokąd zmierzają mutacje.
Obecne techniki mutacji miejscowo-specyficznych wywodzą się z techniki wydłużania startera opracowanej w 1978 roku. Takie techniki zwykle obejmują stosowanie prefabrykowanych mutagennych oligonukleotydów w reakcji wydłużania startera za pomocą polimerazy DNA . Metody te pozwalają na punktową mutację lub delecję lub insercję małych odcinków DNA w określonych miejscach. Postępy w metodologii sprawiły, że taka mutageneza jest obecnie stosunkowo prostym i wydajnym procesem.
Stale opracowywane są nowsze i wydajniejsze metody mutagenezy ukierunkowanej. Na przykład technika zwana „ekstraktem klonowania bez szwu ligacji” (w skrócie SLiCE) pozwala na klonowanie pewnych sekwencji DNA w genomie i do genomu można wstawić więcej niż jeden fragment DNA na raz.
Mutageneza ukierunkowana na miejsce umożliwia zbadanie wpływu określonej mutacji. Istnieje wiele zastosowań; na przykład był używany do określenia podatności niektórych gatunków na chemikalia, które są często używane w laboratoriach. W eksperymencie wykorzystano ukierunkowaną mutagenezę, aby naśladować oczekiwane mutacje określonej substancji chemicznej. Mutacja spowodowała zmianę określonych aminokwasów i analizowano skutki tej mutacji.

Podejście ukierunkowane na miejsce może być wykonywane systematycznie w takich technikach, jak mutageneza ze skanowaniem alaniny , gdzie reszty są systematycznie mutowane do alaniny w celu zidentyfikowania reszt ważnych dla struktury lub funkcji białka. Innym kompleksowym podejściem jest mutageneza z wysyceniem miejsca, gdzie jeden kodon lub zestaw kodonów można zastąpić wszystkimi możliwymi aminokwasami w określonych pozycjach.
Mutageneza kombinatoryczna
Mutageneza kombinatoryczna to technika inżynierii białek ukierunkowanych na miejsce, w której wiele mutantów białka może być jednocześnie modyfikowanych w oparciu o analizę efektów addytywnych pojedynczych mutacji. Stanowi użyteczną metodę oceny kombinatorycznego wpływu dużej liczby mutacji na funkcję białka. Duża liczba mutantów może być przeszukiwana pod kątem określonej cechy za pomocą analizy kombinatorycznej. W tej technice wiele pozycji lub krótkich sekwencji wzdłuż nici DNA można wyczerpująco modyfikować w celu uzyskania kompleksowej biblioteki zmutowanych białek. Częstość występowania korzystnych wariantów można poprawić różnymi metodami konstruowania bibliotek mutagenezy. Jednym z podejść do tej techniki jest ekstrakcja i zastąpienie części sekwencji DNA biblioteką sekwencji zawierającą wszystkie możliwe kombinacje w żądanym miejscu mutacji. Zawartość wstawionego segmentu może zawierać sekwencje o znaczeniu strukturalnym, właściwościach immunogennych lub funkcji enzymatycznej. Segment można również wstawić losowo do genu w celu oceny strukturalnego lub funkcjonalnego znaczenia określonej części białka.
Mutageneza insercyjna
Insercja jednej lub więcej par zasad, powodująca mutacje DNA, jest również znana jako mutageneza insercyjna. Zmodyfikowane mutacje, takie jak te, mogą dostarczyć ważnych informacji w badaniach nad rakiem, takich jak mechanistyczny wgląd w rozwój choroby. Głównymi instrumentami w mutagenezie insercyjnej są retrowirusy i transpozony. Retrowirusy, takie jak wirus nowotworu sutka myszy i wirus mysiej białaczki, można wykorzystać do identyfikacji genów zaangażowanych w karcynogenezę i zrozumienia biologicznych szlaków określonych nowotworów. Transpozony, segmenty chromosomów, które mogą podlegać transpozycji, mogą być zaprojektowane i zastosowane w mutagenezie insercyjnej jako narzędzie do odkrywania genów nowotworowych. Te segmenty chromosomalne umożliwiają zastosowanie mutagenezy insercyjnej w praktycznie dowolnej wybranej tkance, jednocześnie umożliwiając bardziej wszechstronną, bezstronną głębokość sekwencjonowania DNA.
Naukowcy odkryli cztery mechanizmy mutagenezy insercyjnej, które można zastosować u ludzi. pierwszy mechanizm nazywa się wstawianiem wzmacniacza. Wzmacniacze zwiększają transkrypcję określonego genu poprzez interakcję z promotorem tego genu. Ten szczególny mechanizm został po raz pierwszy użyty, aby pomóc pacjentom z poważnie obniżoną odpornością, których potrzebuję w szpiku kostnym. Gammaretrowirusy niosące wzmacniacze były następnie wprowadzane do pacjentów. Drugi mechanizm jest określany jako insercja promotora. Promotory dostarczają naszym komórkom określonych sekwencji potrzebnych do rozpoczęcia translacji. Wstawienie promotora pomogło naukowcom dowiedzieć się więcej o wirusie HIV. Trzeci mechanizm to inaktywacja genów. Przykładem inaktywacji genów jest zastosowanie mutagenezy insercyjnej w celu wprowadzenia retrowirusa, który uszkadza genom komórki T u pacjentów z białaczką i daje im specyficzny antygen zwany CAR umożliwiający limfocytom T atakowanie komórek rakowych. Ostateczny mechanizm określa się jako podstawienie końca 3' mRNA. Nasze geny czasami ulegają mutacjom punktowym powodującym beta-talasemię, która zakłóca funkcję czerwonych krwinek. Aby rozwiązać ten problem, wprowadza się prawidłową sekwencję genów dla czerwonych krwinek i dokonuje się substytucji.
Rekombinacja homologiczna
Rekombinacja homologiczna może być wykorzystana do wytworzenia określonej mutacji w organizmie. Wektor zawierający sekwencję DNA podobną do genu, który ma być zmodyfikowany, jest wprowadzany do komórki i poprzez proces rekombinacji zastępuje docelowy gen w chromosomie. Metoda ta może być wykorzystana do wprowadzenia mutacji lub nokautu genu, np. w produkcji myszy knockout .
CRISPR
Od 2013 roku rozwój technologii CRISPR- Cas9 pozwolił na sprawne wprowadzanie różnych typów mutacji do genomu szerokiej gamy organizmów. Metoda nie wymaga miejsca insercji transpozonu, nie pozostawia markera, a jej wydajność i prostota sprawiły, że jest preferowaną metodą edycji genomu .
Synteza genów
Ponieważ koszt syntezy oligonukleotydów DNA spada, sztuczna synteza całego genu jest obecnie realną metodą wprowadzania mutacji do genu. Metoda ta pozwala na rozległe mutacje w wielu miejscach, w tym całkowite przeprojektowanie wykorzystania kodonów genu w celu optymalizacji go dla konkretnego organizmu.
Zobacz też
Bibliografia
Zewnętrzne linki
|
Zasoby biblioteczne o mutagenezie |