Komórka do osłony węchowej - Olfactory ensheathing cell

Okrywające komórki węchowe ( OEC ), znane również jako glej węchowy lub komórki gleju węchowego , są rodzajem makrogleju ( gleju promieniowego ) występującego w układzie nerwowym . Są one znane również jako zapachowe komórek Schwanna , ponieważ ensheath niepochodzących mielinową aksonów z zapachowych neuronów w podobny sposób, z którym komórki Schwanna ensheath nie mielinowych nerwów obwodowych . Mają również wspólną właściwość wspomagania regeneracji aksonów.
OEC są zdolne do fagocytowania resztek aksonów in vivo , a in vitro fagocytują bakterie . Węchowe komórki glejowe, które wyrażają przeciwbakteryjny enzym lizozym (LYZ), odgrywają ważną rolę w immunoprotekcji w błonie śluzowej , w którym neurony są bezpośrednio narażone na działanie środowiska zewnętrznego.
OEC zostały pomyślnie przetestowane w eksperymentalnej regeneracji aksonów u dorosłych szczurów z urazowym uszkodzeniem rdzenia kręgowego , a obecnie prowadzone są badania kliniczne w celu uzyskania większej ilości informacji na temat urazów rdzenia kręgowego i innych chorób neurodegeneracyjnych .
Początek
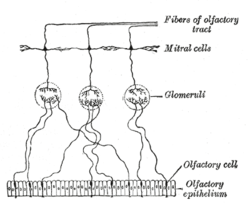
W obwodowym układzie nerwowym GKW są rozproszone w nabłonku węchowym i nerwie węchowym . W ośrodkowym układzie nerwowym GKW znajdują się w dwóch zewnętrznych warstwach opuszki węchowej . Podczas rozwoju prymitywne neurony węchowe rozciągają swoje aksony od plakodu węchowego , poprzez mezenchym , w kierunku pęcherzyka kresomózgowia. Po dotarciu do pęcherzyka kresomózgowia mała warstwa komórek i aksonów pokrywa pęcherzyk. Węchowe aksony inwazji na blaszkę podstawną z limitans glejowych i opuszki węchowej , aby utworzyć nerw węchowy i kłębuszkowego warstw . Część prekursorów migrujących z nabłonka powoduje powstanie gleju osłonowego węchowego, który zasiedla warstwy nerwu węchowego i kłębuszków nerkowych. GKW i astrocyty oddziałują ze sobą, tworząc nowy glej graniczny . GKW różnią się od innych glejów pochodzeniem rozwojowym, ponieważ występują w obwodowym układzie nerwowym, a także w ośrodkowym układzie nerwowym. Tworzą się one również na wiązkach aksonów węchowych neuronów czuciowych w sposób odmienny od mielinizacji .
Funkcje
GKW to gleje radialne, które pełnią różne funkcje. W obrębie układu węchowego fagocytują resztki aksonów i martwe komórki. Gdy hoduje się w szalce Petriego (in vitro), to fagocytozy bakterii. Liczne badania wykazały, że GKW mogą pomagać w leczeniu urazów rdzenia kręgowego (SCI) ze względu na ich właściwości regeneracyjne w obwodowym układzie nerwowym oraz obecność w ośrodkowym układzie nerwowym. Wiadomo również, że GKW wspierają i kierują aksonami węchowymi, przerastają blizny glejowe i wydzielają wiele czynników neurotroficznych .
OEC eksprymują markery glejowe, takie jak kwaśne białko fibrylarne gleju , s100 i p75 oraz markery gleju radialnego, takie jak nestyna i wimentyna , które mogą dodatkowo pomóc naukowcom w zrozumieniu cech znakowania tych wyspecjalizowanych glejów.
Regeneracja układu węchowego
System węchowy ssaków jest niezwykły, ponieważ ma zdolność do ciągłej regeneracji neuronów w wieku dorosłym. Ta zdolność jest związana z glejem węchowym. Aby nowe neurony receptorów węchowych mogły funkcjonować, muszą rzutować swoje aksony przez ośrodkowy układ nerwowy do opuszki węchowej . Wzrost i regenerację aksonów węchowych można przypisać GKW, ponieważ tworzą one pęczki, przez które aksony wyrastają z obwodowego układu nerwowego do ośrodkowego układu nerwowego. Neurony receptora węchowego mają przeciętną długość życia 6–8 tygodni i dlatego muszą zostać zastąpione komórkami różniącymi się od komórek macierzystych, które znajdują się w warstwie u podstawy pobliskiego nabłonka. Wzrost aksonów zależy od składu gleju i cytoarchitektury opuszki węchowej, a także od obecności GKW.
Uważa się, że GKW są częściowo odpowiedzialne za neurogenezę pierwotnych neuronów węchowych poprzez procesy fascykulacji , sortowania komórek i kierowania aksonów.
Rola w urazach rdzenia kręgowego
Urazowe uszkodzenie rdzenia kręgowego powoduje trwałą utratę funkcji ruchowych i czuciowych w ośrodkowym układzie nerwowym, określaną mianem paraplegii lub tetraplegii w zależności od miejsca urazu. W wyniku urazu mogą wystąpić inne szkodliwe skutki w układzie oddechowym i nerkowym . W przeciwieństwie do obwodowego układu nerwowego, ośrodkowy układ nerwowy nie jest w stanie zregenerować uszkodzonych aksonów, więc jego połączenia synaptyczne zostają utracone na zawsze. Obecne leczenie jest ograniczone, a główne potencjalne metody są albo kontrowersyjne, albo nieskuteczne. Badania sięgające lat dziewięćdziesiątych rozpoczęły badania układu węchowego ssaków, w szczególności szczurów, aby lepiej zrozumieć regenerację aksonów i neurogenezę oraz możliwą implementację tych komórek w miejscu uszkodzenia rdzenia kręgowego.
Transplantacja GKW do rdzenia kręgowego stała się możliwą terapią uszkodzenia rdzenia kręgowego i innych chorób nerwowych w modelach zwierzęcych. W kilku ostatnich badaniach stwierdzono, że zapobieganie inhibicji OEC spowoduje powstanie jednolitej populacji komórek w rdzeniu kręgowym, tworząc środowisko, w którym uszkodzone aksony będą mogły być naprawiane. W październiku 2014 roku polski strażak Darek Fidyka został pierwszym pacjentem z paraplegią, który odzyskał sprawność ruchową po przeszczepie OEC.
OEC są podobne do komórek Schwanna pod tym względem, że zapewniają regulację w górę receptora NGF p75 o niskim powinowactwie po uszkodzeniu; jednak w przeciwieństwie do komórek Schwanna wytwarzają niższe poziomy neurotrofin . Kilka badań wykazało, że GKW są w stanie wspierać regenerację uszkodzonych aksonów, ale tych wyników często nie można odtworzyć. Niezależnie od tego, GKW zostały dokładnie zbadane pod kątem urazów rdzenia kręgowego, stwardnienia zanikowego bocznego i innych chorób neurodegeneracyjnych. Naukowcy sugerują, że komórki te posiadają wyjątkową zdolność do remielinizacji uszkodzonych neuronów.
Guma gellanowa modyfikowana peptydami i GKW
Przeszczep komórek macierzystych został zidentyfikowany jako kolejna możliwa terapia regeneracji aksonów w ośrodkowym układzie nerwowym poprzez dostarczenie tych komórek bezpośrednio do miejsca uszkodzenia rdzenia kręgowego. Zarówno GKW, jak i nerwowe komórki macierzyste/progenitorowe (NSPC) zostały z powodzeniem przeszczepione do ośrodkowego układu nerwowego dorosłych szczurów i uzyskały pozytywne lub neutralne wyniki jako metoda neurogenezy i regeneracji aksonów; jednak żadna metoda nie okazała się mieć długoterminowych korzystnych skutków, ponieważ przeżycie komórek po przeszczepie wynosi zwykle mniej niż 1%. Niezdolność tych komórek do utrzymania się po przeszczepie jest wynikiem stanu zapalnego , niezdolności wystarczającej macierzy do rozwoju i tworzenia jednolitej populacji komórek lub odpowiedzi migracyjnej komórek potrzebnej do pełnej naprawy miejsca uszkodzenia. Innym aktualnym problemem związanym z przeżyciem komórek jest wykorzystanie odpowiednich biomateriałów do dostarczania ich do miejsca urazu.
W jednym z badań zbadano zastosowanie zmodyfikowanej peptydem gumy gellan jako biomateriału z GKW i nerwowymi komórkami macierzystymi/progenitorowymi w celu zapewnienia środowiska, które pozwoli tym komórkom przetrwać po przeszczepie. Hydrożel gumy gellan może być wstrzykiwany w sposób minimalnie inwazyjny i jest zatwierdzony przez FDA jako dodatek do żywności ze względu na swoją strukturę chemiczną. Guma gellan została zmodyfikowana kilkoma sekwencjami peptydów pochodzących z fibronektyny , dzięki czemu przeszczepione komórki mają właściwości blisko spokrewnione z natywną tkanką w macierzy zewnątrzkomórkowej . Naśladując tkankę natywną, komórki dostarczające są mniej podatne na odrzucenie przez organizm, a funkcje biologiczne, takie jak adhezja i wzrost komórek, zostaną wzmocnione poprzez interakcje komórka-komórka i komórka-macierz. W celu określenia możliwości poprawy żywotności komórek przez OEC i NPSC, obie komórki hodowano wspólnie w bezpośrednim kontakcie ze sobą, wraz z gumą gellan zmodyfikowaną peptydem.
Doświadczenie wykazało, że adhezja, proliferacja i żywotność NSPC są znacznie zwiększone, gdy guma gellan ze zmodyfikowaną peptydem jest stosowana jako urządzenie do transplantacji w porównaniu z kontrolą gumy gellan. Dodatkowo, wspólna hodowla OEC i NSPC wykazuje większą przeżywalność komórek w porównaniu z przeżywalnością komórek NSPC hodowanych samodzielnie. Wyniki dostarczają dowodów na to, że ta metoda przeszczepiania komórek jest potencjalną strategią naprawy uszkodzeń rdzenia kręgowego w przyszłości.
Skutki uboczne przeszczepu komórek
Badanie wykazało, że przeszczep komórek może powodować wzrost temperatury ciała osoby ze starszym uszkodzeniem rdzenia kręgowego. W tym eksperymencie temperatura ciała pacjentów była podwyższona do umiarkowanej gorączki po przeszczepie i trwała około 3-4 dni. Jednak badanie dostarcza dowodów na to, że nawet wcześniejsze urazy rdzenia kręgowego mogą skorzystać na neurologicznej regeneracji funkcjonalnej, którą może zapewnić przeszczep komórek macierzystych w przyszłości.
Wiadomo również, że transplantacja komórek macierzystych powoduje toksyczność i chorobę przeszczep przeciwko gospodarzowi (GVHD). Komórki apoptotyczne podawano jednocześnie z hematopoetycznymi komórkami macierzystymi w eksperymentalnych modelach transplantacji, w oczekiwaniu na poprawę wyników. W rezultacie połączenie zapobiega alloimmunizacji , zwiększa poziom limfocytów T regulatorowych (limfocyty T supresorowe) i zmniejsza nasilenie GVHD.
Podatność na infekcje
GKW mają właściwości podobne do astrocytów , które zostały zidentyfikowane jako podatne na infekcje wirusowe.
Oznakowanie GKW
Cząsteczki tlenku żelaza do MRI
Ponieważ przeszczepianie komórek macierzystych staje się coraz powszechniejszym sposobem leczenia urazowego uszkodzenia rdzenia kręgowego, należy zająć się wieloma procesami między początkiem a wynikiem końcowym i usprawnić ich działanie. Oznaczając GKW, komórki te mogą być śledzone za pomocą urządzenia do obrazowania metodą rezonansu magnetycznego (MRI), gdy są rozproszone w ośrodkowym układzie nerwowym W niedawnym badaniu wykorzystano nowy rodzaj mikronowych cząstek tlenku żelaza (MPIO) do znakowania i śledzenia te komórki, w których pośredniczy transport, za pomocą MRI. Eksperyment zaowocował wydajnością znakowania OEC na poziomie ponad 90% przy czasie inkubacji MPIO wynoszącym zaledwie 6 godzin, bez wpływu na proliferację , migrację i żywotność komórek . MPIO zostały również z powodzeniem przeszczepione do ciała szklistego oczu dorosłych szczurów, zapewniając pierwszy szczegółowy protokół wydajnego i bezpiecznego znakowania MPIO GKW w celu ich nieinwazyjnego śledzenia MRI w czasie rzeczywistym do wykorzystania w badaniach naprawy ośrodkowego układu nerwowego i regeneracji aksonów .
Subpopulacje
Zidentyfikowano dwie odrębne subpopulacje GKW o wysokiej lub niskiej ekspresji na powierzchni komórek receptora czynnika wzrostu nerwów o niskim powinowactwie (p75).