Kanał potasowy - Potassium channel

Kanały potasowe są najszerzej rozpowszechnionym typem kanałów jonowych i występują praktycznie we wszystkich organizmach żywych. Tworzą pory selektywne względem potasu, które obejmują błony komórkowe . Kanały potasowe znajdują się w większości typów komórek i kontrolują wiele różnych funkcji komórek.
Funkcjonować
Kanały potasowe przenoszą jony potasu w dół ich gradientu elektrochemicznego , robiąc to zarówno szybko (do szybkości dyfuzji jonów K + w wodzie), jak i selektywnie (z wyłączeniem, przede wszystkim sodu, pomimo subangstremowej różnicy w promieniu jonów). Biologicznie te kanały działają, aby ustawić lub zresetować potencjał spoczynkowy w wielu komórkach. W komórkach pobudliwych, takich jak neurony , opóźniony przeciwprąd jonów potasu kształtuje potencjał czynnościowy .
Przyczyniając się do regulacji czasu trwania potencjału czynnościowego mięśnia sercowego , nieprawidłowe funkcjonowanie kanałów potasowych może powodować zagrażające życiu zaburzenia rytmu serca . Kanały potasowe mogą również brać udział w utrzymaniu napięcia naczyniowego .
Regulują one także procesy komórkowe, takie jak wydzielanie hormonów ( na przykład , insulina uwalniania z komórek beta w trzustce ), więc ich nieprawidłowe działanie może prowadzić do chorób (takich jak cukrzycy ).
Niektóre toksyny, takie jak dendrotoksyna , są silne, ponieważ blokują kanały potasowe.
Rodzaje
Istnieją cztery główne klasy kanałów potasowych:
- Kanał potasowy aktywowany wapniem - otwarty w odpowiedzi na obecność jonów wapnia lub innych cząsteczek sygnałowych.
- Kanał potasowy prostujący do wewnątrz - łatwiej przepuszcza prąd (ładunek dodatni) w kierunku do wewnątrz (do ogniwa).
- Kanał potasowy z domeną porów tandemowych - są konstytutywnie otwarte lub posiadają wysoką aktywację podstawową, taką jak „spoczynkowe kanały potasowe” lub „kanały wyciekowe”, które ustawiają ujemny potencjał błonowy neuronów.
- Kanał potasowy bramkowany napięciem - to kanały jonowe bramkowane napięciem, które otwierają się lub zamykają w odpowiedzi na zmiany napięcia transbłonowego .
Poniższa tabela zawiera porównanie głównych klas kanałów potasowych z reprezentatywnymi przykładami (pełna lista kanałów w każdej klasie znajduje się na stronach odpowiednich klas).
Aby uzyskać więcej przykładów farmakologicznych modulatorów kanałów potasowych, zobacz bloker kanału potasowego i otwieracz kanału potasowego .
| Klasa | Podklasy | Funkcjonować | Blokery | Aktywatory |
|---|---|---|---|---|
|
Aktywowany wapniem 6 T i 1 P |
|
|
||
|
Prostowanie wewnętrznie 2 T i 1 P |
|
|
|
|
|
|
|||
|
||||
|
Domena porów tandemowych 4 T i 2 P |
|
|
||
|
Bramkowane napięciem 6 T i 1 P |
|
|
Struktura
Kanały potasowe mają tetrameryczną strukturę, w której czterech identycznych podjednostek białkowych łączą się w czterokrotnie symetryczny ( C 4 ) złożone rozmieszczone wokół centralnego porów jonów przewodzące (tj homotetramer). Ewentualnie cztery podobne, lecz nie identyczne podjednostki białkowe mogą łączą się w kompleksy heterotetramerycznymi pseudo C 4 symetrii. Wszystkie podjednostki kanału potasowego mają charakterystyczną strukturę pętli porów, która wyściela szczyt porów i jest odpowiedzialna za przepuszczalność selektywną względem potasu.
Istnieje ponad 80 genów ssaków , które kodują podjednostki kanału potasowego . Jednak kanały potasowe znalezione w bakteriach należą do najlepiej zbadanych kanałów jonowych pod względem ich struktury molekularnej. Dzięki krystalografii rentgenowskiej uzyskano głęboki wgląd w to, jak jony potasu przechodzą przez te kanały i dlaczego (mniejsze) jony sodu nie przechodzą . Nagroda Nobla w dziedzinie chemii w 2003 r. została przyznana Rodowi MacKinnonowi za pionierską pracę w tej dziedzinie.
Filtr selektywności
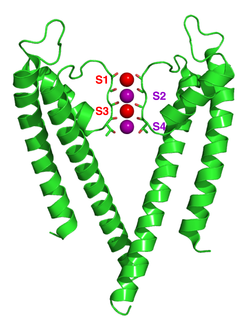
Kanały jonów potasowych usuwają powłokę hydratacyjną z jonu, gdy wchodzi on do filtra selektywności. Filtr selektywności jest utworzony przez sekwencję pięciu reszt, TVGYG, określaną jako sekwencja sygnatury, w obrębie każdej z czterech podjednostek. Ta sekwencja sygnatury znajduje się w pętli między helisą porów a TM2/6, historycznie nazywaną pętlą P. Ta sekwencja sygnatury jest wysoce konserwatywna, z wyjątkiem tego, że reszta waliny w prokariotycznych kanałach potasowych jest często zastępowana resztą izoleucyny w kanałach eukariotycznych. Ta sekwencja przyjmuje unikalną strukturę łańcucha głównego, strukturalnie analogiczną do motywu strukturalnego białka gniazdowego . Cztery zestawy elektroujemnych atomów tlenu karbonylowego są wyrównane w kierunku środka porów filtra i tworzą kwadratowy antypryzmat podobny do powłoki solwatującej wodę wokół każdego miejsca wiązania potasu. Odległość między tlenami karbonylowymi a jonami potasu w miejscach wiązania filtra selektywnego jest taka sama jak między tlenami wody w pierwszej powłoce hydratacyjnej a jonem potasu w roztworze wodnym, zapewniając energetycznie korzystną drogę desolwatacji jonów . Jony sodu są jednak zbyt małe, aby wypełnić przestrzeń między atomami tlenu karbonylowego. Tak więc energetycznie korzystne jest, aby jony sodu pozostawały związane z cząsteczkami wody w przestrzeni pozakomórkowej, a nie przechodziły przez por jonów potasowo-selektywnych. Ta szerokość wydaje się być utrzymywana przez wiązania wodorowe i siły van der Waalsa w arkuszu reszt aminokwasów aromatycznych otaczających filtr selektywności. Filtr selektywności otwiera się w kierunku roztworu pozakomórkowego, odsłaniając cztery tlenki karbonylowe w reszcie glicyny (Gly79 w KcsA ). Następną resztą po zewnątrzkomórkowej stronie białka jest ujemnie naładowany Asp80 (KcsA). Ta pozostałość wraz z pięcioma pozostałościami filtracyjnymi tworzy por, który łączy wypełnioną wodą wnękę w środku białka z roztworem pozakomórkowym.
Mechanizm selektywności
Mechanizm selektywności kanału potasowego pozostaje przedmiotem nieustannej debaty. Tlenki karbonylowe są silnie elektroujemne i przyciągają kationy. Filtr może pomieścić jony potasu w 4 miejscach zwykle oznaczonych jako S1 do S4, zaczynając od strony zewnątrzkomórkowej. Ponadto jeden jon może wiązać się we wnęce w miejscu zwanym SC lub jeden lub więcej jonów po stronie zewnątrzkomórkowej w mniej lub bardziej dobrze zdefiniowanych miejscach zwanych S0 lub Sext. Możliwych jest kilka różnych zajętości tych miejsc. Ponieważ struktury rentgenowskie są uśrednione dla wielu cząsteczek, nie jest jednak możliwe wywnioskowanie rzeczywistych obłożeń bezpośrednio z takiej struktury. Ogólnie rzecz biorąc, istnieją pewne niedogodności wynikające z odpychania elektrostatycznego dwóch sąsiadujących miejsc zajmowanych przez jony. Propozycje mechanizmu selektywności zostały opracowane na podstawie symulacji dynamiki molekularnej , zabawkowych modeli wiązania jonów, obliczeń termodynamicznych, rozważań topologicznych oraz różnic strukturalnych między kanałami selektywnymi i nieselektywnymi.
Mechanizm translokacji jonów w KcsA był szeroko badany za pomocą obliczeń teoretycznych i symulacji. Przewidywanie mechanizmu przewodzenia jonów, w którym dwa stany podwójnie zajęte (S1, S3) i (S2, S4) odgrywają zasadniczą rolę, zostało potwierdzone przez obie techniki. Symulacje dynamiki molekularnej (MD) sugerują, że dwa stany zewnątrzkomórkowe, S ext i S 0 , odzwierciedlające jony wchodzące i wychodzące z filtra, również odgrywają ważną rolę w przewodzeniu jonów.
Region hydrofobowy
Obszar ten neutralizuje środowisko wokół jonu potasu, dzięki czemu nie przyciągają go żadne ładunki. Z kolei przyspiesza reakcję.
Wnęka centralna
Centralny por o szerokości 10 Å znajduje się w pobliżu środka kanału przezbłonowego, gdzie bariera energetyczna jest najwyższa dla jonu poprzecznego ze względu na hydrofobowość ścianki kanału. Wypełniona wodą wnęka i polarny C-koniec helis porów łagodzą barierę energetyczną dla jonu. Uważa się, że odpychanie poprzedzające wiele jonów potasu wspomaga przepustowość jonów. Obecność wnęki może być intuicyjnie rozumiana jako jeden z mechanizmów kanału pokonywania bariery dielektrycznej lub odpychania przez membranę o niskiej dielektrycznej, poprzez utrzymywanie jonu K + w wodnistym środowisku o wysokiej dielektrycznej.
Rozporządzenie
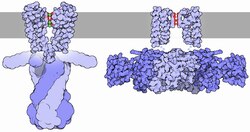
Przepływ jonów przez pory kanału potasowego jest regulowany przez dwa powiązane procesy, zwane bramkowaniem i inaktywacją. Bramkowanie to otwieranie lub zamykanie kanału w odpowiedzi na bodźce, podczas gdy inaktywacja to szybkie ustanie prądu z otwartego kanału potasowego i tłumienie zdolności kanału do wznowienia przewodzenia. Chociaż oba procesy służą do regulacji przewodnictwa kanału, w każdym z nich może pośredniczyć szereg mechanizmów.
Ogólnie uważa się, że w bramkowaniu pośredniczą dodatkowe domeny strukturalne, które wyczuwają bodźce i z kolei otwierają pory kanału. Domeny te obejmują domeny RCK kanałów BK i domeny czujników napięcia kanałów K + bramkowanych napięciem . Uważa się, że te domeny reagują na bodźce, fizycznie otwierając bramkę wewnątrzkomórkową domeny porów, umożliwiając w ten sposób przechodzenie jonów potasu przez błonę. Niektóre kanały mają wiele domen regulatorowych lub białek pomocniczych, które mogą modulować odpowiedź na bodziec. Chociaż mechanizmy nadal są przedmiotem dyskusji, znane są struktury wielu tych domen regulatorowych, w tym domeny RCK kanałów prokariotycznych i eukariotycznych, domena bramkująca pH KcsA, domeny bramkujące cykliczne nukleotydy i kanały potasowe bramkowane napięciem.
Inaktywacja typu N jest zazwyczaj szybszym mechanizmem inaktywacji i jest określana jako model „kulowy i łańcuchowy” . Inaktywacja typu N obejmuje interakcję N-końca kanału lub związanego z nim białka, które oddziałuje z domeną porów i blokuje ścieżkę przewodzenia jonów jak „piłka”. Alternatywnie, uważa się, że inaktywacja typu C występuje w samym filtrze selektywności, gdzie zmiany strukturalne w filtrze sprawiają, że nie przewodzi. Istnieje wiele modeli strukturalnych inaktywowanych filtrów kanałowych K + typu C , chociaż dokładny mechanizm pozostaje niejasny.
Farmakologia
Blokery
Blokery kanału potasowego hamują przepływ jonów potasu przez kanał. Konkurują one z wiązaniem potasu w obrębie filtra selektywnego lub wiążą się na zewnątrz filtra, blokując przewodzenie jonów. Przykładem jednego z tych konkurentów są czwartorzędowe jony amoniowe, które wiążą się na zewnątrzkomórkowej powierzchni lub centralnej wnęce kanału. Do blokowania z jamy centralnej czwartorzędowe jony amoniowe są również znane jako blokery otwartego kanału, ponieważ wiązanie klasycznie wymaga uprzedniego otwarcia bramy cytoplazmatycznej.
Jony baru mogą również blokować prądy kanałów potasowych, wiążąc się z wysokim powinowactwem w filtrze selektywności. Uważa się, że to ścisłe wiązanie leży u podstaw toksyczności baru poprzez hamowanie aktywności kanału potasowego w pobudliwych komórkach.
Z medycznego punktu widzenia , blokery kanałów potasowych , takie jak 4- aminopirydyna i 3,4- diaminopirydyna , zostały przebadane w leczeniu stanów takich jak stwardnienie rozsiane . Niedocelowe działanie leków może prowadzić do wywołanego lekiem zespołu wydłużenia odstępu QT , stanu potencjalnie zagrażającego życiu. Jest to najczęściej spowodowane działaniem na kanał potasowy hERG w sercu. W związku z tym wszystkie nowe leki są testowane przedklinicznie pod kątem bezpieczeństwa kardiologicznego.
Aktywatory
Muskarynowy kanał potasowy

Niektóre typy kanałów potasowych są aktywowane przez receptory muskarynowe i nazywane są muskarynowymi kanałami potasowymi (I KACh ). Kanały te są heterotetramerem złożonym z dwóch podjednostek GIRK1 i dwóch GIRK4 . Przykładem są kanały potasowe w sercu, które po aktywacji przez sygnały przywspółczulne za pośrednictwem receptorów muskarynowych M2 powodują wypływ potasu, który spowalnia częstość akcji serca .
W sztuce
Roderick MacKinnon zamówił Narodziny Pomysłu, wysoką na 1,5 m rzeźbę opartą na kanale potasowym KcsA. Grafika zawiera obiekt z drutu reprezentujący wnętrze kanału oraz obiekt z dmuchanego szkła reprezentujący główną wnękę struktury kanału.
Zobacz też
- Kanał wapniowy
- Kanał jonów potasowych prostownika wewnętrznego
- Potas w biologii – Opis funkcji pierwiastka jako niezbędnego mikroelementu mineralnego
- Rodzina transporterów potasu (Trk)
- Permeaza wychwytu potasu
- Kanał jonów sodowych
Bibliografia
Zewnętrzne linki
- Kanał Proteopedia Kanał potasowy w 3D
- Potas+Kanały w Narodowej Bibliotece Medycznej Stanów Zjednoczonych Medyczne Nagłówki Tematyczne (MeSH)
- Centrum Chorób Nerwowo-mięśniowych (2008-03-04). „Kanały potasowe” . Uniwersytet Waszyngtoński w St. Louis . Źródło 2008-03-10 .