Aparat wrzecionowy - Spindle apparatus

W biologii komórki The wrzeciona podziałowego (lub mitotycznego wrzeciona ) odnosi się do cytoszkieletu struktury komórek eukariotycznych, który tworzy się podczas podziału komórki , aby oddzielić chromatyd siostrzanych pomiędzy potomnych komórek . Nazywa się to wrzecionem mitotycznym podczas mitozy , procesem, który wytwarza genetycznie identyczne komórki potomne, lub wrzecionem mejotycznym podczas mejozy , procesem, w którym powstają gamety zawierające połowę liczby chromosomów komórki macierzystej.
Oprócz chromosomów aparat wrzeciona składa się z setek białek . Mikrotubule stanowią najliczniejsze elementy maszynerii.
Struktura wrzeciona

W przyłączaniu mikrotubul do chromosomów pośredniczą kinetochory , które aktywnie monitorują tworzenie wrzeciona i zapobiegają przedwczesnemu wystąpieniu anafazy . Polimeryzacja mikrotubuli i depolimeryzacja dynamizują kongresję chromosomów. Depolimeryzacja mikrotubul generuje napięcie w kinetochorach; dwubiegunowe przyłączanie siostrzanych kinetochorów do mikrotubul emanujących z przeciwnych biegunów komórek, pary przeciwstawne siłom napięcia, wyrównujące chromosomy na równiku komórkowym i przygotowujące je do segregacji do komórek potomnych. Gdy każdy chromosom jest zorientowany dwukierunkowo, rozpoczyna się anafaza i kohezyna , która łączy chromatydy siostrzane , zostaje odcięta, umożliwiając przejście chromatyd siostrzanych do przeciwnych biegunów.
Komórkowy aparat wrzeciono zawiera wrzeciono mikrotubule , związane białka, które zawierają kinezyny i dyneiny silniki molekularne skondensowanych chromosomów i wszelkie centrosomów lub astry , które mogą być obecne na biegunach wrzeciona w zależności od typu komórki. Aparat wrzecionowy ma nieco elipsoidalny przekrój i zwęża się na końcach. W szerokiej środkowej części, zwanej środkową strefą wrzeciona, antyrównoległe mikrotubule są wiązane przez kinezyny . Na spiczastych końcach, znanych jako bieguny wrzeciona, mikrotubule są zarodkowane przez centrosomy w większości komórek zwierzęcych. Wrzeciona acentrosomalne lub anastralne nie mają odpowiednio centrosomów lub astrów na biegunach wrzeciona i występują na przykład podczas mejozy u samic u większości zwierząt. W tym przypadku gradient Ran GTP jest głównym regulatorem organizacji i montażu mikrotubul wrzeciona. U grzybów między korpusami biegunów wrzeciona osadzonymi w otoczce jądrowej tworzą się wrzeciona , które nie ulegają rozkładowi podczas mitozy.
Białka związane z mikrotubulami i dynamika wrzeciona
Dynamiczne wydłużanie i skracanie mikrotubul wrzeciona, poprzez proces zwany niestabilnością dynamiczną, determinuje w dużej mierze kształt wrzeciona mitotycznego i sprzyja prawidłowemu ustawieniu chromosomów w strefie środkowej wrzeciona. Białka związane z mikrotubulami (MAP) łączą się z mikrotubulami w strefie środkowej i biegunach wrzeciona, aby regulować ich dynamikę. γ-tubulina jest wyspecjalizowanym wariantem tubuliny, który łączy się w kompleks pierścieniowy zwany γ-TuRC, który zarodkuje polimeryzację heterodimerów α/β tubuliny w mikrotubule. Rekrutacja γ-TurRC do regionu pericentrosomalnego stabilizuje końce ujemne mikrotubul i zakotwicza je w pobliżu centrum organizującego mikrotubule . Białko związane z mikrotubulami Augmin działa w połączeniu z γ-TURC, tworząc zarodki mikrotubul z istniejących mikrotubul.
Rosnące końce mikrotubul są chronione przed katastrofą dzięki działaniu białek śledzących mikrotubule na końcach dodatnich (+TIPs), aby promować ich powiązanie z kinetochorami w strefie środkowej. Wykazano, że CLIP170 lokalizuje się w pobliżu końców dodatnich mikrotubul w komórkach HeLa i gromadzi się w kinetochorach podczas prometafazy . Chociaż sposób rozpoznawania końców dodatnich przez CLIP170 pozostaje niejasny, wykazano, że jego homologi chronią przed katastrofą i sprzyjają ratowaniu, co sugeruje rolę CLIP170 w stabilizowaniu końców dodatnich i prawdopodobnie pośredniczeniu w ich bezpośrednim przyłączeniu do kinetochorów. Wykazano również, że białka związane z CLIP, takie jak CLASP1 u ludzi, lokalizują się na końcach dodatnich i zewnętrznym kinetochorze, a także modulują dynamikę mikrotubul kinetochorowych (Maiato 2003). Homologi CLASP w Drosophila , Xenopus i drożdżach są wymagane do prawidłowego montażu wrzeciona; u ssaków CLASP1 i CLASP2 przyczyniają się do prawidłowego montażu wrzeciona i dynamiki mikrotubul w anafazie. Polimeryzacja końca dodatniego może być dalej moderowana przez białko EB1, które bezpośrednio wiąże rosnące końce mikrotubul i koordynuje wiązanie innych +TIP.
Działaniu tych białek stabilizujących mikrotubule przeciwstawia się szereg czynników depolimeryzujących mikrotubule, które umożliwiają dynamiczną przebudowę wrzeciona mitotycznego w celu promowania kongresji chromosomów i osiągnięcia dwubiegunowości . Kinezyny -13 nadrodziną MAP zawiera klasę białek motorycznych oraz półki skierowane związanego z aktywnością depolimeryzacji mikrotubul w tym dobrze poznanych ssaków MCAK i Xenopus XKCM1. MCAK lokalizuje się na rosnących końcach mikrotubul w kinetochorach, gdzie może wywołać katastrofę w bezpośredniej konkurencji ze stabilizującą aktywnością +TIP. Białka te wykorzystują energię hydrolizy ATP do indukowania destabilizujących zmian konformacyjnych w strukturze protofilamentów, które powodują uwalnianie kinezyn i depolimeryzację mikrotubul. Utrata ich aktywności skutkuje licznymi defektami mitotycznymi. Dodatkowe białka destabilizujące mikrotubule obejmują Op18/ statminę i kataninę, które odgrywają rolę w przebudowie wrzeciona mitotycznego, jak również w promowaniu segregacji chromosomów podczas anafazy.
Aktywność tych MAP jest dokładnie regulowana, aby utrzymać odpowiednią dynamikę mikrotubul podczas montażu wrzeciona, przy czym wiele z tych białek służy jako substraty kinaz typu Aurora i Polo .
Organizowanie aparatu wrzeciona
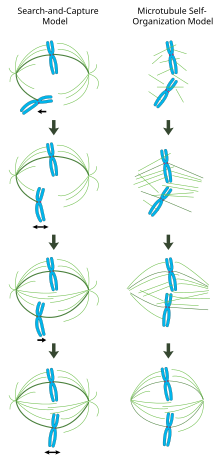
W prawidłowo uformowanym wrzecionie mitotycznym chromosomy dwukierunkowe są wyrównane wzdłuż równika komórki z mikrotubulami wrzeciona zorientowanymi mniej więcej prostopadle do chromosomów, ich końce dodatnie są osadzone w kinetochorach, a końce ujemne zakotwiczone na biegunach komórki. Dokładna orientacja tego kompleksu jest wymagana do zapewnienia dokładnej segregacji chromosomów i określenia płaszczyzny podziału komórki. Jednak pozostaje niejasne, w jaki sposób zorganizowane zostanie wrzeciono. W tej dziedzinie dominują dwa modele, które są synergiczne i nie wykluczają się wzajemnie. W modelu wyszukiwania i przechwytywania wrzeciono jest głównie zorganizowane przez separację w kierunku biegunów centrów organizujących mikrotubule centrosomalne (MTOC). Mikrotubule wrzecionowe emanują z centrosomów i „wyszukują” kinetochory; kiedy wiążą się z kinetochorem, stabilizują się i wywierają napięcie na chromosomy. W alternatywnym modelu samoorganizacji mikrotubule przechodzą nukleację acentrosomalną wśród skondensowanych chromosomów. Mikrotubule, ograniczone wymiarami komórkowymi, bocznymi powiązaniami z antyrównoległymi mikrotubulami poprzez białka motoryczne oraz przyłączeniami do kinetochorów, naturalnie przyjmują strukturę podobną do wrzeciona z chromosomami ustawionymi wzdłuż równika komórkowego.
Model „wyszukiwania i przechwytywania” za pośrednictwem centrosomów
W tym modelu mikrotubule są zarodkowane w centrach organizujących mikrotubule i ulegają szybkiemu wzrostowi i katastrofie, aby "przeszukać" cytoplazmę w poszukiwaniu kinetochorów. Gdy zwiążą kinetochor, zostają ustabilizowane, a ich dynamika zmniejszona. Nowo zorientowany monochromos oscyluje w przestrzeni w pobliżu bieguna, do którego jest przymocowany, aż mikrotubula z przeciwnego bieguna zwiąże siostrzany kinetochor. To drugie mocowanie dodatkowo stabilizuje mocowanie kinetochoru do wrzeciona mitotycznego. Stopniowo dwu-zorientowany chromosom jest przyciągany w kierunku środka komórki, aż napięcie mikrotubul zostanie wyrównane po obu stronach centromeru ; kongresowy chromosom następnie oscyluje na płytce metafazowej, aż początek anafazy uwolni kohezję siostrzanych chromatyd.
W tym modelu centra organizujące mikrotubule są zlokalizowane na biegunach komórki, a ich separacja jest napędzana przez polimeryzację mikrotubul i "przesuwanie" mikrotubul przeciwrównoległych względem siebie w strefie środkowej wrzeciona za pośrednictwem dwubiegunowych kinezyn skierowanych w stronę dodatniego końca. Takie siły ślizgowe mogą odpowiadać nie tylko za separację biegunów wrzeciona na wczesnym etapie mitozy, ale także wydłużenie wrzeciona podczas późnej anafazy.
Samoorganizacja wrzeciona mitotycznego za pośrednictwem chromatyny
W przeciwieństwie do mechanizmu wyszukiwania i przechwytywania, w którym centrosomy w dużej mierze dyktują organizację wrzeciona mitotycznego, model ten sugeruje, że mikrotubule są jądrzaste acentrosomalnie w pobliżu chromosomów i spontanicznie łączą się w wiązki przeciwrównoległe i przyjmują strukturę podobną do wrzeciona. Klasyczne eksperymenty Healda i Karsenti pokazują, że wokół kulek pokrytych DNA inkubowanych w ekstraktach jaj Xenopus tworzą się funkcjonalne wrzeciona i jądra mitotyczne, a dwubiegunowe układy mikrotubul tworzą się przy braku centrosomów i kinetochorów. Rzeczywiście, wykazano również, że ablacja laserowa centrosomów w komórkach kręgowców nie hamuje ani montażu wrzeciona, ani segregacji chromosomów. Zgodnie z tym schematem kształt i wielkość wrzeciona mitotycznego są funkcją biofizycznych właściwości sieciujących białek motorycznych.
Zarodkowanie mikrotubul za pośrednictwem chromatyny przez gradient Ran GTP
Czynnik wymiany nukleotydów guaninowych dla małej GTPazy Ran (Regulator kondensacji chromosomów 1 lub RCC1 ) jest przyłączony do nukleosomów poprzez histony rdzeniowe H2A i H2B. Tak więc gradient Ran związanego z GTP jest generowany wokół sąsiedztwa mitotycznej chromatyny. Kulki szklane pokryte RCC1 indukują zarodkowanie mikrotubul i tworzenie dwubiegunowego wrzeciona w ekstraktach jaj Xenopus , ujawniając, że sam gradient Ran GTP jest wystarczający do złożenia wrzeciona. Gradient wyzwala uwalnianie czynników montażu wrzeciona (SAF) z hamujących interakcji za pośrednictwem białek transportowych importyny β/α. Niezwiązane SAF promują następnie nukleację mikrotubul i stabilizację wokół chromatyny mitotycznej, a dwubiegunowość wrzeciona jest organizowana przez białka motoryczne mikrotubul.
Regulacja zespołu wrzeciona
Montaż wrzeciona jest w dużej mierze regulowany przez zdarzenia fosforylacji katalizowane przez kinazy mitotyczne. Kompleksy kinaz zależnych od cykliny (CDK) są aktywowane przez cykliny mitotyczne, których translacja wzrasta podczas mitozy. CDK1 (zwany także CDC2) jest uważany za główną kinazę mitotyczną w komórkach ssaków i jest aktywowany przez cyklinę B1. Kinazy Aurora są wymagane do prawidłowego montażu i separacji wrzeciona. Aurora A łączy się z centrosomami i uważa się, że reguluje wejście mitotyczne. Aurora B jest członkiem chromosomalnego kompleksu pasażerskiego i pośredniczy w przyłączaniu chromosomu do mikrotubuli i kohezji chromatyd siostrzanych. Kinaza polopodobna, znana również jako PLK, zwłaszcza PLK1 odgrywa ważną rolę w utrzymaniu wrzeciona poprzez regulację dynamiki mikrotubul.
Struktura chromosomu mitotycznego
Pod koniec replikacji DNA chromatydy siostrzane są połączone w amorficzną masę splątanego DNA i białka, których podział na każdą komórkę potomną byłby praktycznie niemożliwy. Aby uniknąć tego problemu, wejście mitotyczne powoduje dramatyczną reorganizację zduplikowanego genomu. Chromatydy siostrzane są rozplątane i oddzielone od siebie. Chromosomy również skracają się, do 10 000 razy w komórkach zwierzęcych, w procesie zwanym kondensacją. Kondensacja zaczyna się w profazie, a chromosomy są maksymalnie zagęszczane w struktury w kształcie pręcików do czasu, gdy zostaną ustawione w środku wrzeciona w metafazie. Nadaje to chromosomom mitotycznym klasyczny kształt „X” widoczny w kariotypach , gdzie każda skondensowana chromatyda siostrzana jest połączona na swojej długości przez białka kohezyny i połączona, często blisko środka, w centromerze .
Chociaż te dynamiczne rearanżacje są niezwykle ważne dla zapewnienia dokładnej i wiernej segregacji genomu, nasza wiedza na temat struktury chromosomów mitotycznych pozostaje w dużej mierze niekompletna. Zidentyfikowano jednak kilka konkretnych graczy molekularnych: Topoizomeraza II wykorzystuje hydrolizę ATP do katalizowania dekatenacji splątań DNA, promując rozdzielczość chromatyd siostrzanych. Kondensyny to 5-podjednostkowe kompleksy, które również wykorzystują hydrolizę ATP do promowania kondensacji chromosomów. Eksperymenty z ekstraktami jaj Xenopus wykazały również, że łącznik Histon H1 jest ważnym regulatorem zagęszczenia chromosomów mitotycznych.
Punkt kontrolny montażu wrzeciona mitotycznego
Zakończenie tworzenia się wrzeciona jest kluczowym punktem przejściowym w cyklu komórkowym, zwanym punktem kontrolnym montażu wrzeciona . Jeśli chromosomy nie są prawidłowo przyłączone do wrzeciona mitotycznego do czasu tego punktu kontrolnego, początek anafazy będzie opóźniony. Niepowodzenie tego punktu kontrolnego zespołu wrzeciona może skutkować aneuploidią i może być zaangażowane w starzenie się i powstawanie raka.
Orientacja aparatu wrzeciona

Orientacja podziału komórek ma duże znaczenie dla architektury tkanek, losów komórek i morfogenezy. Komórki mają tendencję do dzielenia się wzdłuż ich długiej osi zgodnie z tak zwaną regułą Hertwiga . Oś podziału komórek jest określona przez orientację aparatu wrzecionowego. Komórki dzielą się wzdłuż linii łączącej dwa centrosomy aparatu wrzeciona. Po uformowaniu aparat wrzecionowy podlega rotacji wewnątrz komórki. Mikrotubule astralne pochodzące z centrosomów docierają do błony komórkowej, gdzie są przyciągane do określonych wskazówek korowych. In vitro rozkład korowych wskazówek ustalany jest przez wzór adhezyjny. Wskaźniki polarności in vivo są określane przez lokalizację połączeń trójkomórkowych zlokalizowanych na wierzchołkach komórek. Przestrzenne rozmieszczenie wskazówek korowych prowadzi do pola siłowego, które determinuje ostateczną orientację aparatu wrzeciona, a następnie orientację podziału komórek.
Zobacz też
Bibliografia
Zewnętrzne linki
-
 Multimedia związane z aparatem wrzeciona w Wikimedia Commons
Multimedia związane z aparatem wrzeciona w Wikimedia Commons
